Зачем врачу нужна биологическая химия
 Скачать 6.47 Mb. Скачать 6.47 Mb.
|
Аминокислоты обладают изомериейИзомерия аминокислот в зависимости от положения аминогруппыВ зависимости от положенияаминогруппы относительно 2-го атома углерода выделяют α-, β-, γ- и другие аминокислоты. 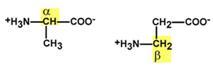 α- и β- формы аланинаДля организма млекопитающих наиболее характерны α-аминокислоты. Изомерия по абсолютной конфигурацииПо абсолютной конфигурации молекулы выделяют D- и L-формы. Различия между изомерами связаны с взаимным расположением четырех замещающих групп, находящихся в вершинах воображаемого тетраэдра, центром которого является атом углерода в α-положении. Имеется только два возможных расположения химических групп вокруг него. 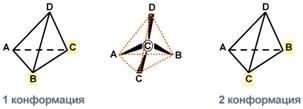 Две конформации тетраэдраВ белке любого организма содержится только один стереоизомер, для млекопитающих это L-аминокислоты.  L- и D-формы аланинаОднако оптические изомеры претерпевают самопроизвольную неферментативную рацемизацию, т.е. L-форма переходит в D-форму. Данное обстоятельство используется для определения возраста, например, костной ткани зуба (в криминалистике, археологии). Деление изомеров по оптической активностиПо оптической активности аминокислоты делятся на право- и левовращающие. Наличие в аминокислоте ассиметричного α-атома углерода (хирального центра) делает возможным только два расположения химических групп вокруг него. Это приводит к особому отличию веществ друг от друга, а именно – изменению направления вращения плоскости поляризации поляризованного света, проходящего через раствор. Величину угла поворота определяют при помощи поляриметра. В соответствии с углом поворота выделяют правовращающие (+) и левовращающие (–) изомеры. 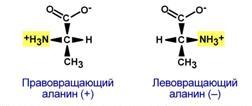 Право- и левовращающие формы аланинаДеление на L- и D-формы не соответствует делению на право- и левовращающие. Для одних аминокислот L-формы (или D-формы) являются правовращающими, для других – левовращающими. Например, L-аланин – правовращающий, а L-фенилаланин – левовращающий. При смешивании L- и D-форм одной аминокислоты образуется рацемическая смесь, не обладающая оптической активностью. Для аминокислот характерна амфотерностьОсновным физико-химическим свойством аминокислот является амфотерность. Понятие амфотерность означает, что вещество сочетает в себе свойства как кислот, так и оснований. В водном растворе аминокислоты одновременно ведут себя как кислоты – доноры протонов и как основания – акцепторы протонов. Если общий заряд аминокислоты равен 0, то это ее состояние называют изоэлектрическим. Величина рН, при которой заряд аминокислоты равен 0, называется изоэлектрической точкой (ИЭТ, pI). Значение изоэлектрической точки зависит от строения радикала аминокислоты:
Зарядаминокислот зависит от величины рН среды и от строения их радикала. При снижении концентрации ионов водорода в растворе (защелачивание среды) повышается их отрыв от аминогруппы и карбоксигруппы аминокислот. Иными словами, от аминокислоты отрывается положительный заряд и она становится отрицательно заряженной. Когда рН снижается (закисление среды), то имеющиеся в растворе ионы Н+ присоединяются к амино- и карбоксигруппам – заряд становится положительным. Отправным пунктом для понимания причин появления заряда у конкретной аминокислоты является величина изоэлектрической точки. К сказанному абзацем выше необходимо добавить одну очень существенную вещь – изменение рН рассматривается относительно изоэлектрической точки. Если рН ниже ИЭТ – заряд аминокислоты становится положительным, если рН выше – отрицательным. 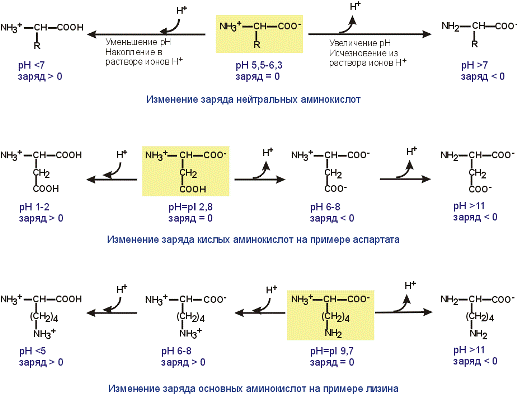 Изменение заряда аминокислот при смещении рН раствора |
