Зачем врачу нужна биологическая химия
 Скачать 6.47 Mb. Скачать 6.47 Mb.
|
Существуют 4 типа дезаминированияПревращение аминокислот с участиемNH2-группы сводится к ее отщеплению от углеродного скелета – реакции дезаминирования. Типы дезаминирования
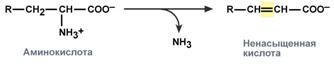
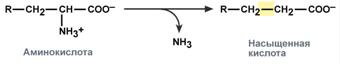
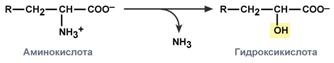
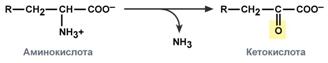 У человекаокислительное дезаминирование является основным путем катаболизма аминокислот. Однако такие аминокислоты как серини гистидинмогут терять аминогруппу с использованием других типов дезаминирования, а треонинсразу подвергается прямому расщеплению до глицина и ацетальдегида. Катаболизм аминокислот начинается с удаления аминогруппыУ человека основным способом дезаминирования является окислительное дезаминирование. Выделяют два варианта окислительного дезаминирования: прямоеи непрямое. Прямое окислительное дезаминированиеПрямое дезаминирование катализируется одним ферментом, в результате образуется NH3 и кетокислота. Прямое окислительное дезаминирование может идти в присутствии кислорода (аэробное) и не нуждаться в кислороде (анаэробное). 1. Аэробное прямое окислительное дезаминирование катализируется оксидазами D-аминокислот (D-оксидазы) в качестве кофермента использующими ФАД, и оксидазами L-аминокислот (L-оксидазы) с коферментом ФМН. В организме человека эти ферменты присутствуют, но практически неактивны. 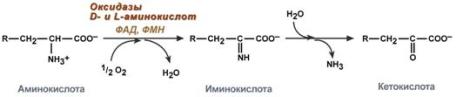 Реакция, катализируемая оксидазами D- и L-аминокислот2. Анаэробное прямое окислительное дезаминирование существует только для глутаминовой кислоты, катализируется только глутаматдегидрогеназой, превращающей глутамат в α-кетоглутарат. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма (кроме мышечных). Этот тип дезаминирования теснейшим образом связан с трансаминированиемаминокислот и формирует с ним процесс трансдезаминирования (см ниже). 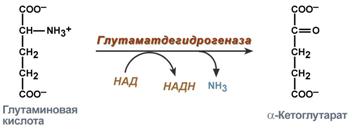 Реакция прямого окислительного дезаминирования |
| | |
Непрямое окислительное дезаминирование (трансдезаминирование)
Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма.
Первый этап заключается в обратимом переносе NH2-группы с аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты – этот перенос называется трансаминированиеиего механизм довольно сложен.
В качестве кетокислоты-акцептора ("кетокислота 2") в организме обычно используется α-кетоглутаровая кислота, которая превращается в глутамат("аминокислота 2").
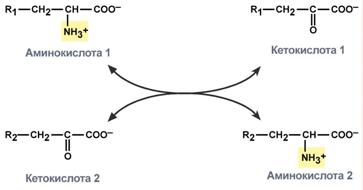
Схема реакции трансаминирования
В результате трансаминирования свободные аминокислоты теряют α-NH2-группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в цикл трикарбоновых кислот и тканевое дыхание, где сгорает до СО2 и Н2О. При необходимости (например, голодание) углеродный скелет глюкогенных аминокислот может использоваться для синтеза глюкозы вглюконеогенезе.
Второй этап состоит в отщеплении аминогруппы от аминокислоты 2 – дезаминирование. В организме человека дезаминированию подвергается только глутаминовая кислота. Второй этап осуществляется глутаматдегидрогеназой (перейти вверх).
В организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, и только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты. Фермент глутаматдегидрогеназаимеется в митохондриях всех клеток организма, кроме мышечных.
Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называюттрансдезаминирование.
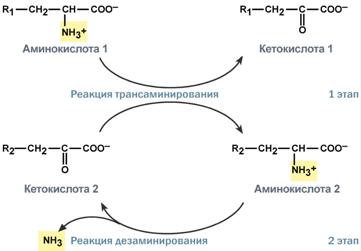
Схема обоих этапов трансдезаминирования
Если реакция идет в митохондриях печени, аммиак используется для синтеза мочевины, которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза.
Так как НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН.
Роль трансаминирования и трансдезаминирования
Реакции трансаминирования:
активируются в печени, мышцах и других органах при поступлении в клетку избыточного количества тех или иных аминокислот – с целью оптимизации их соотношения,
обеспечивают синтез заменимых аминокислот в клетке при наличии их углеродного скелета (кетоаналога),
начинаются при прекращении использования аминокислот на синтез азотсодержащих соединений (белков, креатина, фосфолипидов, пуриновых и пиримидиновых оснований) – с целью дальнейшего катаболизма их безазотистого остатка и выработки энергии,
необходимы при внутриклеточном голодании, например, при гипогликемиях различного генеза – для использования безазотистого остатка аминокислот в печенидля кетогенеза и глюконеогенеза, вдругих органах – для его прямого вовлечения в реакции цикла трикарбоновых кислот.
при патологиях (сахарный диабет, гиперкортицизм) обуславливают наличие субстратов дляглюконеогенеза и способствуют патологической гипергликемии.
Продукт трансаминирования глутаминовая кислота:
является одной из транспортных форм аминного азота в гепатоциты,
способна реагировать со свободным аммиаком, обезвреживая его.
Процесс трансдезаминирования идет в организме непрерывно, потому что:
сопряженные реакции трансаминирования и дезаминирования создают поток лишнего аминного азота из периферических клеток в печень для синтеза мочевины и в почки для синтеза аммонийных солей.
