Зачем врачу нужна биологическая химия
 Скачать 6.47 Mb. Скачать 6.47 Mb.
|
Белки отличаются друг от другаБлагодаря необъятному количеству возможных комбинаций при синтезе белка из 20 аминокислот существует множество разнообразных аминокислотных последовательностей, каждая из которых потенциально соответствует определенному белку. Все эти белки легко сгруппировать по отдельным классам, выделяя определенный признак – функцию или особенности строения. Классификация по функцииВ соответствии с биологическими функциями выделяют:
Классификация по строению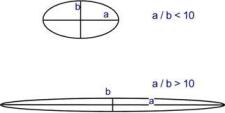 В зависимости от формы молекулы выделяют глобулярные и фибриллярные белки. В глобулярных белках соотношение продольной и поперечной осей составляет <10 и в большинстве случаев не более 3-4. Эти белки характеризуютсякомпактнойтрехмерной укладкой полипептидных цепей. Например: инсулин, альбумин, глобулины плазмы крови. Фибриллярные белки имеют соотношение осей более 10. Они состоят из пучков полипептидных цепей, спиралью навитых друг на друга и связанные между собой поперечными ковалентными и водородными связями. Выполняют защитную и структурную функции. Например: кератин, миозин, коллаген. В зависимости от формы молекулы выделяют глобулярные и фибриллярные белки. В глобулярных белках соотношение продольной и поперечной осей составляет <10 и в большинстве случаев не более 3-4. Эти белки характеризуютсякомпактнойтрехмерной укладкой полипептидных цепей. Например: инсулин, альбумин, глобулины плазмы крови. Фибриллярные белки имеют соотношение осей более 10. Они состоят из пучков полипептидных цепей, спиралью навитых друг на друга и связанные между собой поперечными ковалентными и водородными связями. Выполняют защитную и структурную функции. Например: кератин, миозин, коллаген.По количеству белковых цепейв одной молекуле выделяют мономерные белки, которые имеют одну субъединицу (протомер) и полимерные белки, имеющие несколько субъединиц. Например, к мономерным белкам относятся альбумин, миоглобин, к полимерным - гемоглобин (4 субъединицы), лактатдегидрогеназа (4 субъединицы), креатинкиназа (2 субъединицы), По химическому составувсе белки подразделяют на простыеи сложные. Простые белки содержат в структуре только аминокислоты (альбумины, глобулины, гистоны, протамины). Сложные белки, кроме аминокислот, имеют небелковые компоненты (нуклеопротеины, фосфопротеины, металлопротеины, липопротеины, хромопротеины, гликопротеины). Простых белков немногоСтруктура простых белков представлена только полипептидной цепью (альбумин, инсулин). Однако необходимо понимать, что многие простые белки (например, альбумин) не существуют в "чистом" виде, они всегда связаны с какими-либо небелковыми веществами. Их относят к простым белкам только по той причине, что связи с небелковой группой слабые. АльбуминыАльбумины – это группа схожих белков плазмы крови с молекулярной массой около 40 кДа, содержат много глутаминовой кислоты и поэтому имеют кислые свойства и высокий отрицательный заряд при физиологических рН. Легко адсорбируют полярные и неполярные молекулы, являются,белком-транспортером в крови для многих веществ, в первую очередь для билирубина и длинноцепочечных жирных кислот. ГлобулиныГруппа разнообразных белков плазмы крови с молекулярной массой до 100 кДа, слабокислыеилинейтральные. Они слабо гидратированы, по сравнению с альбуминами меньше устойчивы в растворе и легче осаждаются, что используется в клинической диагностике в "осадочных" пробах (тимоловая,Вельтмана). Часто содержат углеводные компоненты. При электрофорезе глобулины сыворотки крови разделяются, как минимум, на 4 фракции – α1-глобулины,α2-глобулины, β-глобулины и γ-глобулины. 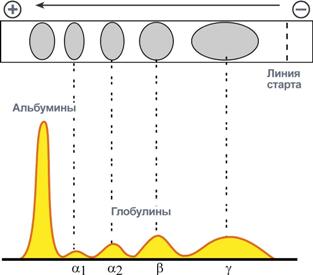 Картина электрофореза белков сыворотки кровиТак как глобулины включают в себя разнообразные белки, то их функции многочисленны. Часть α-глобулинов обладает антипротеазной активностью, что защищает белки крови от преждевременного разрушения, например, α1-антитрипсин, α1-антихимотрипсин, α2-макроглобулин. Некоторые глобулины способны к связыванию определенных веществ: трансферрин(переносит ионы железа), церулоплазмин(содержит ионы меди), гаптоглобин(переносчик гемоглобина), гемопексин(транспорт гема). γ-Глобулины являются антителами и обеспечивают иммунную защиту организма. Гистоны
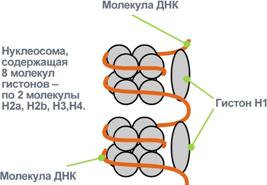
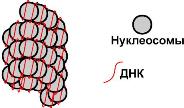
Гистоны – внутриядерные белки массой около 24 кДа. Обладают выраженными основными свойствами, поэтому при физиологических значениях рН заряжены положительно и связываются с дезоксирибонуклеиновой кислотой (ДНК), образуя дезоксирибонуклеопротеины. Существуют 5 типов гистонов – очень богатый лизином (29%) гистон Н1, другие гистоны Н2а, H2b, НЗ, Н4 богаты лизином и аргинином (в сумме до 25%). Радикалы аминокислот в составе гистонов могут быть метилированы, ацетилированы или фосфорилированы. Это изменяет суммарный заряд и другие свойства белков. Можно выделить две функции гистонов: 1. Регуляция активности генома, а именно – они препятствуют транскрипции. 2. Структурная – стабилизируют пространственную структуру ДНК. Гистоны в комплексе с ДНК образуют нуклеосомы – октаэдрические структуры, составленные из гистонов Н2а, H2b, НЗ, Н4. Между нуклеосомами располагается гистон H1, также связанный с молекулой ДНК. ДНК обвивает нуклеосому 2,5 раза и переходит к гистону H1, после чего обвивает следующую нуклеосому. Благодаря такой структуре достигается уменьшение размеров ДНК в 7 раз. Далее нить ДНК с нуклеосомами складывается в суперспиральи суперсуперспираль. Таким образом, гистоны участвуют в плотной упаковке ДНК при формировании хромосом. Например, благодаря гистонам в конечном итоге размеры ДНК уменьшаются в тысячи раз: длина ДНК достигает 6-9 см (10-1), а размеры хромосом – всего несколько микрометров (10-6). ПротаминыЭто белки массой от 4 кДа до 12 кДа, у ряда организмов (рыбы) они являются заменителями гистонов, есть в спермиях. Отличаются резко увеличенным содержанием аргинина (до 80%). Протамины присутствуют в клетках, не способных к делению. Их функция как у гистонов – структурная. Коллаген
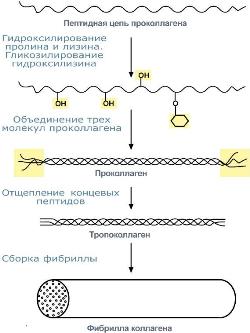
Фибриллярный белок с уникальной структурой. Составляет основу межклеточного вещества соединительной ткани сухожилий, кости, хряща, кожи, но имеется, конечно, и в других тканях. Обычно содержит моносахаридные(галактоза) идисахаридные(галактоза-глюкоза) остатки, соединенные с ОН-группами некоторых остатков гидроксилизина. Полипептидная цепь коллагена включает 1000 аминокислот и состоит из повторяющегося триплета [Гли-А-В], где А и В – любые, кроме глицина, аминокислоты. В основном этоаланин, его доля составляет 11%, доля пролинаигидроксипролина– 21%. Таким образом, на другие аминокислоты приходится всего 33%. Структура пролина и гидроксипролина не позволяет образовать α-спиральную структуру, из-за этого образуется левозакрученная спираль, где на один виток приходится 3 аминокислотных остатка. При синтезе коллагена первостепенноезначение имеет гидроксилирование лизина и пролина, включенных в состав первичной цепи, осуществляемое при участии аскорбиновой кислоты. Синтезированная молекула коллагенапостроена из 3 полипептидных цепей, сплетенных между собой в плотный жгут – тропоколлаген (длина 300 нм, диаметр 1,6 нм). Полипептидные цепи прочно связаны между собой через ε-аминогруппы остатков лизина. Тропоколлаген формирует крупные коллагеновые фибриллыдиаметром 10-300 нм. Поперечная исчерченность фибриллы обусловлена смещением молекул тропоколлагена друг относительно друга на 1/4 их длины. В коже фибриллы образуют нерегулярно сплетенную и очень густую сеть. Например, выделанная кожа представляет собой почти чистый коллаген. Эластин
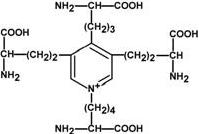
По строению в общих чертах эластин схож с коллагеном. Находится в связках, эластичном слое сосудов. Структурной единицей является тропоэластинс молекулярной массой 72 кДа и длиной 800 аминокислотных остатков. В нем гораздо больше лизина, валина, аланина и меньше гидроксипролина. Отсутствие пролина обуславливает наличие спиральных эластичных участков. Характерной особенностью эластина является наличие своеобразной структуры – десмозина, который своими 4-мя группами объединяет белковые цепи в системы, способные растягиваться во всех направлениях. α-Аминогруппы и α-карбоксильные группы десмозина включаются в образование пептидных связей одного или нескольких белков. 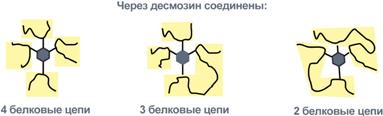 Роль десмозина в соединении белковУ сложных белков есть лиганды У сложных белков, кроме белковой цепи, имеется дополнительная небелковая группа. Она называетсялиганд (лат. ligo - связываю), то есть молекула, связанная с белком. В случае если лиганд несет структурную и/или функциональную нагрузку, он называется простетической группой. В роли лиганда могут выступать любые молекулы:
Узнавание лиганда обеспечивается:
Функции лиганда в составе сложного белка разнообразны:
| ||||||||||