Зачем врачу нужна биологическая химия
 Скачать 6.47 Mb. Скачать 6.47 Mb.
|
Ферменты имеют белковую природуДавно выяснено, что все ферменты являются белками и обладают всеми свойствами белков. Поэтому подобно белкам ферменты делятся на простые и сложные. Простые ферменты состоят только из аминокислот – например, пепсин, трипсин, лизоцим. Сложные ферменты (холоферменты) имеют в своем составе белковую часть, состоящую из аминокислот –апофермент, и небелковую часть – кофактор. Кофактор, в свою очередь, может называться коферментомили простетическойгруппой. Примером могут быть сукцинатдегидрогеназа(содержит ФАД) (в цикле трикарбоновых кислот), аминотрансферазы(содержат пиридоксальфосфат) (функция), пероксидаза(содержит гем). Для осуществления катализа необходим полноценный комплекс апобелка и кофактора, по отдельности катализ они осуществить не могут. Как многие белки, ферменты могут быть мономерами, т.е. состоят из одной субъединицы, и полимерами, состоящими из нескольких субъединиц. Структурно-функциональная организация ферментовВ составе фермента выделяют области, выполняющие различную функцию: 1. Активный центр – комбинация аминокислотных остатков (обычно 12-16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ. Аминокислотные радикалы в активном центре могут находиться в любом сочетании, при этом рядом располагаются аминокислоты, значительно удаленные друг от друга в линейной цепи. У ферментов, имеющих в своем составе несколько мономеров, может быть несколько активных центров по числу субъединиц. Также две и более субъединицы могут формировать один активный центр. У сложных ферментов в активном центре обязательно расположены функциональные группы кофактора. В свою очередь в активном центре выделяют два участка:
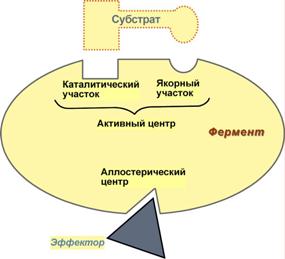 Схема строения ферментов2. Аллостерический центр(allos – чужой) – центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы (называемой активатором или ингибитором, а также эффектором, модулятором, регулятором) вызывает изменение конфигурации белка-фермента и, как следствие, скорости ферментативной реакции. В качестве такого регулятора может выступать продукт данной или одной из последующих реакций, субстрат реакции или иное вещество (см "Регуляция активности ферментов"). Аллостерические ферменты являются полимерными белками, активный и регуляторный центры находятся в разных субъединицах. ИзоферментыИзоферменты – это молекулярные формы одного и того же фермента, возникшие в результате небольших генетических различий в первичной структуре фермента. Различные изоферменты определяют скорость и направление реакции благодаря разному сродству к субстрату. Например, димерный фермент креатинкиназа(КК) представлен тремя изоферментными формами, составленными из двух типов субъединиц: M (англ. muscle – мышца) и B (англ. brain – мозг). Креатинкиназа-1 состоит из субъединиц типа B и локализуется в головном мозге, креатинкиназа-2 – по одной М и В субъединице, активна в миокарде, креатинкиназа-3 содержит две М-субъединицы, специфична для скелетной мышцы.
Также существует пять изоферментов лактатдегидрогеназы(роль ЛДГ) – фермента, участвующего в обмене глюкозы. Отличия между ними заключаются в разном соотношении субъединиц Н (англ. heart – сердце) и М (англ. muscle – мышца). Лактатдегидрогеназы типов 1 (Н4) и 2 (H3M1) присутствуют в тканях с аэробнымобменом (миокард, мозг, корковый слой почек), обладают высоким сродством к молочной кислоте (лактату) и превращают его в пируват. ЛДГ-4 (H1M3) и ЛДГ-5 (М4) находятся в тканях, склонных к анаэробномуобмену (печень, скелетные мышцы, кожа, мозговой слой почек), обладают низким сродством к лактату и катализируют превращение пирувата в лактат. В тканях с промежуточнымтипом обмена (селезенка, поджелудочная железа, надпочечники, лимфатические узлы) преобладает ЛДГ-3 (H2M2). |

