Зачем врачу нужна биологическая химия
 Скачать 6.47 Mb. Скачать 6.47 Mb.
|
Переваривание белков начинается в желудкеРасщепление белков до аминокислот начинается в желудке, продолжается в двенадцатиперстной кишке и заканчивается в тонком кишечнике. В некоторых случаях распад белков и превращения аминокислот могут происходить также в толстом кишечнике под влиянием микрофлоры. Протеолитические ферменты подразделяют по особенности их действия на экзопептидазы, отщепляющие концевые аминокислоты, и эндопептидазы, действующие на внутренние пептидные связи. В желудке пища подвергается воздействию желудочного сока, включающего соляную кислоту и ферменты. К ферментам желудка относятся две группы протеаз с разным оптимумом рН, которые упрощенно называютпепсин и гастриксин. У грудных детей основным ферментом является реннин.Регуляция желудочного пищеваренияРегуляция осуществляется нервными (условные и безусловные рефлексы) и гуморальными механизмами. К гуморальным регуляторам желудочной секреции относятся гастрини гистамин. Гастринстимулирует главные, обкладочные и добавочные клетки, что вызывает секрецию желудочного сока, в большей мере соляной кислоты. Также он обеспечивает секрецию гистамина. Гастрин выделяется специфичными G-клетками:
Гистамин, образующийся в энтерохромаффиноподобных клетках (ECL-клетки, принадлежат фундальным железам) слизистой оболочки желудка, взаимодействует с Н2-рецепторами на обкладочных клетках желудка, увеличивает в них синтез и выделение соляной кислоты. Закисление желудочного содержимого подавляет активность G-клеток и по механизму обратной отрицательной связи снижает секрецию гастрина и желудочного сока. Соляная кислотаОдним из компонентов желудочного сока является соляная кислота. В образовании соляной кислоты принимают участие париетальные (обкладочные) клетки желудка, образующие ионы Н+. Источником ионов Н+ является угольная кислота, образуемая ферментом карбоангидразой. При ее диссоциациии , кроме ионов водорода, образуются карбонат-ионы НСО3–. Они по градиенту концентрации движутся в кровьв обмен на ионы Сl–. В полость желудкаионы Н+ попадают энергозависимым антипортом с ионами К+ (Н+,К+-АТФаза), хлорид-ионы перекачиваются в просвет желудка также с затратой энергии. При нарушении нормальной секреции HCl возникают гипоацидныйили гиперацидныйгастрит, отличающиеся друг от друга по клиническим проявлениям, последствиям и требуемой схеме лечения. 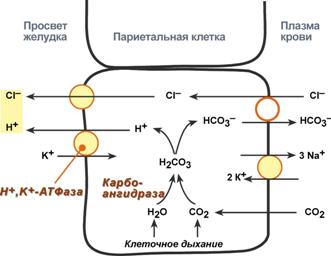 Синтез соляной кислотыФункции соляной кислоты
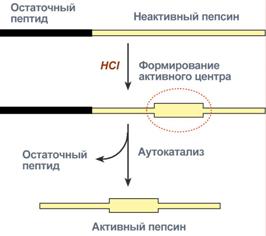
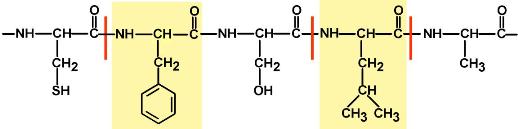
ПепсинПепсин является эндопептидазой, то есть он расщепляет внутренние пептидные связи в молекулах белков и пептидов. Синтезируется в главных клетках желудка в виде неактивного проферментапепсиногена, в котором активный центр "прикрыт" N-концевым фрагментом. При наличии соляной кислоты конформация пепсиногена изменяется таким образом, что "раскрывается" активный центр фермента, который отщепляет остаточный пептид (N-концевой фрагмент), т.е. происходит аутокатализ. В результате образуется активный пепсин, активирующий и другие молекулы пепсиногена.
Оптимум рН для пепсина 1,5-2,0. Пепсин, не обладая высокой специфичностью, гидролизует пептидные связи, образованные аминогруппами ароматическихаминокислот (тирозина, фенилаланина, триптофана), аминогруппами и карбоксигруппами лейцина, глутаминовой кислоты и т.д..
ГастриксинЕго оптимум рН соответствует 3,2-3,5. Наибольшее значение этот фермент имеет при питании молочно-растительной пищей, слабо стимулирующей выделение соляной кислоты и одновременно нейтрализующей ее в просвете желудка. Гастриксин является эндопептидазойи гидролизует связи, образованные карбоксильными группами дикарбоновых аминокислот. |