Зачем врачу нужна биологическая химия
 Скачать 6.47 Mb. Скачать 6.47 Mb.
|
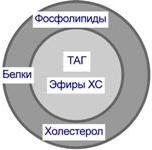
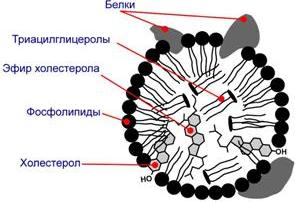
Липопротеины имеют огромное клиническое значениеК липопротеинам, строго говоря, принадлежат только белки, содержащие ковалентно связанные липиды. Однако традиционно к липопротеинам относят и надмолекулярные образования, переносящие липиды в плазме крови, и состоящие из белков и молекул всех классов липидов. Структуру транспортных липопротеинов можно сравнить с орехом, у которых имеется скорлупаи ядро. "Скорлупа" липопротеина является гидрофильной, ядро – гидрофобное. Ядро формируют неполярные эфиры холестерола (ХС) и триацилглицеролы (ТАГ). В поверхностном слое ("скорлупе") находятся фосфолипиды, холестерол, белки. Белки в липопротеинах называются апобелками, их выделяют несколько видов: А, В, С, D. В каждом типе липопротеинов преобладают соответствующие ему апобелки.
Выделяют четыре основных класса липопротеинов:
Концентрация и соотношение в крови тех или иных липопротеинов играют ведущую роль в возникновении такой распространенной сосудистой патологии как атеросклероз. Свойства и функции липопротеинов разных классов зависят от состава, т.е. от соотношения триацилглицеролов, холестерола и его эфиров, фосфолипидов, белков:
Функцией липопротеинов является перенос в крови триацилглицеролов и холестерола и его эфиров. Для гликопротеинов характерна структурная рольКласс под названиемгликопротеиныили, более корректно, гликоконъюгаты– это белки, содержащие углеводный компонент, ковалентно присоединенный к полипептидной основе. Содержание углеводов в них варьирует от 1 до 85% по массе. Выделяют два подкласса белков, содержащих углеводы: протеогликаныи гликопротеины. Между этими подклассами имеются существенные отличия:
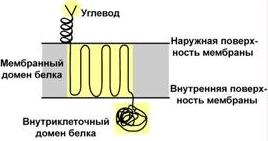
ГликопротеиныДля собственно гликопротеинов характерно низкое содержание углеводов. Они присоединены либо N-гликозидной связью к амидному азоту аспарагина, либо О-гликозидной связью к гидроксигруппе остатка серина, треонина, гидроксилизина. Углевод имеет нерегулярное строение и содержит маннозу, галактозу, глюкозу, их аминопроизводные, N-ацетилнейраминовую кислоту. 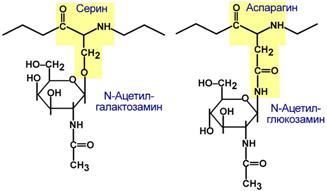 Способ присоединения углевода к белкуФункцией гликопротеинов являются:1. Структурная– клеточная стенка бактерий, костный матрикс, например, коллаген, эластин. 2. Защитная– например, антитела, интерферон, факторы свертывания крови (протромбин, фибриноген).
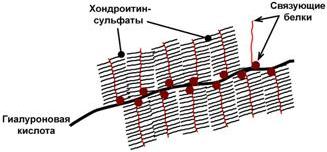
3. Рецепторная– присоединение эффектора приводит к изменению конформации белка-рецептора, что вызывает внутриклеточный ответ. 4. Гормональная– гонадотропный, адренокортикотропный и тиреотропный гормоны. 5. Ферментативная– холинэстераза, нуклеаза. 6. Транспортная– перенос веществ в крови и через мембраны, например, трансферрин, транскортин, альбумин, Na+,К+-АТФаза. ПротеогликаныДругая группа гликоконъюгатов – протеогликаны – характеризуется наличием крупных полисахаридов, состоящих из повторяющихся дисахаридных остатков. Дисахариды включают в себя какую-либо уроновую кислоту и аминосахар. Многократно дублируясь, дисахариды образуют олиго- и полисахаридные цепи – гликаны. Для углеводной части встречаются другие названия – кислые гетерополисахариды(т.к. имеют много кислотных групп), гликозаминогликаны(содержат аминогруппы). Основными представителями гликозаминогликанов являются гиалуроновая кислота,хондроитинсульфаты,кератансульфаты и дерматансульфаты,гепарин. Эти молекулы входят в состав протеогликанов, функцией которых является заполнение межклеточного пространства и удержание здесь воды, также они выступают как смазочный и структурный компонент суставов и других тканевых структур. 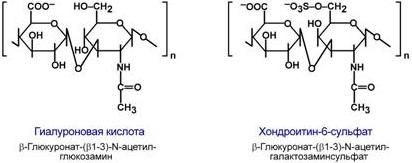 Строение гиалуроновой кислоты и хондроитинсульфатаУглеводная часть, аналогично с гликопротеинами, связывается с белком через остатки серина и аспарагина.
По функциипротеогликаны особенно значимы для межклеточного пространства, особенно соединительной ткани, в которое погружены коллагеновые волокна. При помощи электронной микроскопии выяснено, что они имеют древовидную структуру. Молекулы гликанов весьма гидрофильны, создают сетчатый желеподобный матрикс и заполняют пространство между клетками, являясь преградой для крупных молекул и микроорганизмов. |