1 (1). Первичная структура белка. Зависимость свойств и конформации белков от первичной структуры. Примеры полиморфизма белков, гемоглобин а и F, структурные и функциональные отличия
 Скачать 1.58 Mb. Скачать 1.58 Mb.
|
|
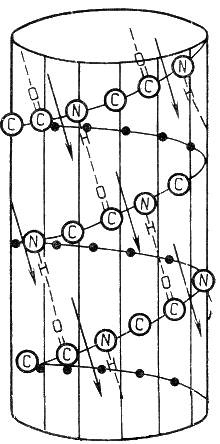
1 (1). Первичная структура белка. Зависимость свойств и конформации белков от первичной структуры. Примеры полиморфизма белков, гемоглобин А и F, структурные и функциональные отличия. Наследственные изменения первичной структуры — молекулярные болезни (серповидно-клеточная анемия). 1. Первичной структурой белка называют последовательность чередования аминокислот в полипептидной цепи. Эту структуру формируют пептидные связи между α-амино- и α-карбоксильными группами аминокислот (см. раздел 1.2 настоящего курса). Первичная структура каждого белка уникальна и запрограммирована генетически. Выяснение аминокислотной последовательности белков представляет интерес по ряду причин. Во-первых, даже небольшие изменения первичной структуры белка в результате генных мутаций могут значительно изменять его свойства. Это приводит к нарушению нормальной функции белка, а следовательно, к развитию заболевания. Примеры заболеваний, развивающихся в результате изменения первичной структуры ферментного белка, будут рассмотрены в 5-й теме настоящего курса. Во-вторых, знание аминокислотной последовательности важно для выяснения молекулярной основы биологической активности белка. В-третьих, сравнительное изучение последовательностей аминокислот в белках позволяет проследить эволюцию форм жизни на молекулярном уровне. В-четвёртых, это необходимо для выяснения тех принципов, на основе которых из полипептидных цепей формируются высокоспецифичные пространственные структуры. Установлено, что последовательность аминокислотных остатков полипептидной цепи белка несёт в себе информацию, необходимую для формирования пространственной структуры белковой молекулы. Процесс сворачивания полипептидной цепи в правильную трёхмерную структуру получил название фолдинг. До последнего времени считалось, что формирование пространственной структуры белка происходит самопроизвольно, в отсутствие каких-либо компонентов. Однако сравнительно недавно выяснилось, что это справедливо только для относительно небольших белков (порядка 100 аминокислотных остатков). Для фолдинга крупных белков необходимы специальные протеины — шапероны, которые создают возможность быстрого формирования правильной пространственной структуры белка. В полипептидной цепи многократно повторяется группа: -NH-CH-CO-. Эта группа формирует пептидный остов. Следовательно, полипептидная цепь состоит из остова (скелета), имеющего регулярную, повторяющуюся структуру, и отдельных боковых цепей R-групп. Первичная структура характеризуется порядком (последовательностью) чередования аминокислот в полипептидной цепи. Даже одинаковые по длине и аминокислотному составу пептиды могут быть разными веществами потому, что последовательность аминокислот в цепи у них разная. Последовательность аминокислот в белке уникальна и детерминируется генами. Даже небольшие изменения первичной структуры могут серьезно изменять свойства белка. Было бы неправильно заключить, что каждый аминокислотный остаток в белке необходим для сохранения нормальной структуры и функции белка. Функциональные свойства белков определяются их конформацией, т.е. расположением полипептидной цепи в пространстве. Уникальность конформации для каждого белка определяется его первичной структурой. В белках различают два уровня конформации пептидной цепи - вторичную и третичную структуру. Вторичная структура белков обусловлена способностью групп пептидной связи к водородным взаимодействиям: C=O....HN. Пептид стремится принять конформацию с максимумом водородных связей. Однако возможность их образования ограничивается тем, что пептидная связь имеет частично двойной характер, поэтому вращение вокруг нее затруднено. Пептидная цепь приобретает не произвольную, а строго определенную конформацию, фиксируемую водородными связями. Известны несколько способов укладки полипептидной цепи: a -спираль - образуется внутрицепочечными водородными связями между NH-группой одного остатка аминокислоты и CO-группой четвертого от нее остатка; b -структура (складчатый лист) - образуется межцепочечными водородными связями или связями между участками одной полипептидной цепи изогнутой в обратном направлении; беспорядочный клубок - это участки, не имеющие правильной, периодической пространственной организации. Но конформация этих участков также строго обусловлена аминокислотной последовательностью. Содержание a -спиралей и b -структур в разных белках различно: у фибриллярных белков - только a -спираль или только b -складчатый лист; а у глобулярных белков - отдельные фрагменты полипептидной цепи: либо a -спираль, либо b -складчатый лист, либо беспорядочный клубок. Третичная структура глобулярных белков представляет ориентацию в пространстве полипептидной цепи, содержащей a -спирали, b -структуры и участки без периодической структуры (беспорядочный клубок). Дополнительное складывание скрученной полипептидной цепи образует компактную структуру. Это происходит, прежде всего, в результате взаимодействия между боковыми цепями аминокислотных остатков. В. Полиморфизм белков Поскольку большинство нормальных клеток человека диплоидны, то они содержат две копии каждой хромосомы, одна из которых получена от отца, а вторая от матери. Эти две копии одной и той же хромосомы называют гомологичными (рис. 4-59). В ДНК каждой хромосомы содержится более тысячи генов. Соответствующие друг другу гены в гомологичных хромосомах называют аллелями. Аллели могут быть идентичными и содержат одинаковую последовательность нуклеотидов. В этом случае индивидуум, имеющий такие аллели, будет гомозиготен по данному признаку. Если аллели различаются по последовательности нуклеотидов в ДНК, то говорят о гетерозиготном наследовании гена. В этом случае индивидуум будет иметь 2 белковых продукта гена, различающихся по аминокислотной последовательности. У каждого человека существует только 2 разных аллеля одного гена, тогда как в популяции людей вариантов аллелей может быть огромное множество. Как уже говорилось ранее, изменчивость структуры ДНК, а следовательно разнообразие аллелей, обусловлено мутационным процессом и рекомбинациями в гомологичных хромосомах половых клеток. Если в ходе мейоза рекомбинации сопровождаются обменом участками ДНК, меньшими по размеру, чем ген, то такой процесс может приводить к появлению новых, прежде не существовавших аллелей. А поскольку рекомбинации - более частые события, чем мутации в кодирующих участках гена, то разнообразие вариантов аллелей обусловлено главным образом ими. Существование в популяции 2 и большего числа аллелей одного гена называют"аллеломорфизм", или "полиморфизм", а белковые продукты, образующиеся в ходе экспрессии этих вариантов гена - "полиморфы". Разные аллели встречаются в популяции с разной частотой. К полиморфам относят только те варианты, распространённость которьж в популяции не меньше 1%. В процессе эволюции отдельные гены амплифицируют с образованием копий, а их структура и положение могут изменяться в результате мутаций и перемещений не только внутри хромосомы, но и между хромосомами. Со временем это приводит к появлению новых генов, кодирующих белки, родственные исходному, но отличающиеся от него определёнными свойствами и занимающие в хромосомах разные генные локусы (или места). К родственным белкам относят изобелки, представляющие собой варианты белков, выполняющие одну и ту же функцию и обнаруживаемые в пределах одного вида организмов. Так, в группе из 2000 генов человека, кодирующих факторы транскрипции и транскрипционные активаторы, идентифицировано 900, относящихся к семейству белков, имеющих "цинковые пальцы". Существует 46 генов фермента глицеральдегид-3-фосфатдегидрогеназы, осуществляющего единственную окислительную реакцию в метаболическом пути катаболизма глюкозы до пирувата. Выявлены семейства родственных белков, возникшие в ходе эволюции из одного "предкового" гена, или гена-предшественника. Такие семейства составляют: 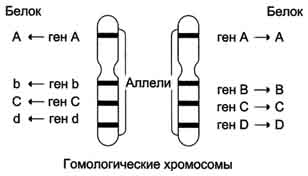 Рис. 4-59. Гомологичные хромосомы и соответствующие аллелям белковые продукты. На рисунке показано расположение 4 аллелей (АА, Bb, CC, dD) на гомологичных хромосомах. Аллели могут быть идентичны, как в случае генов АА и СС, или различаться (Bb, Dd). Белковые продукты будут идентичны для аллелей АА и СС, но будут различаться по аминокислотной последовательности в случае аллелей Bb и Dd. 207
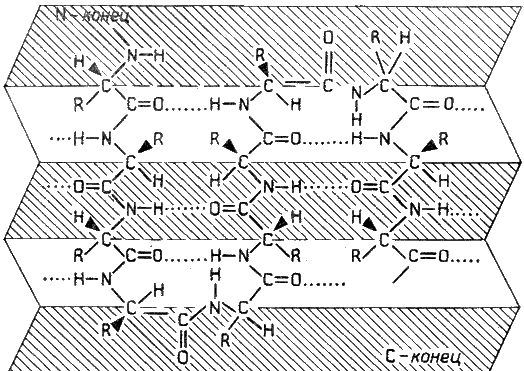
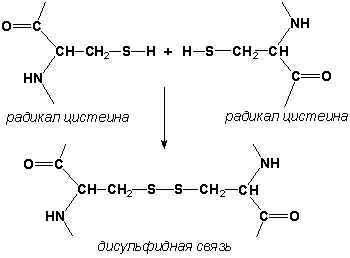
Атом железа расположен в центре гема-пигмента, придающего крови характерный красный цвет. Каждая из 4 молекул гема «обернута» одной полипептидной цепью. В молекуле гемоглобина взрослого человека HbА. (от англ. adult – взрослый) содержатся четыре полипептидные цепи, которые вместе составляют белковую часть молекулы – глобин. Две из них, на- зываемые α-цепями, имеют одинаковую первичную структуру и по 141 аминокислотному остатку. Две другие, обозначаемые β-цепями, также идентично построены и содержат по 146 аминокислотных остатков. Таким образом, вся молекула белковой части гемоглобина состоит из 574 амино- кислот. Во многих положениях α- и β-цепи содержат разные аминокислот- ные последовательности, хотя и имеют почти одинаковые пространствен- ные структуры. Получены доказательства, что в структуре гемоглобинов более 20 видов животных 9 аминокислот в последовательности оказались одинаковыми, консервативными (инвариантными), определяющими функ- ции гемоглобинов; некоторые из них находятся вблизи гема, в составе участка связывания с кислородом, другие – в составе неполярной внутрен- ней структуры глобулы. В дополнение к основному гемоглобину HbA1 в крови взрослого человека доказано существование мигрирующего с меньшей скоростью при электрофорезе гемоглобина НbА2 , также состоящего из 4 субъединиц: двух α-цепей и двух δ-цепей. На долю НbА2 приходится около 2,5% от всего гемоглобина. Известен, кроме того, фетальный гемоглобин (гемоглобин новорожденных), обозначаемый HbF и состоящий из двух α-цепей и двух γ-цепей. Фетальный гемоглобин отличается от HbA1 не только составом аминокислот, но и физико-химическими свойствами: спектральным пока- зателем, электрофоретической подвижностью, устойчивостью к щелочной денатурации и др. Кровь новорожденного содержит до 80% HbF, но к концу 1-го года жизни он почти целиком заменяется на НbА (все же в крови взрослого человека открывается до 1,5% HbF от общего количества гемоглобина). Последовательность аминокислот в γ- и δ-цепях гемогло- бинов окончательно не расшифрована. Болезни гемоглобинов (их насчитывают более 200) называют гемогло- бинозами. Принято делить их на гемоглобинопатии, в основе развития которых лежит наследственное изменение структуры какой-либо цепи 82. Нормальные и серповидные эритроциты. нормального гемоглобина (часто их относят также к «молекулярным болезням»), и талассемии, обусловленные наследственным нарушением синтеза какой-либо нормальной цепи гемоглобина. Различают также же- лезодефицитные анемии. Классическим примером наследственной гемоглобинопатии является серповидно-клеточная анемия, широко распространенная в странах Южной Америки, Африки и Юго-Восточной Азии. При этой патологии эритроциты в условиях низкого парциального давления кислорода прини- мают форму серпа .Гемоглобин S, как показали Л. Полинг и др., отличается рядом свойств от нормального гемоглобина: в частности, после отдачи кислорода в тканях он превращается в плохо растворимую дез- окси-форму и начинает выпадать в осадок в виде веретенообразных кристаллоидов, названных тактоидами. Последние деформируют клетку и приводят к массивному гемолизу. Болезнь протекает остро, и дети, гомозиготные по мутантному гену, часто умирают в раннем возрасте. Химический дефект при серповидно-клеточной анемии был раскрыт В. Ингремом и сводится к замене единственной аминокислоты, а именно глутаминовой, в 6-м положении с N-конца на валин в β-цепях молекулы гемоглобина HbS .Это результат мутации в молекуле ДНК, кодирующей синтез β-цепи гемоглобина. Все остальные аминокис- лоты располагаются в той же последовательности и в таком же количестве, как и в нормальном гемоглобине НЬА: Одной этой замены оказалось достаточно не только для нарушения формы эритроцита, но и для развития тяжелой наследственной болез- ни – серповидно-клеточной анемии 2 (1). Конформация белковой молекулы (вторичная и третичная структу ры). Типы внутримолекулярных связей в белках. Фибриллярные и глобу лярные белки (примеры). Четвертичная структура белка. Примеры строения и функциониро вания олигомерных белков. Вторичная структура белка представляет собой способ свёртывания полипептидной цепи в спиральную или иную конформацию. При этом образуются водородные связи между СО- и NH-группами пептидного остова одной цепи или смежных полипептидных цепей. Известно несколько типов вторичной структуры пептидных цепей, среди которых главными являются α--спираль и β-складчатый слой. α-Спираль - жёсткая структура, имеет вид стержня . Внутреннюю часть этого стержня создаёт туго закрученный пептидный остов, радикалы аминокислот направле ны наружу. При этом CO-группа каждого аминокислотного остатка взаимодействует с NH-группой четвёртого от него остатка. На один виток спирали приходится 3,6 аминокислотных остатка, а шаг спирали составляет 0,54 нм. Некоторые аминокислоты препятствуют свёртыванию цепи в α-спираль, и в месте их расположения непрерывность спирали нарушается. К этим аминокислотам относятся пролин (в нём атом азота входит в состав жёсткой кольцевой структуры и вращение вокруг связи N - Са становится не возможным) , а также аминокислоты с заряженными или объёмными радикалами, которые электростатически или механически препятствуют формированию α-спирали. Β-Складчатый слой отличается от α-спирали тем, что имеет плоскую, а не стержневидную форму. Образуется при помощи водородных связей в пределах одной или нескольких полипептидных цепей. Пептидные цепи могут быть расположены в одном направлении (параллельно) или в противоположных направлениях (антипараллельно) , напоминая меха аккордеона. Боковые радикалы находятся выше и ниже плоскости слоя. Третичная структура белка - это распределение в пространстве всех атомов белковой молекулы, или иначе говоря, пространственная упаковка спирализованной полипептидной цепи. Основную роль в образовании третичной структуры белка играют водородные, ионные, гидрофобные и дисульфидные связи, которые образуются в результате взаимодействия между радикалами аминокислот. Водородные связи образуются между двумя полярными радикалами, один из которых может иметь заряд. Ионные связи могут возникать между противоположно заряженными радикалами. Гидрофобные взаимодействия характерны для неполярных радикалов. Дисульфидные связи образуются между SH-группами двух радикалов цистеина, находящихся в разных участках полипептидной цепи. По форме молекулы и особенностям формирования третичной структуры белки делят на фибриллярные и глобулярные. Фибриллярные белки - имеют нитевидную форму (фибриллы), образуют волокна и пучки волокон. Между соседними полипептидными цепями имеется много поперечных ковалентных сшивок. Нерастворимы в воде. Переходу в раствор препятствуют неполярные радикалы аминокислот и сшивки между пептидными цепями. В организме выполняют главным образом структурную функцию, обеспечивают механическую прочность тканей. Примеры фибриллярных белков: Коллаген - белок соединительной ткани. В его составе преобладают аминокислоты глицин, пролин, гидроксипролин. Эластин - более эластичен, чем коллаген, входит в состав стенок артерий, лёгочной ткани, в его составе преобладают аминокислоты глицин, аланин, валин. Кератин - белок эпидермиса и производных кожи, в его структуре преобладает аминокислота цистеин. Глобулярные белки - имеют сферическую или эллипсовидную форму молекулы (глобула). В процессе образования глобулы гидрофобные радикалы аминокислот погружаются во внутренние области, гидрофильные радикалы располагаются на поверхности молекулы. При взаимодействии с водной фазой полярные радикалы образуют многочисленные водородные связи. Белки удерживаются в растворённом состояния за счёт заряда и гидратной оболочки. В организме глобулярные белки выполняют динамические функции (транспортную, ферментативную, регуляторную, защитную). Примеры глобулярных белков: Альбумин - белок плазмы крови; содержит много остатков глутамата и аспартата; осаждается при 100%-ном насыщении раствора сульфатом аммония. Глобулины - белки плазмы крови; по сравнению с альбумином обладают большей молекулярной массой и содержат меньше остатков глутамата и аспартата, осаждаются при 50%-ном насыщении раствора сульфатом аммония. Гистоны - входят в состав ядер клеток, где образуют комплекс с ДНК. Содержат много остатков аргинина и лизина. Молекулярные глобулы ряда белков, таких как иммуноглобулины, состоят из нескольких независимых, компактно свёрнутых фрагментов полипептидной цепи, которые называют доменами. Доменные белки являются как бы переходной формой к следующему уровню структурной организации белка.
|