|
|
1 (1). Первичная структура белка. Зависимость свойств и конформации белков от первичной структуры. Примеры полиморфизма белков, гемоглобин а и F, структурные и функциональные отличия
ОСОБЕННОСТИСТРОЕНИЯИФУНКЦИОНИРОВАНИЯОЛИГОМЕРНЫХБЕЛКОВ
1.Олигомерные белки могут содержать разное количество протомеров (например, димеры, тетра-меры, гексамеры и т. д.).
2. В состав олигомерных белков могут входить одинаковые или разные протомеры, например го-модимеры - белки содержащие 2 одинаковых про�томера, гетеродимеры - белки, содержащие 2 раз�ных протомера.
3. Различные по структуре протомеры могут свя�зывать разные лиганды.
4. Взаимодействие одного протомера со специ�фическим лигандом вызывает конформационные изменения всего олигомерного белка и изменяет сродство других протомеров к лигандам. Это явле�ние носит название кооперативных изменений конформации протомеров.
5. У олигомерных белков появляется новое по сравнению с одноцепочечными белками свойст�во — способность к аллостерической регуляции их функций.
Гемоглобин — олигомерный белок, функция которо�го регулируется различными лигандами.
1.Гемоглобин (НЬ) — сложный олигомерный белок, содержащийся в эритроцитах. Он состоит из 4 протомеров, соединенных нековалентными связями.
2. НЬ — белок, родственный миоглобину. Вто�ричная и третичная структуры миоглобина и про�томеров НЬ очень сходны, несмотря на то что в первичной структуре полипептидных цепей иден�тичны только 24 аминокислотных остатка (каж�дый протомер содержит 8 ос-спиралей, обозначае�мых буквами от А до Н).
Следовательно, белки, значительно различаю�щиеся по аминокислотной последовательности, могут приобретать сходные пространственные структуры.
3. Каждый протомер НЬ в белке связан с небел�ковой частью — гемом и 3 другими протомерами.
4. Соединение белковой части НЬ с гемом ана�логично таковому у миоглобина: гидрофобные части гема окружены гидрофобными радикалами аминокислот, за исключением Гис F8 и Гис Е7, которые расположены по обе стороны от плоско�сти гема и играют важную роль в связывании ге�моглобина с 02.
Гемоглобины человека
Гемоглобин А — тетрамер: (2а2р). Составляет около 98% гемоглобина эритроцитов взрослого человека.
Гемоглобин А2 — тетрамер (2а28). Его содержа�ние в эритроцитах взрослого человека равно 2%.
Гемоглобин эмбриональный — тетрамер (2а2е). Обнаруживается на ранних этапах развития плода.
Гемоглобин F— тетрамер (2ос2у). Приходит на смену раннему гемоглобину плода на 6-м месяце развития.
3 (1). Биологические функции белков. Роль пространственной организации полипептидной цепи в образовании активных центров. Взаимодействие бел�ков с лигандами. Денатурация белков.
Функции белков
|
Характеристика функций белков
|
Примеры белков, осуществляющих данную функцию
|
Ферментативная, или каталитичеcкая
|
Одна из наиболее распространенных функций белков, которая состоит в ускорении химических превращений (синтез и распад веществ; перенос отдельных групп атомов, электронов от одного вещества к другому)
|
Фумаратгидратаза - катализирует обратимое превращение фумарат + Н2О -> малат
Цитохромоксидаза - участвует в транспорте электронов на кислород
|
Гормональная, или регуляторная
|
Регуляция обмена веществ внутри клеток и интеграция обмена в разных клетках целого организма
|
Инсулин - участвует в регуляции углеводного, белкового, жирового и других обменов
Лютропин - участвует в регуляции синтеза прогестерона в желтом теле яичников
|
Рецепторная
|
Избирательное связывание различных регуляторов (гормонов, медиаторов, циклических нуклеотидов) на поверхности клеточных мембран или внутри клетки (цитозольные рецепторы)
|
Цитозольный рецептор эстрадиола - связывает эстрадиол внутри клеток, например слизистой матки
Глюкагоновый рецептор - связывает гормон глюкагон на поверхности клеточной мембраны, например печени
Регуляторная субъединица протеинкиназы - связывает цАМФ внутри клеток
|
Транспортная
|
Связывание и транспорт веществ между тканями и через мембраны клетки
|
Липопротеиды - участвуют в переносе липидов между тканями организма
Транскортин - переносит кортикостероиды (гормоны коры надпочечников в крови)
Миоглобин - переносит кислород в мышечной ткани
|
Структурная
|
Участвуют в построении различных мембран
|
Структурные белки митохондрий, плазматической мембраны и т. д.
|
Опорная, или механическая
|
Близкая по назначению к структурной. Обеспечивает прочность опорных тканей, участвуя в построении внеклеточных структур
|
Коллаген - структурный элемент опорного каркаса костной ткани, сухожилий
Фиброин - участвует в построении оболочки кокона шелкопряда
β-Кератин - структурная основа шерсти, ногтей, копыт
|
Резервная, или трофическая
|
Использование белков как запасного материала для питания развивающихся клеток
|
Проламины и глютелины - запасной материал семян пшеницы
Овальбумин - запасной белок куриного яйца (используется при развитии зародыша)
|
Субстратно-энергетическая
|
Близка к резервной. Белок используется как субстрат (при распаде) для образования энергии. При распаде 1 г белка выделяется 17,1 кДж энергии
|
Все белки (поступающие или с пищей, или внутриклеточные), которые распадаются до конечных продуктов (СО2, Н2О, мочевина)
|
Механохимическая, или сократительная
|
Сокращение (механический процесс) с использованием химической энергии
|
Миозин - закрепленные нити в миофибриллах
Актин - движущиеся нити в миофибриллах
|
Электроосмотическая
|
Участие в образовании разницы электрических зарядов и градиента концентрации ионов на мембране
|
Na+, К+ АТФаза - фермент, участвующий в создании разницы концентраций ионов Na+ и К+ и электрического заряда на клеточной мембране
|
Энерготрансформирующая
|
Трансформация электрической и осмотической энергии в химическую энергию (АТФ)
|
АТФ-синтетаза - осуществляет синтез АТФ за счет разности электрических потенциалов или градиента осмотической концентрации ионов на сопрягающей мембране
|
Когенетическая
|
Вспомогательная генетическая функция белков (приставка "ко" в переводе с латинского означает совместность действия). Сами белки не являются генетическим (наследственным) материалом, но помогают нуклеиновым кислотам реализовывать способность к самовоспроизведению и переносу информации
|
ДНК-полимераза - фермент, участвующий в репликации ДНК
ДНК-зависимая РНК-полимераза - фермент, участвующий в переносе информации от ДНК к РНК
|
Генно-регуляторная
|
Способность некоторых белков участвовать в регуляции матричных функций нуклеиновых кислот и переноса генетической информации
|
Гистоны - белки, участвующие в регуляции репликации и частично транскрипции участков ДНК
Кислые белки - участвуют в регуляции процесса транскрипции отдельных участков ДНК
|
Иммунологичеcкая, или антитоксическая
|
Антитела участвуют в обезвреживании чужеродных антигенов микроорганизмов (токсинов, выделяемых ими) путем образования комплекса антиген - антитело
|
Иммуноглобулины А, М, G и др. - выполняют защитную функцию
Комплемент - белок, способствующий образованию комплекса - антиген-антитело
|
Токсигенная
|
Некоторые белки и пептиды, выделяемые организмами (в основном микроорганизмами), являются ядовитыми для других живых организмов
|
Ботулинический токсин - пептид, выделяемый палочкой ботулизма
|
Обезвреживающая
|
Благодаря функциональным группам белки связывают токсические соединения (тяжелые металлы, алкалоиды), обезвреживая их
|
Альбумины - связывают тяжелые металлы, алкалоиды
|
Гемостатическая
|
Участвуют в образовании тромба и остановке кровотечения
|
Фибриноген - белок сыворотки крови, полимеризуется в виде сетки, составляющей структурную основу тромба
|
Активный центр – участок молекулы фермента, который связывает субстраты и от которого зависит специфичность каталитического действия ферментов; активный центр содержит функциональные группы остатков аминокислот и коферментов, пространственно сближенных и определённым образом ориентированных.
Несмотря на огромное разнообразие структуры ферментов, их специфичности и механизма действия, существует ряд общих закономерностей формирования активных центров.
Во-первых, на активный центр приходится относительно малая часть объёма фермента. Роль остальных аминокислотных остатков, составляющих основную массу фермента, состоит в том, чтобы обеспечить молекуле фермента правильную глобулярную форму.
Во-вторых, активный центр – это сложная трёхмерная структура, и в её образовании принимают участие группы, принадлежащие разным частям линейной последовательности аминокислот. Радикалы аминокислот, образующих активный центр, оказываются вблизи друг от друга в результате формирования третичной структуры белка (рисунок 3.3). Поэтому при воздействии факторов, вызывающих денатурацию (нагревание, концентрированные кислоты и щёлочи) утрачивается конформация активного центра и фермент теряет свою активность.
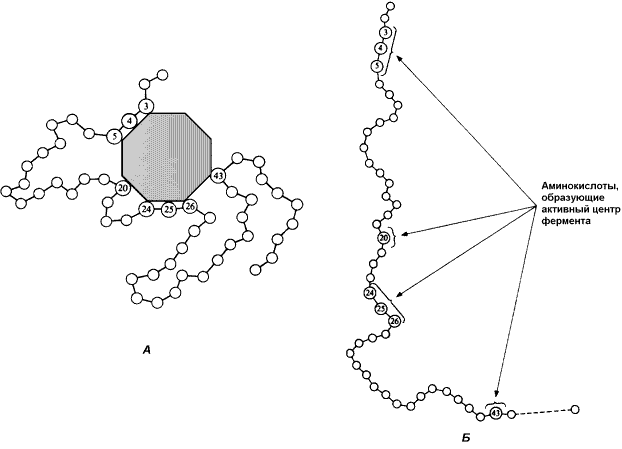
Рисунок 3.3. А. Участие аминокислотных остатков, образующих активный центр фермента, во взаимодействии с субстратом. Б. Положение этих аминокислотных остатков в первичной структуре фермента.
В-третьих, активный центр имеет форму узкого углубления или щели, в которую ограничен доступ воде, за исключением тех случаев, когда вода является одним из реагирующих веществ. В этом углублении присутствует несколько полярных аминокислотных остатков, необходимых для связывания субстрата и катализа.
В-четвёртых, в составе активного центра можно условно выделить две части: а) контактный или якорный участок, где происходит связывание субстрата в нужной ориентации; б) каталитический участок, обеспечивающий протекание реакции.
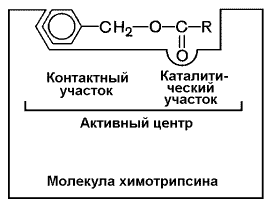
Рисунок 3.4. Состав активного центра фермента (на примере химотрипсина).
В-пятых, субстраты относительно слабо связываются с ферментами. В связывании и превращении субстрата принимают участие следующие группировки аминокислотных радикалов:
полярные заряженные: карбоксильные группы глутамата и аспартата, аминогруппы лизина; гуанидиновые группы аргинина; имидазольные группы гистидина;
полярные незаряженные: гидроксильные группы серина и треонина; сульфгидрильные группы цистеина; фенольные группы тирозина;
неполярные группы: углеводородные цепи алифатических аминокислот; ароматические кольца фенилаланина и триптофана.
У сложных ферментов в формировании активных центров принимают участие также функциональные группы коферментов.
В образовании фермент-субстратных комплексов принимают участие те же молекулярные взаимодействия, что и обеспечивают формирование пространственной структуры макромолекул, межклеточные контакты и другие процессы в биологических системах:
водородные связи между полярными незаряженными группировками субстрата и фермента;
ионные связи между противоположно заряженными группировками субстрата и фермента;
гидрофобные взаимодействия между неполярными группировками субстрата и фермента.
Эти три основных типа нековалентных связей различаются по своей геометрии, энергии, специфичности.
Взаимодействие белков с лигандами
Основным свойством белка, обеспечивающим его функцию, является избирательное взаимодействие с определенным веществом - лигандом.
Лигандами могут быть вещества разной природы, как низкомолекулярные соединения, так и макромолекулы, в том числе и белки. На белковых молекулах есть участки, к которым присоединяется лиганд - центры связывания или активные центры. Центры связывания формируются из аминокислотных остатков, сближенных в результате формирования вторичной и третичной структуры.
Связи между белком и лигандом могут быть нековалентными и ковалентными. Высокая специфичность взаимодействия («узнавания») белка и лиганда обеспечивается комплементарностью структуры центра связывания пространственной структуре лиганда.
Под комплементарностью понимают химическое и пространственное соответствие активного центра белка и лиганда. Взаимодействие между белком Р и лигандом L описывается уравнением:
белок + лиганд↔ белково-лигандный комплекс.
1. Главными физико-химическими свойствами белков являются молекулярная масса, электрический заряд и растворимость в воде.
Молекулярная масса белков может значительно варьировать. Например, гормон инсулин имеет молекулярную массу около 6 тыс. Да, а иммуноглобулин М - около 1 млн. Да. Молекулярная масса белка зависит от количества аминокислотных остатков, входящих в его состав, а также массы неаминокислотных компонентов. Масса одного остатка аминокислоты в среднем составляет 110 Да. Таким образом, зная количество остатков аминокислот в белке, можно оценить его молекулярную массу и наоборот (Н.Н.Мушкамбаров, 1995).
Электрический заряд белка определяется соотношением положительно и отрицательно заряженных групп на поверхности его молекулы. Заряд белковой частицы зависит от рН среды. Для характеристики белка используют понятие «изоэлектрическая точка».
Изоэлектрическая точка (pI) — значение pH среды, при котором суммарный заряд белковой частицы равен нулю. В изоэлектрической точке белки наименее устойчивы в растворе и легко выпадают в осадок. Величина pI зависит от соотношения кислых и основных аминокислот в белке. Для белков и пептидов с преобладанием кислых аминокислот (отрицательно заряженных при pH 7,0) значение pI находится в кислой среде; для белков и пептидов с преобладанием основных аминокислот (положительно заряженных при pH 7,0) значение pI находится в кислой среде.
Изоэлектрическая точка — характерная константа белков, её значение для большинства белков животных тканей лежит в пределах от 5,5 до 7,0, что свидетельствует о преобладании в их составе кислых аминокислот. Однако в природе имеются белки, у которых значение изоэлектрической точки лежит при крайних значениях pH среды. В частности, величина pI пепсина (фермента желудочного сока) равна 1, в лизоцима (фермента, расщепляющего клеточную стенку микроорганизмов) — около 11. Значения молекулярной массы и изоэлектрической точки некоторых белков приведены в таблице 1.4.
Таблица 1.4
Некоторые константы белков плазмы крови и тканей
Белок
|
Молекулярная масса, Да
|
Изоэлектрическая точка
|
Альбумин сывороточный
|
66 000
|
4.9
|
Альбумин яичный
|
45 000
|
4.6
|
α-Амилаза
|
50 000
|
5.3
|
Гаптоглобин
|
85 000
|
4.2
|
Гемоглобин
|
65 000
|
6.8
|
Гистоны
|
15 000
|
10.8
|
Иммуноглобулин А
|
150 000
|
7.3
|
Иммуноглобулин G
|
150 000
|
5.8
|
Иммуноглобулин М
|
950 000
|
6.6
|
Инсулин
|
5 780
|
5.35
|
Карбоксипептидаза
|
34 400
|
6.0
|
Каталаза
|
245 000
|
5.6
|
β-Лактоглобулин
|
37 100
|
5.2
|
Лизоцим
|
14 000
|
11.0
|
α2-Макроглобулин
|
820 000
|
5.4
|
Миоглобин
|
16 000
|
7.0
|
Орозомукоид
|
41 000
|
2.8
|
Пепсин
|
35 000
|
1.0
|
Рибонуклеаза
|
13 700
|
7.8
|
Трансферрин
|
88 000
|
5.4
|
Трипсиноген
|
24 000
|
9.3
|
Уреаза
|
480 000
|
5.0
|
Фибриноген
|
340 000
|
5.8
|
Химотрипсиноген
|
25 700
|
9.5
|
Церулоплазмин
|
151 000
|
4.4
|
Цитохром с
|
12 400
|
10.7
| | |
|
|
 Скачать 1.58 Mb.
Скачать 1.58 Mb.

