|
|
1 (1). Первичная структура белка. Зависимость свойств и конформации белков от первичной структуры. Примеры полиморфизма белков, гемоглобин а и F, структурные и функциональные отличия
Виды липопротеинов
Вид
|
Размеры
|
Функция
|
Липопротеины высокой плотности (ЛПВП)
|
8-11 нм
|
Транспорт холестерина от периферийных тканей к печени
|
Липопротеины низкой плотности (ЛПНП)
|
18-26 нм
|
Транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям
|
Липопротеины промежуточной (средней) плотности ЛППП (ЛПСП)
|
25-35 нм
|
Транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям
|
Липопротеины очень низкой плотности (ЛПОНП)
|
30-80 нм
|
Транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям
|
Хиломикроны
|
75-1200 нм
|
Транспорт холестерина и жирных кислот, поступающих с пищей, из кишечника в периферические ткани и печень
|
Нековалентная связь в липопротеинах между белками и липидами имеет важное биологическое значение. Она обусловливает возможность свободного обмена липидов и модуляцию свойств липопротеинов в организме.
Липопротеины являются:
структурными элементами мембран клеток животных организмов;
транспортными белками, транспортирующими холестерин и другие стероиды, фосфолипиды и др.
Липиды амфипаты???????????
26 (1). Принципы построения биологических мембран. Роль основных компонентов (липидов, белков, углеводов) в структурной организации и функционировании мем�бран
ОСНОВНЫЕ ПРИНЦИПЫ ОРГАНИЗАЦИИ БИОМЕМБРАН
Все клетки отграничены друг от друга и от окружающей среды с помощью специальной оболочки –клеточной мембраны. Со времен К. Негели, описавшего в 1855 г. структуру мембран, окружающих живыеклетки, представления об устройстве и функциях мембран существенно обогатились. Клеточная мембранаво многом определяет свойства, поведение и даже форму клетки. Мембраны прокариот и эукариотразличаются между собой по составу и свойствам. Растительные и животные клетки также отличаются друг от друга как по набору органелл, так и по свойствам мембран
Состав и строениебиологических мембран.Биологические мембраны состоят из белков и липидов.Углеводы присутствуют лишь в качестве составных частей сложных белков (гликопротеинов) и сложныхлипидов (гликолипидов). Нуклеиновые кислоты в небольшом количестве бывают ассоциированы смембранами, но в состав мембранных структур не включаются. Вода составляет 20% от мембранного материала, а отношение белок/липид в зависимости от вида мембран колеблется от 0,25 (клеткимиелиновой оболочки) до 3,0 (митохондриальные мембраны).
Липидымембран представлены четырьмя основными группами: фосфо-липидами (основная доля),сфинголипидами, гликолипидами и стероидами. Фосфолипиды – это сложные эфиры фосфатидной кислоты. Основными фосфолипидами являются фосфатидилэтаноламин, фосфатидилсерин, фос-фатидилинозит ифосфатидилхолин. В состав фосфолипидов входят также дифосфатидилглицерины (кардиолипин),плазмалогены (1-О-алкенил-2-О ацилфосфолипиды) и диольные фосфолипиды. Сфинголипиды, которые являются производными церамида и монофосфорных эфиров различных спиртов, представлены в основномсфингомиелином. Гликолипиды – глико-зильные производные церамида – представлены как нейтральными церебро-зидами, так и их кислыми сульфоэфирами – сульфатидами. Производные церамида и нейраминовой кислоты – ганглиозиды – часто выделяют в отдельную группу липидов – гликосфинголипиды.Стероиды представлены холестерином (в мембранах животных клеток), ситостерином (в растительныхклетках) и тетрахименином (обнаружен у тетрахимены).
Несмотря на различия в составе, все мембранные липиды построены по единому плану и легко смешиваются друг с другом, образуя монослойные или бислойные структуры (рис. 9.2). В этих структурах реализуется 2 типа взаимодействий: ионные взаимодействия полярных «голов» и гидрофобные взаимодействия жирнокислотных цепей. Благодаря этому мицеллы и липо-сомы, создаваемые протяженными бислойными структурами, достаточно стабильны в водном окружении.
В наружных (плазматических) мембранах животных клеток обнаруживается большое количество холестерина(около 21 моль%), меньше – фосфатидилэтаноламина и еще меньше фосфатидилхолина. Для внутриклеточных мембран основным компонентом является фосфатидилхолин, и соотношениефосфатидилхолин/фосфатидилэтаноламин в них всегда больше
Белки
Белки — незаменимая часть пищи.
Основными источниками белка животного происхождения являются мясо, рыба, творог, яйца. В растительных продуктах тоже содержатся протеины, особенно богаты ими бобовые и орехи.
Человек получает белок, употребляя животную и растительную пищу, однако белки пищи отличаются от тех, из которых состоит человеческое тело. В процессе пищеварения белки распадаются на аминокислоты, которые всасываются и используются организмом для образования собственного белка. Наиболее важных аминокислот 22. Из них восемь считаются незаменимыми. Они называются так потому, что организм не может синтезировать их самостоятельно — он получает их только с пищей, Остальные аминокислоты расцениваются как заменимые.
Различные белки содержат разные комплексы аминокислот, поэтому очень важно, чтобы организм постоянно получал полный набор необходимых белков. Средняя норма белка в суточном рационе взрослого человека составляет 100—120 г, при тяжелой физической работе ее следует увеличить до 150—160 г.
Жиры
Жиры - наиболее мощный источник энергии. Кроме того, жировые отложения («депо» жира) защищают организм от потери тепла и ушибов, а жировые капсулы внутренних органов служат им опорой и защитой от механических повреждений. Депонированный жир является основным источником энергии при острых заболеваниях, когда аппетит снижается и усвоение пищи ограничивается.
Источником жира являются животные жиры и растительные масла, а также мясо, рыба, яйца, молоко и молочные продукты. Жиры содержат насыщенные и ненасыщенные жирные кислоты, жирорастворимые витамины А, В, Е, лецитин и ряд других веществ, необходимых организму. Они обеспечивают всасывание из кишечника ряда минеральных веществ и жирорастворимых витаминов. Жировые ткани - активный резерв энергетического материала. Жиры улучшают вкус пи¬щи и вызывают чувство сытости. Они могут образовываться из углеводов и белков, но в полной мере ими не заменяются.
Обеспечить потребности организма можно только сочетанием животных и растительных жиров, поскольку они дополняют друг друга жизненно важными веществами.
Суточная норма жира для взрослого человека — от 100 до 150 г при тяжелой физической работе, особенно на холоде. В среднем суточный рацион жира должен состоят на 60-70% из животного жира и на 30—40% — из растительного.
Углеводы
Углеводы служат для организма основным источником энергии, помогают работать нашим мышцам. Они необходимы для нормального обмена белков и жиров. В комплексе с белками они образуют определенные гормоны, ферменты, секреты слюнных и других образующих слизь желез и прочие важные соединения. Средняя норма углеводов в суточном рационе должна составлять 400-500 г.
Углеводы подразделяются на простые и сложные. Простые углеводы отличаются от сложных химической структурой. Среди них различаются моносахариды (глюкоза, галактоза, фруктоза) и дисахариды (сахароза, лактоза и мальтоза). Простые углеводы содержатся в сладких продуктах - сахаре, меде, кленовом сиропе и т.п.
Сложные углеводы называют полисахаридами, их источником являются растения - злаковые, овощи, бобовые. К сложным углеводам относятся крахмал, гликоген, клетчатка, пектины, гемицеллюлоза и др. Полисахариды составляют основу пищевых волокон, поэтому они играют важную роль в питании.
27 (1). Механизмы переноса веществ. Транспортные АТФазы. Роль К+,Na+-АТФазы в поддержании трансмем�бранного потенциала и возбудимости мембраны.
Одна из главных функций мембран – участие в переносе веществ. Этот процесс обеспечивается при помощи трёх основных механизмов: простой диффузией, облегчённой диффузией и активным транспортом (рисунок 14.10). Запомните важнейшие особенности этих механизмов и примеры транспортируемых веществ в каждом случае.
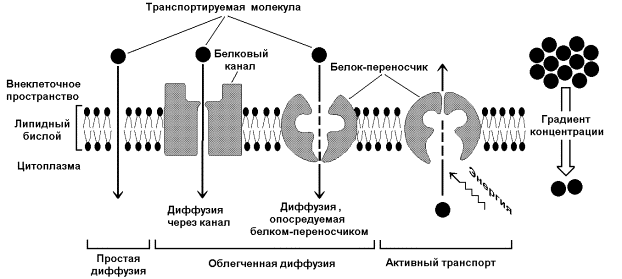
Рисунок 14.10. Механизмы транспорта молекул через мембрану
Простая диффузия - перенос веществ через мембрану без участия специальных механизмов. Транспорт происходит по градиенту концентрации без затраты энергии. Путём простой диффузии транспортируются малые биомолекулы – Н2О, СО2, О2, мочевина, гидрофобные низкомолекулярные вещества. Скорость простой диффузии пропорциональна градиенту концентрации.
Облегчённая диффузия - перенос веществ через мембрану при помощи белковых каналов или специальных белков-переносчиков. Осуществляется по градиенту концентрации без затраты энергии. Транспортируются моносахариды, аминокислоты, нуклеотиды, глицерол, некоторые ионы. Характерна кинетика насыщения – при определённой (насыщающей) концентрации переносимого вещества в переносе принимают участие все молекулы переносчика и скорость транспорта достигает предельной величины.
Активный транспорт – также требует участия специальных белков-переносчиков, но перенос происходит против градиента концентрации и поэтому требует затраты энергии. При помощи этого механизма через клеточную мембрану транспортируются ионы Na+ , K+, Ca2+ , Mg2+, через митохондриальную – протоны. Для активного транспорта веществ характерна кинетика насыщения.
14.5.2. Примером транспортной системы, осуществляющей активный транспорт ионов, является Na+,K+-аденозинтрифосфатаза (Na+,K+-АТФаза или Na+,K+-насос). Этот белок находится в толще плазматической мембраны и способен катализировать реакцию гидролиза АТФ. Энергия, выделяемая при гидролизе 1 молекулы АТФ, используется для переноса 3 ионов Na+ из клетки во внеклеточное пространство и 2 ионов К+ в обратном направлении (рисунок 14.11). В результате действия Na+,K+-АТФазы создаётся разность концентраций между цитозолем клетки и внеклеточной жидкостью. Поскольку перенос ионов неэквивалентен, то возникает разность электрических потенциалов. Таким образом, возникает электрохимический потенциал, который складывается из энергии разности электрических потенциалов Δφ и энергии разности концентраций веществ ΔС по обе стороны мембраны.
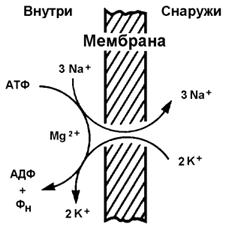
Рисунок 14.11. Схема Na+, K+-насоса.
14.5.3. Перенос через мембраны частиц и высокомолекулярных соединений
Наряду с транспортом органических веществ и ионов, осуществляемым переносчиками, в клетке существует совершенно особый механизм, предназначенный для поглощения клеткой и выведения из неё высокомолекулярных соединений при помощи изменения формы биомембраны. Такой механизм называют везикулярным транспортом.
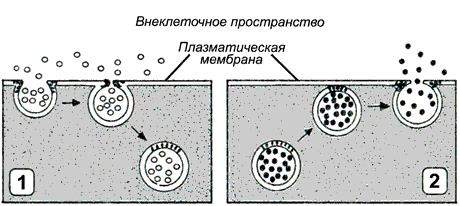
Рисунок 14.12. Типы везикулярного транспорта: 1 - эндоцитоз; 2 - экзоцитоз.
При переносе макромолекул происходит последовательное образование и слияние окружённых мембраной пузырьков (везикул). По направлению транспорта и характеру переносимых веществ различают следующие типы везикулярного транспорта:
Эндоцитоз (рисунок 14.12, 1) — перенос веществ в клетку. В зависимости от размера образующихся везикул различают:
а) пиноцитоз — поглощение жидкости и растворённых макромолекул (белков, полисахаридов, нуклеиновых кислот) с помощью небольших пузырьков (150 нм в диаметре);
б) фагоцитоз — поглощение крупных частиц, таких, как микроорганизмы или обломки клеток. В этом случае образуются крупные пузырьки, называемые фагосомами диаметром более 250 нм.
Пиноцитоз характерен для большинства эукариотических клеток, в то время как крупные частицы поглощаются специализированными клетками - лейкоцитами и макрофагами. На первой стадии эндоцитоза вещества или частицы адсорбируются на поверхности мембраны, этот процесс происходит без затраты энергии. На следующей стадии мембрана с адсорбированным веществом углубляется в цитоплазму; образовавшиеся локальные впячивания плазматической мембраны отшнуровываются от поверхности клетки, образуя пузырьки, которые затем мигрируют внутрь клетки. Этот процесс связан системой микрофиламентов и является энергозависимым. Поступившие в клетку пузырьки и фагосомы могут сливаться с лизосомами. Содержащиеся в лизосомах ферменты расщепляют вещества, содержащиеся в пузырьках и фагосомах до низкомолекулярных продуктов (аминокислот, моносахаридов, нуклеотидов), которые транспортируются в цитозоль, где они могут быть использованы клеткой.
Экзоцитоз (рисунок 14.12, 2) — перенос частиц и крупных соединений из клетки. Этот процесс, как и эндоцитоз, протекает с поглощением энергии. Основными разновидностями экзоцитоза являются:
а) секреция - выведение из клетки водорастворимых соединений, которые используются или воздействуют на другие клетки организма. Может осуществляться как неспециализированными клетками, так и клетками эндокринных желёз, слизистой желудочно-кишечного тракта, приспособленными для секреции производимых ими веществ (гормонов, нейромедиаторов, проферментов) в зависимости от определённых потребностей организма.
Секретируемые белки синтезируются на рибосомах, связанных с мембранами шероховатого эндоплазматического ретикулума. Затем эти белки транспортируются к аппарату Гольджи, где они модифицируются, концентрируются, сортируются, и затем упаковываются в пузырьки, которые отщепляются в цитозоль и в дальнейшем сливаются с плазматической мембраной, так что содержимое пузырьков оказывается вне клетки.
В отличие от макромолекул, секретируемые частицы малых размеров, например, протоны, транспортируются из клетки при помощи механизмов облегчённой диффузии и активного транспорта.
б) экскреция - удаление из клетки веществ, которые не могут быть использованы (например, удаление в ходе эритропоэза из ретикулоцитов сетчатой субстанции, представляющей собой агрегированные остатки органелл). Механизм экскреции, по-видимому, состоит в том, что вначале выделяемые частицы оказываются в цитоплазматическом пузырьке, который затем сливается с плазматической мембраной.
28 (1). Липопротеины крови: особенности строения, состава и функций разных классов липопротеинов. Роль в обмене триацилглицеролов и холе�стерола. Диагностическое значение определения уровня холестерола и ли�попротеинов в крови
В плазме крови можно обнаружить все типы липидов, а также продукты их превращения — сво�бодные жирные кислоты и кетоновые тела.
Особенностью цир�куляции липидов в крови, связанной с их нерастворимостью в воде, является то, что и триглицериды, и холестерин, и фосфолипиды в сво�бодном виде в плазме крови не существуют. Они связаны с белками плазмы —апопротеинами, образуя липид-белковые комплексы, извест�ные под названием липопротеины(илилипопротеиды- оба названия равноценны).
Липопротеиды — это транспортная фор�ма липидов в крови, водорастворимость этих комплексов обеспечивает активное включение липидов плазмы в процессы метаболизма. Все липопротеиды содержат в себе одновременно триглицериды, фосфолипиды и холесте�рин, но в различных количественных соотношениях.
Различаются меж�ду собой липопротеиды также по размеру комплексов, по плотности, по группам апопротеинов и величине электрического заряда апопротеинов.
В соответствии с приведенными отличиями существует три варианта классификации липопротеидов:
- по группам апопротеинов;
- по величине электричес�кого заряда апопротеинов путем разделения липопротеинов с помощью электрофо�реза;
- по плотности липопротеинов, измеряемой методом ультрацентрифугирования.
Во всех трех классификациях липопротеиды подразделяются на 4 основных клас�са, сопоставимых между собой в различных классификациях.
Первая из названных классификаций (по группам апопротеинов) на сегодняшний день в клинической практике применения не имеет.
При разделении методом электрофореза получают следующие клас�сы липопротеинов (в порядке продвижения их от линии старта):
- хиломикроны,
- пре-бета-липопротеины,
- бета-липопротеины,
- альфа-липопротеины.
Электрофоретическая номенклатура получила наибольшее распространение в клинической практике, так как на ней базируется классификация типов гиперлипопротеидемий по Фредериксону, принятая ВОЗ.
При ультрацентрифугировании липопротеинов разделяются в зависимости от их плотности на:
- хиломикроны,
- липопротеиды очень низкой плотности, или пре-бета-липопротеины,
- липопротеиды низкой плотности, или бета-липопротеины,
- липопротеиды высокой плотности, или альфа-липопротеины.
Данная классификация применяется наряду с электрофоретической.
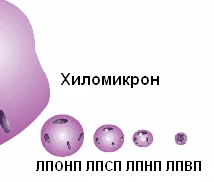
Соотношение размеров липопротеидов показано на картинке:
- хиломикрон
- ЛПОНП - липопротеид очень низкой плотности
- ЛПСП - липопротеинд средней плотности
- ЛПНП - липопротеид низкой плотности
- ЛПВП - липопротеид высокой плотности
Хиломикроны состоят преимущественно из триглицеридов, причем, как мы знаем, из экзогенных триглицеридов, транспортной формой в крови которых они и являются.
Липопротеины очень низкой плотности также главным образом содержат триглицериды, но эндогенного происхожде�ния и являются их транспортной формой в крови.
Липопротеины низкой плотности в своем со�ставе в норме содержат до 45% холестерина, что преобладает над другими типами липидов в данном классе липопротеидов, поэтому данные липопротеины рассмат�ривают как транспортную форму холестерина в крови.
Липопротеины высокой плотности содер�жат больше всего фосфолипидов и являются их транспортной формой.
В крови здорового человека, взятой натощак, содержатся только липопротеиды высокой, низкой и очень низкой плотности. Хиломикроны в ней отсутствуют. Они появ�ляются только при нарушениях липидного обмена.
В ряде патологичес�ких состояний в крови может обнаруживаться пятый класс липопротеинов —липопротеиды промежуточной плотности. Обычно они представ�ляют собой промежуточные продукты превращения липопротеинов очень низкой и низкой плотности. Синтезируются липопротеиды высокой и очень низкой плотности в печени, а низкой — в плазме крови из липопротеидов очень низкой плотности.
Все классы липопротеидов в большей или меньшей мере содержат холестерин. Но наиболее атерогенными из них являются ЛПНП и ЛППП. Един�ственный неатерогенный класс липопротеидов — это липопротеиды высокой плотности. Более того, они ак�тивно участвуют в выведении холестерина из клеток путем этерификации его, что облегчает доставку холестерина в печень, откуда он в составе желчи выводится в кишечник и удаляется из организма. Все другие классы, наоборот, транспортируют холестерин в клетки.
Кроме то�го, липопротеиды высокой плотности являются транспортной формой фосфолипидов в крови. Фосфолипиды способствуют поддержанию холестерина во взве�шенном состоянии, препятствуя его выпадению из кровяного русла.
Липопротеины высокой плотности - ЛПВП
Нормальный уровень ЛПВП: 0,8—2,2 ммоль/л.
Повышение ЛПВП:
- ожирение
- жировая дистрофия печени (то же, что иожирение печени)
- гиперлипидемия
Снижение ЛПВП:
- танжерская болезнь — накопление холестерина в тканях, сни�жение содержания в крови
Липопротеины низкой плотности - ЛПНП
Нормальный уровень ЛПНП: 1,3—3,5 ммоль/л.
Повышение ЛПНП:
- II и III типы гиперлипидемий
- гипотиреоз
- сахарный диабет
- дислипидемия
- нефротический синдром
- острая порфирия
- атеросклероз
Снижение ЛПНП:
- I, IV и V типы гиперлипидемий
- алкоголизм
- беременность
- гипертиреоз
- панкреатит
- стероидная терапия
Липопротеины очень низкой плотности - ЛПОНП
Нормальный уровень ЛПОНП:0,13—1,0 ммоль/л.
Незначительное повышение ЛПОНП:
- I и II типы гиперлипидемий
- алкоголизм
- гипотиреоз
- сахарный диабет
- дислипидемия
- нефротический синдром
- порфирия
- атеросклероз
Повышение ЛПОНП:
- IVи V типы гиперлипидемий
- алкоголизм
- беременность
- гипотиреоз
- сахарный диабет
- дислипидемия
- нефротический синдром
- панкреатит
- стероидная терапия
- атеросклероз
Биосинтез триацилглицеролов и глицерофосфолипидов происходит в цитоплазме клеток. Первые реакции этих метаболических путей совпадают и включают образование фосфатидной кислоты.
Предшественники фосфатидной кислоты - глицерол и жирные кислоты - вступают в реакцию в активной форме.
Образование активной формы глицерола (глицерол-3-фосфата может происходить двумя путями (рисунок 19.3).
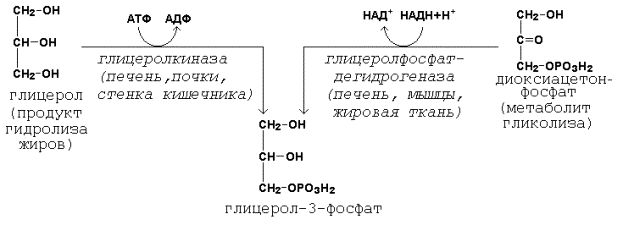
Рисунок 19.3. Пути образования глицерол-3-фосфата.
Активация жирных кислот идёт путём образования тиоэфиров коэнзима А – ацил-КоА (см. 18.1.1, рисунок 18.1).
19.2.2. Первая реакция ацилирования глицерол-3-фосфата осуществляется за счёт КоА-производного насыщенной жирной кислоты, например, пальмитиновой. Образуется сложноэфирная связь в 1-м положении (рисунок 19.4, реакция 1).
Вторая реакция ацилирования идёт, как правило, за счёт КоА-тиоэфира ненасыщенной жирной кислоты, например, олеиновой (рисунок 19.4, реакция 2).
В процессе синтеза триацилглицеролов происходит дефосфорилирование фосфатидной кислоты при помощи фосфатидатфосфатазы (рисунок 19.4, реакция 3).
В дальнейшем 1,2-диацилглицерол ацилируется третьей молекулой ацил-КоА, которая может содержать остаток как ненасыщенной, так и насыщенной жирной кислоты (рисунок 19.4, реакция 4).
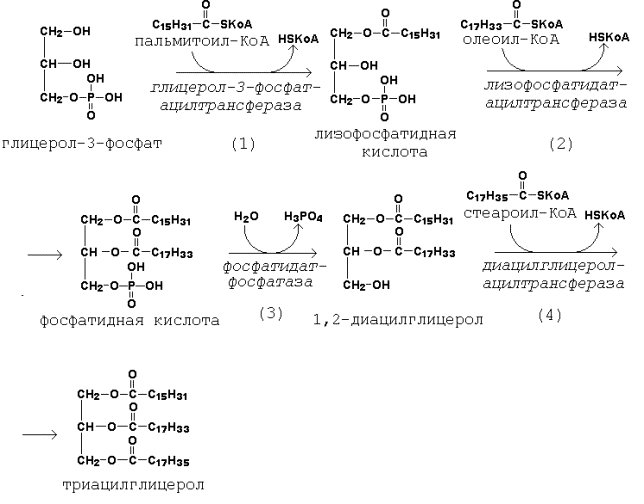
Рисунок 19.4. Реакции биосинтеза триацилглицеролов.
19.2.3. В организме здорового человека процессы биосинтеза и катаболизма триацилглицеролов взаимно уравновешены.
В тех случаях, когда углеводы, жиры или белки потребляются в количествах, превышающих энергетические потребности организма, излишки калорий запасаются в виде триацилглицеролов. Источником ацетил-КоА для биосинтеза жирных кислот могут служить как углеводы, так и углеродные цепи аминокислот. Накопленный избыток жиров может быть израсходован для получения энергии, например, при голодании.
Скорость биосинтеза триацилглицеролов регулируется гормонами. Инсулин стимулирует поступление глюкозы в клетки и, следовательно, превращение её в жиры. Глюкагон и гормоны надпочечников тормозят этот процесс.
19.3.1. Как известно (9.4.2), глицерофосфолипиды являются производными фосфатидной кислоты и одного из аминоспиртов (например, этаноламина, холина или серина). Реакции образования фосфатидной кислоты обсуждались в предыдущем параграфе (см. 19.2.2, рисунок 19.4).
Подобно другим предшественникам в биосинтезе липидов, аминоспирты, участвующие в синтезе фосфолипидов, вступают в реакцию в активной форме – в виде соединения с цитидиндифосфатом (ЦДФ). В качестве примера на рисунке 19.5 приводятся реакции активации этаноламина. Обратите внимание, что в реакциях активации аминоспиртов принимают участие два нуклеозидтрифосфата – АТФ и ЦТФ.
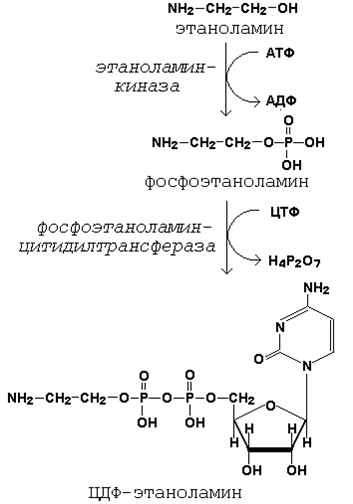
Рисунок 19.5. Реакции образования активной формы этаноламина.
Далее остаток фосфоэтаноламина с ЦДФ-этаноламина переносится на 1,2-диацилглицерол, образующийся в результате дефосфорилирования фосфатидной кислоты (рисунок 19.6, реакции 1 и 2). Продуктом реакции является фосфатидилэтаноламин.
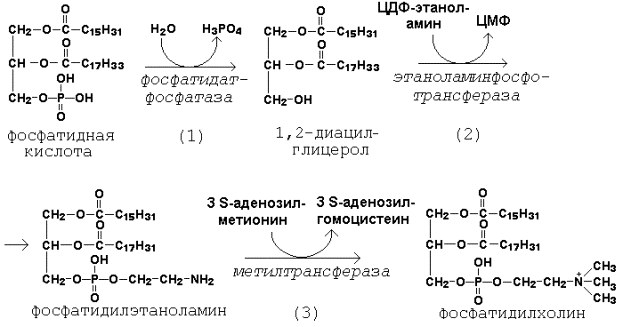
Рисунок 19.6. Реакции синтеза фосфатидилхолина.
Синтез фосфатидилхолина происходит путём трёхкратного метилирования фосфатидидэтаноламина. Донором метильных групп служит S-аденозилметионин (рисунок 19.6, реакция 3). Фосфатидилхолин может образоваться также путём активации холина, подобно этаноламину.
Фосфатидилсерин образуется в реакции прямого взаимодействия фосфатидилэтаноламина и серина:
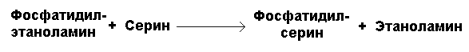
19.3.2. Липотропные факторы – вещества, способствующие синтезу фосфолипидов и препятствующие отложению триацилглицеролов в тканях.
Липотропный эффект этих соединений связан с тем, что общим предшественником триацилглицеролов и фосфолипидов является фосфатидная кислота. При недостатке липотропных факторов фосфатидная кислота используется преимущественно для синтеза триацилглицеролов. Они нерастворимы в воде и накапливаются в клетках, способствуя их жировому перерождению. Запомните, какие липотропные факторы можно использовать в качестве препаратов для его предупреждения:
1) холин – самое распространённое азотистое основание фосфолипидов;
2) метионин – незаменимая аминокислота, предшественник S-аденозилметионина, универсального донора метильных групп;
3) фолиевая кислота и витамин В 12 – предшественники коферментов, участвующих в реакциях переноса СН 3 -групп.
При введении липотропных факторов снижается синтез триацилглицеролов и усиливается выведение жира из клеток при участии липопротеиновых комплексов (см.20.1.2).
19.4.1. Исходным соединением для синтеза холестерола является ацетил-КоА (см. 15.2.3, рисунок 15.6). Ферменты, катализирующие реакции синтеза, содержатся в цитоплазме и эндоплазматическом ретикулуме многих клеток. Наиболее активно этот процесс происходит в печени. В организме человека в сутки синтезируется около одного грамма холестерола.
19.4.2. Биосинтез холестерола включает три основные стадии (рисунок 19.7).
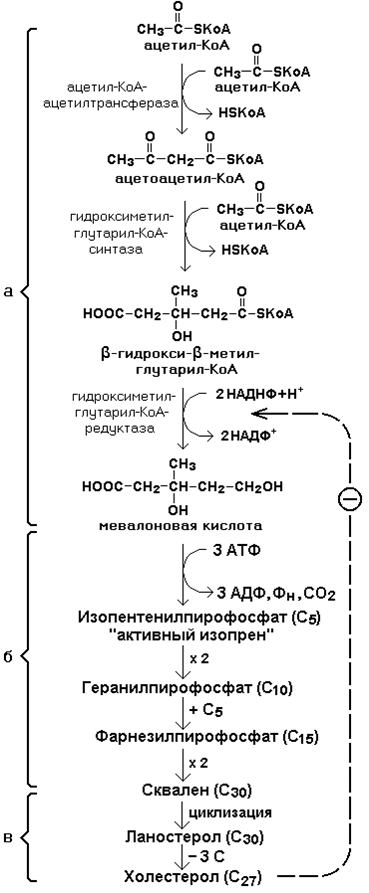
Рисунок 19.7. Синтез холестерола.
На первой стадии образуется мевалоновая кислота (рисунок 19.7, а).
На второй стадии мевалоновая кислота превращается в изопентенилпирофосфат («активный изопрен»), 6 молекул которого конденсируются в сквален (рисунок 19.7, б).
На третьей стадии сквален превращается в холестерол (рисунок 19.7, в).
Всего для синтеза 1 молекулы холестерола используется 18 молекул ацетил-КоА: для образования «активного изопрена» требуется 3 молекулы; в последующих реакциях конденсации участвуют 6 молекул «активного изопрена»; 3 × 6 = 18.
19.4.3. Скорость синтеза холестерола в организме регулируется по механизму отрицательной обратной связи (рисунок 19.7, пунктирная стрелка). Фермент β-гидрокси-β-метилглутарил-КоА-редуктаза катализирует лимитирующую реакцию биосинтеза холестерола. Холестерол является корепрессором синтеза данного ферментного белка, что приводит к снижению скорости катализируемой реакции. Поэтому при поступлении избытка холестерола с пищей синтез эндогенного холестерола прекращается.
Холестерол является компонентом биологических мембран, из него в организме образуются стероидные гормоны, витамин D 3 , желчные кислоты (см. 9.2.2). Избыток холестерола превращается в печени в желчные кислоты (см. 10.2.3, рисунок 10.3), а также выделяется с желчью в кишечник и выводится с калом.
19.4.4. Нормальное содержание холестерола в сыворотке крови человека составляет 3,9 – 6,3 ммоль/л. Транспортной формой холестерола в крови являются липопротеины (см. далее 20.1.2). Если нарушается соотношение между поступлением холестерола в организм и его выведением, то содержание холестерола в тканях и крови изменяется. Повышение концентрации холестерола в крови ( гиперхолестеролемия ) может приводить к развитию атеросклероза и желчно-каменной болезни.
Исследование проводится натощак, после 8— 12 часов голодания. На концентрацию различных веществ в крови влияет как прием пищи, так и положение тела: при переходе из горизонтального положения в вертикальное в ней повышается количество общего белка, ферментов, альбумина. кальция, калия, фосфатов, общего тироксина, а также холестерола и триглицеридов. Поэтому интерпретация анализов должна проводиться только врачом с учетом всех обстоятельств и индивидуальных особенностей организма пациента. Наибольшую точность дают анализы, которые проводятся ферментативным, методом.
Существуют также индивидуальные тест-системы для определения уровня холестерина и глюкозы в домашних условиях, однако на их действие могут оказывать такие условия внешней среды, как повышенная температура или влажность, вследствие чего велика вероятность получения ошибочных результатов.
Медицинские нормы содержания в организме тех или иных веществ — это усредненные значения, характерные для большинства здоровых людей. В каждом отдельно взятом случае они могут быть скорректированы как в сторону снижения, так и в сторону увеличения. Так, пациентам, страдающим сахарным диабетом, ожирением и другими заболеваниями, которые обычно сопутствуют гиперлипопротеинемии, для профилактики сердечно-сосудистых заболеваний рекомендовано поддерживать уровень холестерина на самом низком уровне, в то время как для здоровых людей эти цифры могут быть несколько увеличены.
Кроме того, при оценке данных исследования важны не только полученные цифры различных показателей, но и соотношение их между собой, поэтому не стоит делать самостоятельных выводов и ставить себе диагноз только на основании отклонения того или иного показателя от нормы
29 (1). Окисление высших жирных кислот. Последовательность реакций -окисления. Связь окисления жирных кислот с цитратным циклом и ды�хательной цепью. Биологическая роль.
Окисление высших жирных кислот и глицерола в тканях. Биосинтез жирных кислот»
1. Строение высших жирных кислот, триацилглицеролов, фосфолипидов и холестерола. Биологическая роль липидов в организме человека.
2. Липолиз: локализация в клетке и тканях, ферменты, продукты реакции и их использование. Участие гормонов в регуляции липолиза.
3. Окисление глицерола в тканях до СО 2 и Н 2 О (схема), значение для организма.
4. Окисление жирных кислот в тканях: локализация в клетке, транспорт ацильных остатков через митохондриальную мембрану, роль карнитина, последовательность реакций β-окисления, роль витаминных коферментов в этом процессе.
5. Биологическая роль окисления высших жирных кислот. Энергетический баланс β-окисления жирных кислот (выход АТФ).
6. Синтез высших жирных кислот: локализация, исходное соединение, последовательность реакций, мультиферментный комплекс, его регуляция, коферменты. Источники НАДФН и его использование в синтезе жирных кислот.
18.1.1. Окисление жирных кислот происходит в митохондриях клеток и сопровождается выделением большого количества энергии, запасаемой в форме АТФ.
Окислению жирных кислот предшествует их активация , то есть образование ацил-КоА. Эта реакция протекает в цитоплазме в присутствии фермента ацил-КоА-синтетазы за счёт использования энергии АТФ (рисунок 18.1).
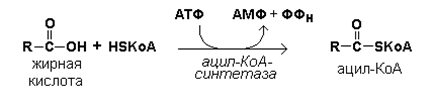
Рисунок 18.1. Реакция активации жирной кислоты.
Следующий этап - транспорт ацил-КоА в митохондрии - происходит при помощи карнитинового механизма. В цитоплазме ацил-КоА взаимодействует с карнитином (γ-триметиламино-β-гидроксибутиратом) при участии фермента карнитин-ацилтрансферазы I. Образовавшийся ацилкарнитин проникает через митохондриальную мембрану. В митохондрии происходит обратная реакция – расщепление ацилкарнитина при участии НS-КоА и митохондриальной карнитин-ацилтрансферазы II. При этом карнитин возвращается в цитоплазму клеток (рисунок 18.2).
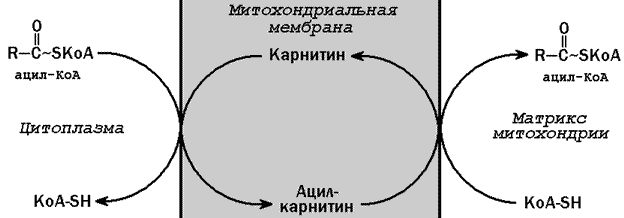
Рисунок 18.2. Схема транспорта жирных кислот через митохондриальную мембрану.
18.1.2. Ацил-КоА подвергается в митохондриях окислению по β-атому углерода (β-окислению). Реакции одного цикла β-окисления жирных кислот представлены на рисунке 18.3.
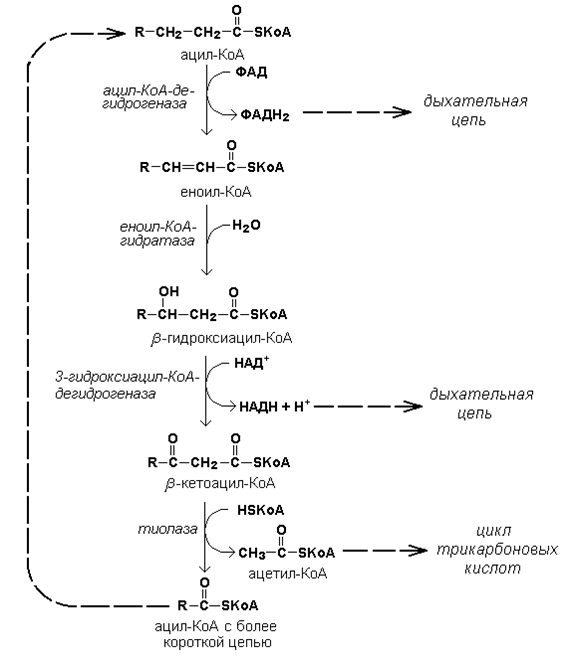
Рисунок 18.3. Реакции одного цикла β-окисления жирных кислот и их связь с циклом трикарбоновых кислот и дыхательной цепью.
Образовавшийся в результате этой последовательности реакций ацил-КоА с более короткой цепью может включаться в новый цикл β-окисления вплоть до образования двух молекул ацетил-КоА. Ацетил-КоА далее окисляется в цикле трикарбоновых кислот Кребса . НАДН и ФАДН 2 служат донорами электронов для дыхательной цепи .
Окисление жирных кислот наиболее активно происходит в миокарде, почках, а также в скелетных мышцах при длительной работе.
18.1.3. При решении задач на расчёт энергетического эффекта окисления жирных кислот необходимо учитывать, что:
1) В каждом цикле β-окисления образуются 1 молекула ФАДН 2 и 1 молекула НАДН. В ходе окисления в дыхательной цепи и сопряжённого с ним окислительного фосфорилирования образуются: 2 молекулы АТФ за счёт дегидрирования ФАДН 2 и 3 молекулы АТФ за счёт дегидрирования НАДН. Таким образом, в сумме за один цикл образуется 5 молекул АТФ.
2) В процессе β-окисления образуются молекулы ацетил-КоА. Окисление каждого ацетильного остатка в цикле трикарбоновых кислот сопровождается в конечном счёте выходом 12 молекул АТФ (см. расчёт энергетического баланса цикла трикарбоновых кислот).
3) Для образования активной формы жирной кислоты (ацил-КоА) затрачивается одна молекула АТФ.
Раздел 18.2
Синтез высших жирных кислот.
18.2.1. Высшие жирные кислоты могут быть синтезированы в организме из метаболитов углеводного обмена. Исходным соединением для этого биосинтеза является ацетил-КоА , образующийся в митохондриях из пирувата – продукта гликолитического распада глюкозы. Место синтеза жирных кислот – цитоплазма клеток, где имеется мультиферментный комплекс синтетаза высших жирных кислот . Этот комплекс состоит из шести ферментов, связанных с ацилпереносящим белком , который содержит две свободные SH-группы (АПБ-SH). Синтез происходит путём полимеризации двууглеродных фрагментов, конечным продуктом его является пальмитиновая кислота – насыщенная жирная кислота, содержащая 16 атомов углерода. Обязательными компонентами, участвующими в синтезе, являются НАДФН (кофермент, образующийся в реакциях пентозофосфатного пути окисления углеводов) и АТФ.
30 (1). Биосинтез жирных кислот в тканях: последовательность реакций, биологическая роль. Компартментализация и регуляция обмена жирных кислот.
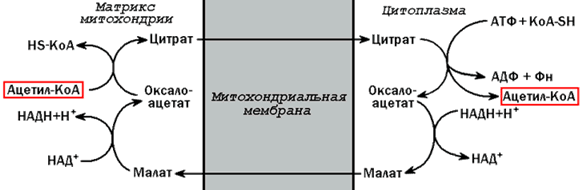
. Ацетил-КоА поступает из митохондрий в цитоплазму при помощи цитратного механизма (рисунок 18.6). В митохондриях ацетил-КоА взаимодействует с оксалоацетатом (фермент – цитратсинтаза ), образующийся цитрат переносится через митохондриальную мембрану при помощи специальной транспортной системы. В цитоплазме цитрат реагирует с HS-КоА и АТФ, вновь распадаясь на ацетил-КоА и оксалоацетат (фермент – цитратлиаза ). 
Рисунок 18.6. Перенос ацетильных групп из митохондрий в цитоплазму.
18.2.3. Начальной реакцией синтеза жирных кислот является карбоксилирование ацетил-КоА с образованием малонил-КоА (рисунок 18.7). Фермент ацетил-КоА-карбоксилаза активируется цитратом и ингибируется КоА-производными высших жирных кислот.
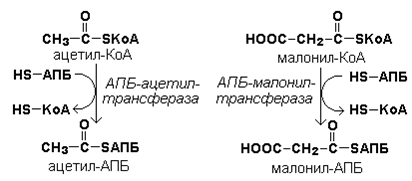
Рисунок 18.7. Реакция карбоксилирования ацетил-КоА.
Затем ацетил-КоА и малонил-КоА взаимодействуют с SH-группами ацилпереносящего белка (рисунок 18.8).

Рисунок 18.8. Взаимодействие ацетил-КоА и малонил-КоА с ацилпереносящим белком.
Далее происходит их конденсация, декарбоксилирование и восстановление образовавшегося продукта (рисунок 18.9).
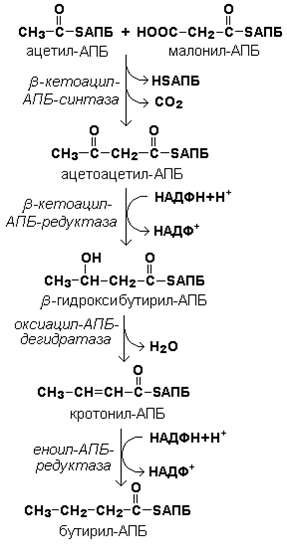
Рисунок 18.9. Реакции одного цикла биосинтеза жирных кислот.
Продукт реакции взаимодействует с новой молекулой малонил-КоА и цикл многократно повторяется вплоть до образования остатка пальмитиновой кислоты.
18.2.4. Запомните основные особенности биосинтеза жирных кислот по сравнению с β-окислением:
синтез жирных кислот в основном осуществляется в цитоплазме клетки, а окисление – в митохондриях;
участие в процессе связывания СО 2 с ацетил-КоА;
в синтезе жирных кислот принимает участие ацилпереносящий белок, а в окислении – коэнзим А;
для биосинтеза жирных кислот необходимы окислительно-восстановительные коферменты НАДФН, а для β-окисления – НАД + и ФАД.
|
|
|
|
 Скачать 1.58 Mb.
Скачать 1.58 Mb.