1 (1). Первичная структура белка. Зависимость свойств и конформации белков от первичной структуры. Примеры полиморфизма белков, гемоглобин а и F, структурные и функциональные отличия
 Скачать 1.58 Mb. Скачать 1.58 Mb.
|
|
Растворимость белков в воде. Из курса биофизической химии известно, что белки как высокомолекулярные соединения образуют коллоидные растворы. Стабильность растворов белков в воде определяется следующими факторами:
Имейте в виду, что под действием различных физических и химических факторов может происходить осаждение белков из коллоидных растворов. Различают:
Заметьте, что в основе реакций осаждения белков могут лежать следующие механизмы:
Чаще всего для действия факторов, вызывающих осаждение белков, характерно сочетание двух или всех трёх перечисленных механизмов. Биологическая активность. В основе функционирования любого белка лежит его способность к избирательному взаимодействию со строго определёнными молекулами или ионами — лигандами. Например, для ферментов, катализирующих химические реакции, лигандами будут вещества, участвующие в этих реакциях (субстраты), а также кофакторы, активаторы и ингибиторы. Для транспортных белков лигандами являются транспортируемые вещества и т.д. Лиганд способен взаимодействовать с определённым участком белковой молекулы — центром связывания или активным центром. Этот центр формируется пространственно сближенными радикалами аминокислот на уровне третичной структуры белка. Способность лиганда взаимодействовать с центром связывания обусловлена их комплементарностью, то есть взаимным дополнением их пространственной структуры (подобно взаимодействию «ключ — замок»). Между функциональными группами лиганда и центра связывания образуются нековалентные (водородные, ионные, гидрофобные) связи. Комплементарностью лиганда и центра связывания можно объяснить высокую специфичность (избирательность) взаимодействия белок — лиганд. Итак, различные белки отличаются друг от друга по своим физико-химическим свойствам и биологической активности. На этих различиях основаны методы разделения белковых смесей на фракции и выделения отдельных ферментных белков. Данные методы широко используются в медицинской биохимии и биотехнологии. 2. Денатурация белков – это изменение нативных (природных) физико-химических и, главное, биологических свойств белка вследствие нарушения его четвертичной, третичной и даже вторичной структуры. Денатурацию белка могут вызвать:
Для денатурированных белков характерно:
Обратите внимание, что при определённых условиях возможно восстановление исходной (нативной) конформации белка после удаления фактора, вызвавшего денатурацию. Этот процесс получил название ренативации. Запомните некоторые примеры использования процесса денатурации белков в медицине:
4 (1). Гемоглобин - аллостерический белок. Конформационные изменения молекулы гемоглобина. Кооперативный эффект. Регуляторы сродства гемоглобина к кислороду. Структурные и функциональные различия миоглобина и гемоглобина. Гемоглобин: аллостерический белок Переход в процессе эволюции от мономерного миоглобина к тетрамерному гемоглобину сопровождался появлением новых свойств. Молекула гемоглобина значительно сложнее, чем молекула миоглобина. Прежде всего гемоглобин помимо 02 транспортирует Н+ и С02. Во-вторых, связывание кислорода гемоглобином регулируется специфическими компонентами внутренней среды, а именно Н + , С02 и органическими фосфорными соединениями. Эти регуляторы оказывают сильнейшее влияние на способность гемоглобина связывать кислород, несмотря на то что они присоединяются к белку в участках, отстоящих далеко от гема. Вообще так называемое аллостериче-ское взаимодействие, т.е. взаимодействие между пространственно разделенными участками, имеет место во многих белках. Аллостерические эффекты играют важнейшую роль в регуляции и интеграции молекулярных процессов в биологических системах. Гемоглобин является наиболее изученным аллостерическим белком, и потому имеет смысл более подробно рассмотреть его структуру и функцию. КОНФОРМАЦИОННЫМИ ИЗМЕНЕНИЯМИ В ГЕМОГЛОБИНЕ Связывание кислорода сопровождается разрывом солевых связей, образованных концевыми карбоксильными группами субъединиц (рис.7) Это облегчает связывание следующих молекул кислорода, поскольку при этом требуется разрыв меньшего числа солевых связей. Указанные изменения заметно влияют на вторичную, третичную и особенно четвертичную структуру гемоглобина. При этом одна А/В-пара субъединиц поворачивается относительно другой А/В-пары, что приводит к компактизации тетрамера и повышению сродства гемов к кислороду (рис. 8 и 9). КОНФОРМАЦИОННЫЕ ИЗМЕНЕНИЯ В ОКРУЖЕНИЕ ГЕМОГРУППЫ Оксигенирование гемоглобина сопровождается структурными изменениями в окружении гемогруппы. При оксигенировании атом железа, который в дезоксигемоглобине выступал на 0,06 нм из плоскости гемового кольца, втягивает в эту плоскость (рис. 10). Вслед за атомом железа ближе к гему перемещается проксимальный гистидин (F8), а также связанные с ним соседние остатки. Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода. Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН. Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей . Нативная трехмерная структура устанавливается в результате действия целого ряда энергетических и энтропийных факторов. Изменение конформационного состояния молекулы белка за счет различных внешних воздействий (рН, температура, ионный состав) отражается и на его функциональной активности. Конформационные перестройки происходят весьма быстро. На первых стадиях они носят локальный микроконформационный характер, вызывая смещения лишь отдельных атомных групп. Распространение таких локальных смещений на остальные области макромолекулярной структуры приведет уже к общему конформационному изменению молекулы биополимера. Миоглобин — состоит из одной полипептидной цепи, включающей 153 аминокислотных остатка, и одной железопорфириновой группы (гем) на молекулу. Миоглобин относится к гемопротеинам, могущим обратимо связывать кислород; в клетках скелетной мышцы он ответствен за резервирование кислорода, а также за увеличение скорости его диффузии через клетки. Филогенетически миоглобин — предшественник гемоглобина. Молекула не содержит дисульфидиых связей и характеризуется -спиральностью на 77%. Гем, ответственный за связывание кислорода, находится в «гидрофобном кармане», образованном особыми, для этого предназначенными аминокислотами. Гем представляет собой макроцикл протопорфирина с координационно связанным ионом двухвалентного железа, находящимся в центре молекулы. Такая пространственная фиксация гема делает возможным связывание молекулы кислорода в качестве шестого лиганда. Гемоглобин — «дыхательный» белок крови. Он осуществляет транспорт кислорода по кровеносной системе легких к другим органам и центрам потребления. Молекула гемоглобина состоит из четырех попарно идентичных полипептидных цепей, каждая из которых несет гем. Полипептидные цепи гемоглобина называют и ,а симметричное строение молекулы записывают как 22.Образование четвертичной структуры осуществляется путем гидрофобных взаимодействий между отдельными полипептидными цепями. При присоединении кислорода к гему образуется оксигемоглобин, четвертичная структура которого лишь незначительно отличается от неоксигенированной формы. 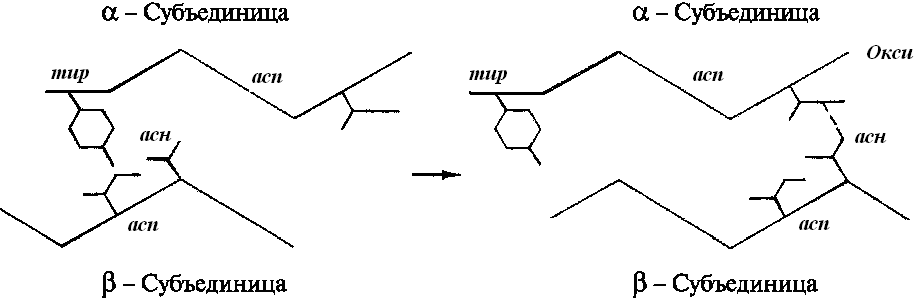 Присоединение кислорода индуцирует ряд конформационных изменений в молекуле НЬ. Связывание кислорода с переводом иона Fe2+ в низкоспиновое состояние сопровождается одновременным смещением железа в плоскость гемовой группы. Происходит поэтапный разрыв солевых мостиков между -субъединицами. Расстояние между гемами --субъединиц увеличивается, а между гемами -субъединиц сокращается. В целом оксигенация переводит каждую из субъединиц из дезокси- и оксиконформацию. Разрыв четырех солевых мостиков из шести при оксигенации первых двух -субъединиц способствует разрыву двух остальных мостиков и, следовательно, облегчает присоединение следующих молекул кислорода к остальным субъединицам, увеличивая сродство их к кислороду в несколько сотен раз. В этом и состоит кооперативный характере присоединения. 5 (1). Первичная и вторичная структуры ДНК. Правила Чаргаффа. Принцип комплементарности. Типы связей в молекуле ДНК. Биологическая роль ДНК. Молекулярные болезни - следствие генных мутаций. Первичная структура ДНК - порядок чередования дезоксирибонуклеозидмонофосфатов (дНМФ) в полинукпеотидной цепи. Каждая фосфатная группа в полинукпеотидной цепи, за исключением фосфорного остатка на 5'-конце молекулы, участвует в образовании двух эфирных связей с участием 3'- и 5'-углеродных атомов двух соседних дезоксирибоз, поэтому связь между мономерами обозначают 3', 5'-фосфодиэфирной. Концевые нуклеотиды ДНК различают по структуре: на 5'-конце находится фосфатная группа, а на 3'-конце цепи - свободная ОН-группа. Эти концы называют 5'- и 3'-концами. Линейная последовательность дезоксирибонуклеотидов в полимерной цепи ДНК обычно сокращённо записывают с помощью однобуквенного кода, например -A-G-C-T-T-A-C-A- от 5'- к 3'-концу. В каждом мономере нуклеиновой кислоты присутствует остаток фосфорной кислоты. При рН 7 фосфатная группа полностью ионизирована, поэтому in vivo нуклеиновые кислоты существуют в виде полианионов (имеют множественный отрицательный заряд). Остатки пентоз тоже проявляют гидрофильные свойства. Азотистые основания почти нерастворимы в воде, но некоторые атомы пуринового и пиримидинового циклов способны образовывать водородные связи. Вторичная структура ДНК. В 1953 г. Дж. Уотсоном и Ф. Криком была предложена модель пространственной структуры ДНК. Согласно этой модели, молекула ДНК имеет форму спирали, образованную двумя полинуклеотидными цепями, закрученными относительно друг друга и вокруг общей оси. Двойная спираль правозакрученная, полинуклеотидньхе цепи в ней антипараллельны(рис. 4-6), т.е. если одна из них ориентирована в направлении 3'→5', то вторая - в направлении 5'→3'. Поэтому на каждом из концов 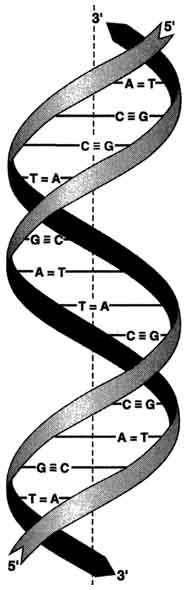 Рис. 4-6. Двойная спираль ДНК. Молекулы ДНК состоят из двух антипараллельных цепей с комплементарной последовательностью нукпеотидов. Цепи закручены относительно друг друга в правозакрученную спираль так, что на один виток приходится примерно 10 пар нуклеотидов. молекулы ДНК расположены 5'-конец одной цепи и 3'-конец другой цепи. Все основания цепей ДНК расположены внутри двойной спирали, а пентозофосфатный остов - снаружи. Полинуклеотидные цепи удерживаются относительно друг друга за счёт водородных связей между комплементарными пуриновыми и пиримидиновыми азотистыми основаниями А и Т (две связи) и между G и С (три связи) (рис. 4-7). При таком сочетании каждая 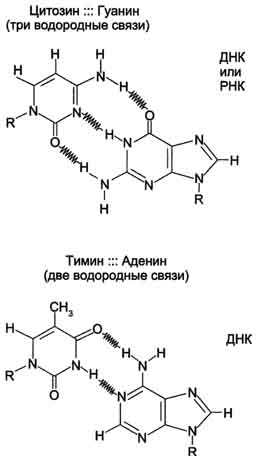 Рис. 4-7. Пурин-пиримидиновые пары оснований в ДНК. пара содержит по три кольца, поэтому общий размер этих пар оснований одинаков по всей длине молекулы. Водородные связи при других сочетаниях оснований в паре возможны, но они значительно слабее. Последовательность нуклеотидов одной цепи полностью комплементарна последовательности нуклеотидов второй цепи. Поэтому, согласно правилу Чаргаффа (Эрвин Чаргафф в 1951 г. установил закономерности в соотношении пуриновых и пиримидиновых оснований в молекуле ДНК), число пуриновых оснований (А + G) равно числу пиримидиновых оснований (Т + С). Комплементарые основания уложены в стопку в сердцевине спирали. Между основаниями двухцепочечной молекулы в стопке возникают гидрофобные взаимодействия, стабилизирующие двойную спираль. Такая структура исключает контакт азотистых остатков с водой, но стопка оснований не может быть абсолютно вертикальной. Пары оснований слегка смещены относительно друг друга. В образованной структуре различают две бороздки - большую, шириной 2,2 нм, и малую, шириной 1,2 нм. Азотистые основания в области большой и малой бороздок взаимодействуют со специфическими белками, участвующими в организации структуры хроматина. Пра́вила Ча́ргаффа — система эмпирически выявленных правил, описывающих количественные соотношения между различными типами азотистых оснований в ДНК. Были сформулированы в результате работы группы биохимика Эрвина Чаргаффа в 1949—1951 гг. До работ группы Чаргаффа господствовала так называемая «тетрануклеотидная» теория, согласно которой ДНК состоит из повторяющихся блоков по четыре разных азотистых основания (аденин, тимин, гуанин и цитозин). Чаргаффу и сотрудникам удалось разделить нуклеотиды ДНК при помощи бумажной хроматографии и определить точные количественные соотношения нуклеотидов разных типов. Они значительно отличались от эквимолярных, которых можно было бы ожидать, если бы все четыре основания были представлены в равных пропорциях. Соотношения, выявленные Чаргаффом для аденина (А), тимина (Т), гуанина (Г) и цитозина (Ц), оказались следующими:
Вместе с тем, соотношение (A+Т):(Г+Ц) может быть различным у ДНК разных видов. У одних преобладают пары АТ, в других — ГЦ. Правила Чаргаффа, наряду с данными рентгеноструктурного анализа, сыграли решающую роль в расшифровке структуры ДНК Дж. Уотсоном и Фрэнсисом Криком. Комплемента́рность (в химии, молекулярной биологии и генетике) — взаимное соответствие молекул биополимеров или их фрагментов, обеспечивающее образование связей между пространственно взаимодополняющими (комплементарными) фрагментами молекул или их структурных фрагментов вследствие супрамолекулярных взаимодействий (образование водородных связей, гидрофобных взаимодействий, электростатических взаимодействий заряженных функциональных групп и т. п.). Взаимодействие комплементарных фрагментов или биополимеров не сопровождается образованием ковалентной химической связи между комплементарными фрагментами, однако из-за пространственного взаимного соответствия комплементарных фрагментов приводит к образованию множества относительно слабых связей (водородных и ван-дер-ваальса) с достаточно большой суммарной энергией, что приводит к образованию устойчивых молекулярных комплексов. Вместе с тем следует отметить, что механизм каталитичекой активности ферментов определяется комплементарностью фермента и переходного состояния либо промежуточного продукта катализируемой реакции — и в этом случае может происходить обратимое образование химической связи. Комплементарность нуклеиновых кислот В случае нуклеиновых кислот — как олиго- так и полинуклеотидов азотистые основания нуклеотидов способны вследствие образования водородных связей формировать парные комплексы аденин—тимин (или урацил в РНК) и гуанин—цитозин при взаимодействии цепей нуклеиновых кислот. Такое взаимодействие играет ключевую роль в ряде фундаментальных процессов хранения и передачи генетической информации: репликации ДНК, обеспечивающей передачу генетической информации при делении клетки, транскрипцииДНК в РНК при синтезе белков, кодируемых ДНК гена, хранении генетической информации в двухцепочечной ДНК и процессах репарации ДНК при её повреждении. ДНК Принцип комплементарности используется в синтезе ДНК. Это строгое соответствие соединения азотистых оснований, соединёнными водородными связями, в котором: А-Т (Аденинсоединяется с Тимином) Г-Ц (Гуанин соединяется с Цитозином) Ферментативный катализ Комплементарное связывание фермент-субстрат является ключевым фактором в механизме ферментативной активности и, в отличие описанных выше ситуаций с образованием химически несвязанных комплексов может приводить к инициированию химической реакции — в случае связи фермента с субстратом комплементарность относительно невысока, однако при высокой комплементарности к переходному реакционному состоянию субстрата происходит стабилизация этого состояния, что приводит к эффекту каталитической активности ферментов: такая стабилизация переходного состояния эквивалентна снижению энергии активации и, соответственно, резкому увеличению скорости реакции. Двойная спираль В зависимости от концентрации ионов и нуклеотидного состава молекулы, двойная спираль ДНК в живых организмах существует в разных формах. На рисунке представлены формы A, B и Z(слева направо) Полимер ДНК обладает довольно сложной структурой. Нуклеотиды соединены между собой ковалентно в длинныеполинуклеотидные цепи. Эти цепи в подавляющем большинстве случаев (кроме некоторых вирусов, обладающих одноцепочечными ДНК-геномами) попарно объединяются при помощи водородных связей во вторичную структуру, получившую название двойнойспирали[3][10]. Остов каждой из цепей состоит из чередующихся фосфатов и сахаров[14]. Внутри одной цепи ДНК соседние нуклеотиды соединены фосфодиэфирными связями, которые формируются в результате взаимодействия между 3'-гидроксильной (3'—ОН) группой молекулы дезоксирибозы одного нукдеотида и 5'-фосфатной группой (5'—РО3) другого. Асимметричные концы цепи ДНК называются 3' (три прим) и 5' (пять прим). Полярность цепи играет важную роль при синтезе ДНК (удлинение цепи возможно только путём присоединения новых нуклеотидов к свободному 3'-концу). Как уже было сказано выше, у подавляющего большинства живых организмов ДНК состоит не из одной, а из двух полинуклеотидных цепей. Эти две длинные цепи закручены одна вокруг другой в виде двойной спирали, стабилизированнойводородными связями, образующимися между обращёнными друг к другу азотистыми основаниями входящих в неё цепей. В природе эта спираль, чаще всего, правозакрученная. Направления от 3'-конца к 5'-концу в двух цепях, из которых состоит молекула ДНК, противоположны (цепи «антипараллельны» друг другу). Ширина двойной спирали составляет от 22 до 24 Å, или 2,2 — 2,4 нм, длина каждого нуклеотида 3,3 Å (0,33 нм)[15]. Подобно тому, как в винтовой лестнице сбоку можно увидеть ступеньки, на двойной спирали ДНК в промежутках между фосфатным остовом молекулы можно видеть рёбра оснований, кольца которых расположены в плоскости, перпендикулярной по отношению к продольной оси макромолекулы. В двойной спирали различают малую (12 Å) и большую (22 Å) бороздки[16]. Белки, например, факторы транскрипции, которые присоединяются к определённым последовательностям в двухцепочечной ДНК, обычно взаимодействуют с краями оснований в большой бороздке, где те более доступны. Биологическая роль ДНК Функция ДНК в клетке – хранение наследственной информации. Функциональной единицей является ген. Ген – определенная последовательность нуклеотидов (500 – 2000 нуклеотидных единиц) с помощью которых закодирован определенный признак (морфогенез, старение, устойчивость к антибиотикам, половая дифференциация, цвет кожи, глаз). Структурный ген – закодированный признак. Для его функционирования необходимо 2 регуляторных гена: ген – регулятор и ген – оператор (они могут быть рядом, могут быть удалены). Ген – оператор, ген – регулятор и структурный ген вместе составляют оперон. Оперон – функциональная надструктура генетического аппарата. Сколько признаков, сколько оперонов, например, к структурным генам относится гены, ответственные за синтез белка и если белков- 5 миллионов, то оперонов – 5 миллионов. Молекулярные болезни - это большая группа заболеваний, в основе которых лежат нарушения в структуре молекул ДНК, т.е. генные мутации. Учитывая последнее, эти заболевания называют также генными болезнями. Молекулярные болезни чрезвычайно разнообразны по характеру кли нических симптомов, тяжести течения и прогнозу. Точное количество таких заболеваний не известно, однако, исходя из того, что в организме имеется около 30 тыс. генов и, теоретически, каждый из них может мутировать один или несколько раз, можно допустить, что количество возможных генных бо лезней будет, если не превышать число генов, то, по крайней мере, соответствовать их сумме. По одной из последних сводок известного генетика Мак-Кьюсика (1988, США) в настоящее время описано 2106 аутосомно-доминантных, 1321 аутосомно-рецессивных и 276 X - сцепленных молекулярных заболеваний. В эту сводку вошли только моногенно наследуемые заболевания, подчиняющиеся менделевским закономерностям. Однако, помимо моногенных заболеваний, имеет место большое число молекулярных болезней с полигенным типом наследования (например, гипертоническая болезнь, атеросклероз, диабет, эпилепсия, шизофрения и многие другие). Для этих заболеваний характерна высокая зависимость не только от особенностей генотипа, но и средовых факторов (стрессы, неправильное питание, инфекции, неизвестные агенты). Эти заболевания получили название мультифакториальных. Для этих заболеваний имеются значительные трудности в определении риска рождения больного ребенка, поскольку наследуемость не подчиняется менделевским правилам. При молекулярных болезнях мутации происходят не только в структурных, но и регуляторных генах. Однако, в любом случае, это сопровождается нарушением синтеза каких-либо белков: ферментных, транспортных или структурных. Если блокируются ферментные белки, развиваются различные патологические состояния, получившие название энзимопатии (греч. "энзим" - фермент, "патос" - страдание, болезнь). Следствием энзимопатии являются болезни обмена. Причем, нарушаться может любой вид обмена: аминокислотный, белковый, углеводный, липидный, минеральный и другие. При болезнях обмена, обусловленных отсутствием какого-либо фермента, снижением его активности или уровня содержания в организме, нака пливаются вещества, подлежащие расщеплению (например, продукты промежуточного обмена), или же какие-то аномальные продукты. Накапливаясь в организме, они оказывают на него токсическое действие, что приводит к развитию различных патологических признаков. Клинически выраженные симптомы молекулярных болезней могут проявляться в разные периоды онтогенеза. Некоторые из них диагностируются сразу после рождения, поскольку сопровождаются выраженными внутриутробными пороками развития. Другие - проявляют себя в раннем детстве, третьи - на более поздних периодах индивидуального развития, чаще до на ступления репродуктивного (детородного) возраста. Многие генные болезни характеризуются нарушениями не только физического, но и психического развития, и, как правило, в большинстве случаев укорачивают жизнь больного, приводят к частичной или полной инвалидности. Характерный для молекулярных болезней полиморфизм (многообразие) патологических симптомов является следствием не только мутаций, происходящих в разных генах, но и особенностями действия на них генов-модификаторов и различных средовых факторов. В итоге при сходном генотипе патологические признаки имеют различную экспрессивность и пенетрантность даже среди ближайших родственников. В то же время сходные симптомокомплексы могут наблюдаться при мутациях различных генов (генокопии). Это объясняется тем, что разные мутации могут нарушать процесс функционирования одного и того же звена. А мутации в пределах одного и того же гена (множественные аллели) могут приводить к формированию различных фенотипов. Например, метгемоглобинемия - это, в отличие от серповидноклеточной анемии, совершенно другое заболевание, хотя мутация в обоих случаях приходится на один и тот же локус. Общая частота молекулярных болезней в человеческих популяциях составляет 1 -2%. Однако доказано то, что среди детей этот показатель в три раза выше, чем среди взрослых. Условно считают частоту генных болезней высокой, если встречается 1 больной на 10 тыс. новорожденных; средней - в случае, если больной при ходится на 10-40 тыс. новорожденных, а далее - низкой. Многие молекулярные болезни могут лечиться при условии, что лечение начато своевременно. В связи с этим разработаны просеивающие программы (скрининг-программы) по раннему выявлению наиболее часто встречающихся генных болезней. Для этого используются простые биохимические методы диагностики, с помощью которых в крови, моче, околоплодных водах при массовых обследованиях определяются аномальные продукты обмена. Скрининговые методы качественные и должны быть специфичными. Важно правильно выбрать время скрининга: в доклинический период развития заболевания, т.е. в досимптомный период, когда возможно эффективное лечение. Кроме чисто биохимических методов, в состав просеивающих программ включают такие специальные методы, как микробиологические тесты, электрофорез, хроматография, радио-иммунологический метод. В практике мирового здравоохранения используются 2 типа просеивающих программ. 1.Среди новорожденных на нарушение аминокислотного обмена - аминоацидопатии, галактоземию, гипотиреоз, муковисцидоз и недостаточность α1 – антитрипсина. 2.Среда определенных расовых и национальных групп на гетерозиготное носительство болезни Тея-Сакса, серповидно-клеточной анемии и талассемии. Кроме того, показанием к скринингу у новорожденных в любом случае служат такие нарушения, как судороги, летаргия, кома, трудности кормле ния, рвота, двигательные беспокойства, необычный запах, катаракта и др. 6 (1). Роль ферментов в метаболизме. Многообразие ферментов. Специфичность действия ферментов. Классификация ферментов. Изоферменты, мультиферменты. Все химические реакции в клетке протекают при участии ферментов. Поэтому, чтобы воздействовать на скорость протекания метаболического пути, достаточно регулировать количество или активность ферментов. Обычно в метаболических путях есть ключевые ферменты, благодаря которым происходит регуляция скорости всего пути. Эти ферменты (один или несколько в метаболическом пути) называются регуляторными ферментами; они катализируют, как правило, начальные реакции метаболического пути, необратимые реакции, скорость-ли-митирующие реакции (самые медленные) или реакции в месте переключения метаболического пути (точки ветвления). Регуляция скорости ферментативных реакций осуществляется на 3 независимых уровнях:
110 
112 специфичность по отношению к лигандам: она может быть абсолютной и групповой. Некоторые ферменты имеют несколько аллостерических центров, одни из которых специфичны к активаторам, другие - к ингибиторам.
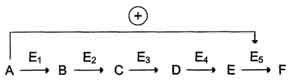
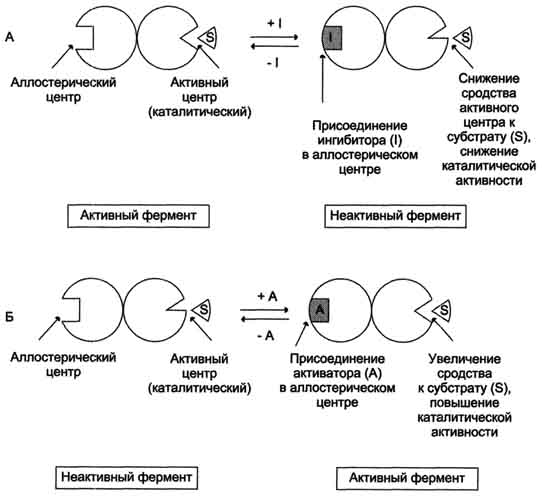 Рис. 2-30. Схема, поясняющая работу аллостерического фермента. А - действие отрицательного эффектора (ингибитора); Б - действие положительного эффектора (активатора). 113 логичной, так как при накоплении конечного продукта он (конечный продукт) может действовать как аллостерический ингибитор фермента, катализирующего чаще всего начальный этап данного метаболического пути: 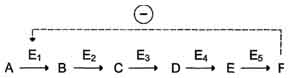
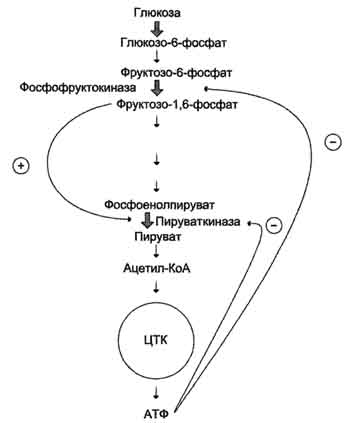 Многообразие ферментов, их классификация Названия ферментов производят от названий субстратов, на которые они действуют, по схеме: тип катализируемой данным ферментом реакции + название одного из продуктов реакции (или одного из ее участников) с прибавлением окончания -аза. Окончание -аза служит для обозначения ферментной природы. Например: фермент молочная оксидаза (другое название – дегидрогеназа) катализирует превращение молочной кислоты в уксусную. По названию фермента можно понять сущность реакции. Почти каждая химическая реакция в клетке катализируется особым ферментом. Число реакций в клетке достигает нескольких тысяч. Соответственно, в клетке обнаружено несколько тысяч ферментов. И чтобы не запутаться в их многообразии, их классифицируют. Давайте поработаем с опорным конспектом и учебником: назовите группу ферментов и укажите их функцию (фронтальная работа – по цепочке)
|
