1 (1). Первичная структура белка. Зависимость свойств и конформации белков от первичной структуры. Примеры полиморфизма белков, гемоглобин а и F, структурные и функциональные отличия
 Скачать 1.58 Mb. Скачать 1.58 Mb.
|
Дегидрогеназ пирувата и реакции пируват формиат лиазыКислородное преобразование пирувата в ацетил-КоА называют реакцией дегидрогеназа пирувата. Она катализируется пируватдегидрогеназным комплексом. Другие преобразования между пируватом и ацетил-КоА возможны. Например, пируват формиат лиазы преобразуют пируват в ацетил-КоА и муравьиную кислоту. Метаболизм жирных кислотУ животных ацетил-КоА является основой баланса между углеводным обменом и жировым обменом. Обычно ацетил-КоА из метаболизма жирных кислот поступает в цикл трикарбоновых кислот, содействуя энергетическому обеспечению клеток. В печени, когда уровень циркуляции жирных кислот высок, производство ацетил-КоА от разрыва жиров превышает энергетические потребности клетки. Чтобы использовать энергию, доступную из лишних ацетил-КоА, создаются кетоновые тела, которые затем могут циркулировать в крови. В некоторых обстоятельствах это может привести к высокому уровню кетоновых тел в крови, состоянию, называемому кетозом, которое отличается от кетоацидоза, опасного состояния, способного повлиять на диабетиков. У растений синтез новых жирных кислот происходит в пластидах. Многие семена запасают большие количества масел в семенах, чтобы поддерживать прорастание и ранний рост саженцов, пока они не перешли на питание от фотосинтеза. Жирные кислоты включены в липиды мембраны, главнейший компонент большинства мембран. Другие реакции
14 (1). Цикл трикарбоновых кислот: последовательность реакций, харак теристика ферментов. Амфиболическая функция цитратного цикла. Связь с обменом углеводов, жиров и белков. Реакции цикла Кребса относятся к третьей стадии катаболизма питательных веществ и происходят в митохондриях клетки. Эти реакции относятся к общему пути катаболизма и характерны для распада всех классов питательных веществ (белков, липидов и углеводов). Главной функцией цикла является окисление ацетильного остатка с образованием четырёх молекул восстановленных коферментов (трёх молекул НАДН и одной молекулы ФАДН2), а также образование молекулы ГТФ путём субстратного фосфорилирования. Атомы углерода ацетильного остатка выделяются в виде двух молекул СО2. 8.4.2. Цикл Кребса включает 8 последовательных стадий, обращая особое внимание на реакции дегидрирования субстратов: 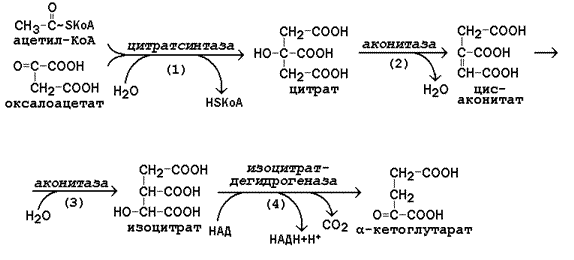 Рисунок 8.6. Реакции цикла Кребса, включая образование α-кетоглутарата а) конденсация ацетил-КоА с оксалоацетатом, в результате которой образуется цитрат (рис.8.6, реакция 1); поэтому цикл Кребса называют также цитратным циклом. В этой реакции метильный углерод ацетильной группы взаимодействует с кетогруппой оксалоацетата; одновременно происходит расщепление тиоэфирной связи. В реакции освобождается КоА-SH, который может принять участие в окислительном декарбоксилировании следующей молекулы пирувата. Реакцию катализирует цитратсинтаза, это – регуляторный фермент, он ингибируется высокими концентрациями НАДН, сукцинил-КоА, цитрата. б) превращение цитрата в изоцитрат через промежуточное образование цис-аконитата. Образующийся в первой реакции цикла цитрат содержит третичную гидроксильную группу и не способен окисляться в условиях клетки. Под действием фермента аконитазы идёт отщепление молекулы воды (дегидратация), а затем её присоединение (гидратация), но другим способом (рис.8.6, реакции 2-3). В результате данных превращений гидроксильная группа перемещается в положение, благоприятствующее её последующему окислению. в) дегидрирование изоцитрата с последующим выделением молекулы СО2 (декарбоксилированием) и образованием α-кетоглутарата (рис. 8.6, реакция 4). Это – первая окислительно-восстановительная реакция в цикле Кребса, в результате которой образуется НАДН. Изоцитратдегидрогеназа, катализирующая реакцию, - регуляторный фермент, активируется АДФ. Избыток НАДН ингибирует фермент. 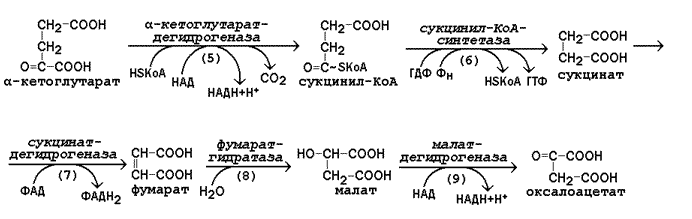 Рисунок 8.7. Реакции цикла Кребса, начиная с α-кетоглутарата. г) окислительное декарбоксилирование α-кетоглутарата, катализируется мультиферментным комплексом (рис. 8.7, реакция 5), сопровождается выделением СО2 и образованием второй молекулы НАДН. Эта реакция аналогична пируватдегидрогеназной реакции. Ингибитором служит продукт реакции – сукцинил-КоА. д) субстратное фосфорилирование на уровне сукцинил-КоА, в ходе которого энергия, освобождающаяся при гидролизе тиоэфирной связи, запасается в форме молекулы ГТФ. В отличие от окислительного фосфорилирования, этот процесс протекает без образования электрохимического потенциала митохондриальной мембраны (рис. 8.7, реакция 6). е) дегидрирование сукцината с образованием фумарата и молекулы ФАДН2 (рис. 8.7, реакция 7). Фермент сукцинатдегидрогеназа прочно связан с внутренней мембраной митохондрии. ж) гидратация фумарата, в результате чего в молекуле продукта реакции появляется легко окисляемая гидроксильная группа (рис. 8.7, реакция 8). з) дегидрирование малата, приводящее к образованию оксалоацетата и третьей молекулы НАДН (рис.8.7, реакция 9). Образующийся в реакции оксалоацетат может вновь использоваться в реакции конденсации с очередной молекулой ацетил-КоА (рис. 8.6, реакция 1). Поэтому данный процесс носит циклический характер. 8.4.3. Таким образом, в результате описанных реакций подвергается полному окислению ацетильный остаток СН3-СО-. Количество молекул ацетил-КоА, превращаемых в митохондриях в единицу времени, зависит от концентрации оксалоацетата. Основные пути увеличения концентрации оксалоацетата в митохондриях (соответствующие реакции будут рассмотрены позднее): а) карбоксилирование пирувата – присоединение к пирувату молекулы СО2 с затратой энергии АТФ; б) дезаминирование или трансаминирование аспартата – отщепление аминогруппы с образованием на её месте кетогруппы. 8.4.4. Некоторые метаболиты цикла Кребса могут использоваться для синтеза структурных блоков для построения сложных молекул. Так, оксалоацетат может превращаться в аминокислоту аспартат, а α–кетоглутарат – в аминокислоту глутамат. Сукцинил-КоА принимает участие в синтезе гема – простетической группы гемоглобина. Таким образом, реакции цикла Кребса могут участвовать как в процессах катаболизма, так и анаболизма, то есть цикл Кребса выполняет амфиболическую функцию (см. 8.1). Анаболическая функция — использование субстратов цикла на синтез органических веществ:
 14 (1). Окисление НАДН2 и ФАДН2 в митохондриях. Характеристика основных компонентов дыхательной цепи. Ферментные комплексы. Дегидрирование субстратов и окисление водорода как источник энергии для синтеза АТФ. Роль АТФ в организме. Водород на двух переносчиках (10 молекулах восстановленного НАД и двух молекулах восстановленного ФАД) направляется теперь к внутренней мембране митохондрий. Эта мембрана образует складки, так называемые кристы, увеличивающие площадь ее поверхности. Водород — это топливо. Мы уже отмечали, что при его окислении молекулярным кислородом образуется вода и выделяется энергия: 2Н2 + 02 --------> 2Н20+ Энергия Часть этой энергии используется для синтеза АТФ из АДФ и неорганического фосфата при окислительном фосфорилировании. Энергия не выделяется вся сразу в одной какой-нибудь реакции. Процесс разбит на ряд небольших этапов и среди них есть такие, на которых выделяется достаточно энергии для синтеза АТФ. Данная последовательность реакций известна как дыхательная цепь. В дыхательной цепи участвует ряд переносчиков водорода и электронов, заканчивается же она кислородом. Водород или электроны переходят от одного переносчика к другому, двигаясь в энергетическом смысле «вниз» до тех пор, пока на конечном этапе они не восстановят молекулярный кислород до воды. На каждом этапе выделяется некоторое количество энергии, причем в нескольких пунктах этот переход сопряжен с синтезом АТФ. В подписи к рисунку сказано о дыхательной цепи несколько более подробно. На конечном этапе действует медьсодержащий переносчик, называемый цитохро-моксидазой. Цианид (или моноксид углерода) блокирует клеточное дыхание на этом этапе. Цианид связывается с медью, после чего кислород уже не может с ней соединиться. На рисунке видно, что на каждую молекулу восстановленного НАД, поступающую в дыхательную цепь, при переходе водорода или электронов к кислороду образуются 3 молекулы АТФ. Однако на каждую молекулу восстановленного ФАД образуется всего лишь две молекулы АТФ, потому что восстановленный ФАД поступает в дыхательную цепь на более низком энергетическом уровне. Общий баланс для дыхательной цепи приведен в таблице. 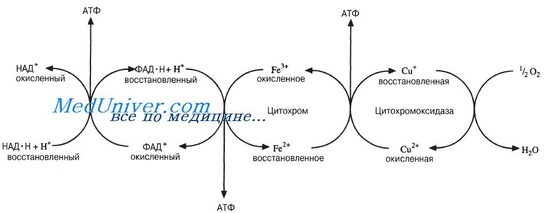 Суммарное уравнение для дыхательной цепи имеет вид: 12Н2 + 602---------> 12Н20 + 34АТФ Объединим два приведенных ниже уравнения, 1 и 2: Итак, на каждую молекулу глюкозы, окисленную в процессе аэробного дыхания, образуется 38 молекул АТФ Суммарное уравнение для дыхательной цепи имеет вид: 12Н2 + 602---------> 12Н20 + 34АТФ Объединим два приведенных ниже уравнения, 1 и 2: Итак, на каждую молекулу глюкозы, окисленную в процессе аэробного дыхания, образуется 38 молекул АТФ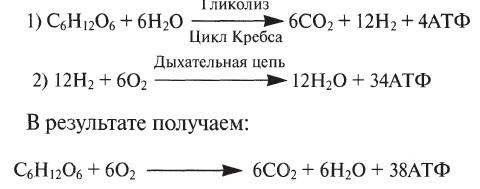 Дыхательная цепь включает четыре мультиферментных комплекса: 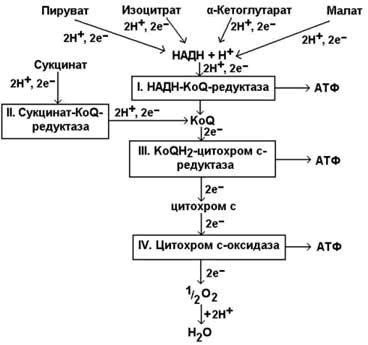 I. НАДН-KoQ-редуктаза (содержит промежуточные акцепторы водорода: флавинмононуклеотид и железосерные белки). II. Сукцинат-KoQ-редуктаза (содержит промежуточные акцепторы водорода: ФАД и железосерные белки). III. KoQН2-цитохром с-редуктаза (содержит акцепторы электронов: цитохромы b и с1, железосерные белки). IV. Цитохром с-оксидаза (содержит акцепторы электронов: цитохромы а и а3, ионы меди Cu2+). Главная роль АТФ в организме связана с обеспечением энергией многочисленных биохимических реакций. Являясь носителем двух высокоэнергетических связей, АТФ служит непосредственным источником энергии для множества энергозатратных биохимических и физиологических процессов. Всё это реакции синтеза сложных веществ в организме: осуществление активного переноса молекул черезбиологические мембраны, в том числе и для создания трансмембранного электрического потенциала; осуществления мышечного сокращения. Помимо энергетической АТФ выполняет в организме ещё ряд других не менее важных функций:
15 (1). Сопряжение окисления с фосфорилированием в дыхатель ной цепи. Н+-АТФсинтетаза мембран митохондрий. Коэффициент Р/О. Разобщение дыхания и фосфорилирования. Гипоэнергетические состояния. . Степень сопряжённости окисления и фосфорилирования в митохондриях характеризует коэффициент фосфорилирования (Р/О). Он равен отношению количества молекул неорганического фосфата (Н3РО4), перешедшего в АТФ, к количеству атомов потреблённого кислорода (О2). Например, если донором водорода для дыхательной цепи является молекула НАДН, то электроны от донора (НАДН) к акцептору (кислород) проходят 3 участка сопряжения окисления и фосфорилирования (I, III и IV ферментные комплексы дыхательной цепи). Таким образом, максимально может образоваться 3 молекулы АТФ (3 АДФ + 3 Н3РО4 → 3 АТФ). Затрачивается 1 атом кислорода (2 Н + О → Н2О). Значение коэффициента Р/О = 3/1 = 3. Если донором водорода будет молекула ФАДН2, то электроны в дыхательной цепи проходят 2 участка сопряжения окисления и фосфорилирования (III и IV ферментные комплексы дыхательной цепи). Таким образом, максимально может образоваться 2 молекулы АТФ (2 АДФ + 2 Н3РО4 → 2 АТФ). Затрачивается, как и в предыдущем случае, 1 атом кислорода (2 Н + О → Н2О). Значение коэффициента Р/О = 2/1 = 2. 8.2.2. Более сложный пример расчёта коэффициента фосфорилирования – при окислении пирувата до конечных продуктов - показан на рисунке 8.5. В этом метаболическом пути происходит дегидрирование 4 субстратов (пирувата, изоцитрата, α-кетоглутарата и малата) с образованием НАДН и одного субстрата (сукцината) с образованием ФАДН2. Восстановленные коферменты окисляются в дыхательной цепи, и в сопряжённых реакциях фосфорилирования образуется (4×3 АТФ + 1×2 АТФ)=14 молекул АТФ. Ещё 1 молекула АТФ (ГТФ) образуется в реакции субстратного фосфорилирования на уровне сукцинил-КоА. Таким образом, при полном окислении 1 молекулы пирувата образуется 15 молекул АТФ (из них 14 - путём окислительного фосфорилирования). Чтобы рассчитать количество потреблённого кислорода, нужно знать число реакций дегидрирования на данном участке метаболического пути. Для окисления каждой восстановленной формы кофермента необходим 1 атом кислорода (см. выше). Следовательно, в нашем примере потребляется 5 атомов кислорода. Значение коэффициента Р/О будет равно 14/5 = 2,8. 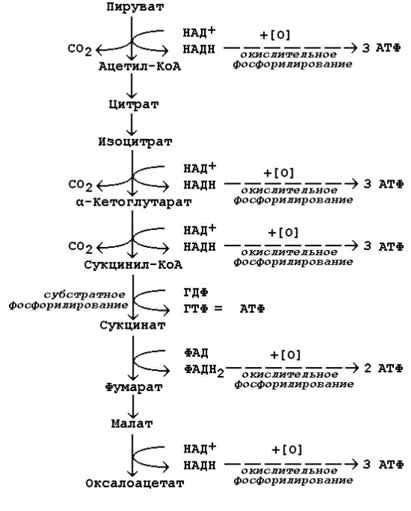 Рисунок 8.5. Расчёт энергетического баланса реакций окислительного декарбоксилирования пирувата и цикла Кребса. Гипоэнергетические состояния Наиболее частой причиной гипоэнергетических состояний является гипоксия, возникновение которой в свою очередь связано с нарушением:
Кроме того, причиной гипоэнергетических состояний могут быть гиповитаминозы, так как в реакциях общих путей катаболизма и дыхательной цепи участвуют коферменты, содержащие витамины. Так, витамин В1 входит в состав тиаминдифосфата, В2 является составной частью FMN и FAD, витамин РР в виде никотинамида входит в состав NAD+ и NADP+, пантотеновая кислота — в состав кофермента А, биотин также выполняет коферментную функцию активации СО2. 16 (1). Переваривание и всасывание углеводов. Катаболизм лактозы и сахарозы. Особенности метаболизма фруктозы и галактозы. Наследственные заболевания углеводного обмена: галактоземия, непереносимость сахарозы и лактозы. |
