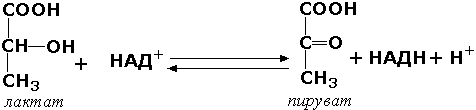
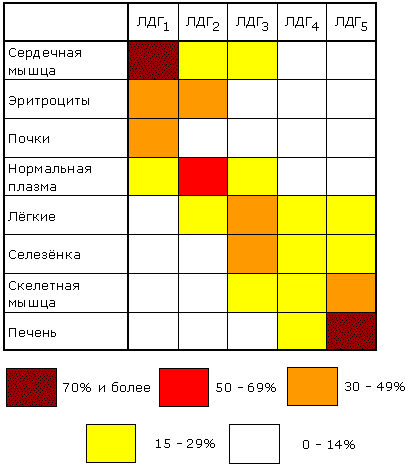
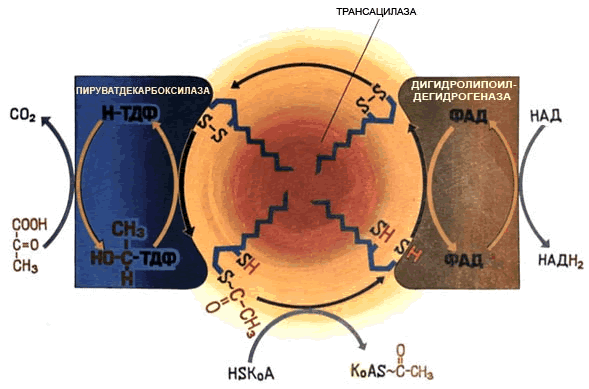
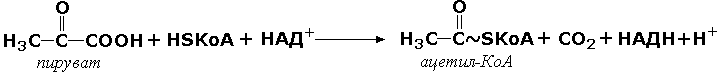1 (1). Первичная структура белка. Зависимость свойств и конформации белков от первичной структуры. Примеры полиморфизма белков, гемоглобин а и F, структурные и функциональные отличия
 Скачать 1.58 Mb. Скачать 1.58 Mb.
|
Специфичность действия ферментовНаиболее характерная черта, отличающая ферменты от других катализаторов — высокая специфичность их действия. Активный центр ферментов, как и других белков, образован боковыми группами аминокислотных остатков пептидной цепи. Строение активных центров ферментов, катализирующих разные реакции, различно. Действие ферментов. Структура активного центра фермента комплементарна структуре его субстрата, вследствие чего данный фермент из множества веществ, имеющихся в живой клетке, присоединяет только свой субстрат. Эту особенность называют субстратной специфичностью фермента. Например, структура активного центра фермента гистидазы комплементарна структуре аминокислоты гистидина, поэтому возможно образование фермент-субстратного комплекса гистидаза—гистидин; другие вещества, в том числе аминокислоты, не связываются гистидазой. Кроме того, часть функциональных групп активного центра ферментов имеет такое строение и реакционную способность, что обеспечивается химическое превращение субстрата в новые вещества — продукты ферментативной реакции. Каждый фермент катализирует не любое из всех возможных химических превращений субстрата, а какое-либо одно. Назовем это свойство специфичностью пути превращения.Жиры — это группа соединений, отдельные представители которых различаются природой жирно-кислотных остатков (радикалов R). Липаза расщепляет жиры, включающие разные жирно-кислотные остатки. Другой пример групповой специфичности — действие ферментов, гидролизующих пептиды и белки: многие из этих ферментов расщепляют пептидные связи, образованные разными аминокислотами. Пространственная структура стереоизомеров вещества различна, поэтому активный центр фермента, комплементарный одному стереоизомеру, не обязательно будет комплементарен и другим стереоизомерам. В связи с этим многие ферменты катализируют превращение лишь одного из стереоизомеров — стереоспецифич-ность. Например, малеиновая кислота, являющаяся г^оизомером фумаровой кислоты (рис. 2.3), не может быть субстратом фумаразы.
7 (1). Механизм действия ферментов. Каталитический (активный) центр. Коферменты и кофакторы. Конкурентное и неконкурентное ингибирование. Использование конкурентных ингибиторов как лекарственных препаратов Механизм действия ферментов Различают три стадии в механизме ферментативного катализа: образование фермент-субстратного комплекса; образование комплекса «фермент-продукт реакции»; отщепление продуктов реакции от фермента. Первая стадияфермент отличается от белка наличием АЦ — участка, с помощью которого фермент соединяется с субстратом и ускоряет реакцию. Долгое время считали, что между ферментом и субстратом имеется точное соответствие («ключ к замку»). Однако сейчас принято считать, что АЦ фермента приспосабливается к субстрату в ходе реакции (теория вынужденного соответствия). В АЦ имеются якорные участки, за счет которых субстрат закрепляется. Каталитический участок АЦ ответственен за тип ускоряемой реакции Вторая стадия –функционально-активные группы АЦ фермента действуют на субстрат, дестабилизируя связи в нем, вызывая изменение конфигурации субстрата, поляризацию его молекулы, растяжение связей и т.д. Это приводит к химическому преобразованию субстрата (т.е. к протеканию реакции) и образованию продуктов реакции, которые некоторое время находятся в связи с ферментом Третья стадия– от нее зависит скорость реакции. Происходит отделение фермента от продуктов реакции Активный центр фермента В процессе формирования фермент-субстратного комплекса субстрат присоединяется к специфическому участку на молекуле фермента, который называется активным центром. Активный центр – участок молекулы фермента, который связывает субстраты и от которого зависит специфичность каталитического действия ферментов; активный центр содержит функциональные группы остатков аминокислот и коферментов, пространственно сближенных и определённым образом ориентированных. Несмотря на огромное разнообразие структуры ферментов, их специфичности и механизма действия, существует ряд общих закономерностей формирования активных центров. Во-первых, на активный центр приходится относительно малая часть объёма фермента. Роль остальных аминокислотных остатков, составляющих основную массу фермента, состоит в том, чтобы обеспечить молекуле фермента правильную глобулярную форму. Во-вторых, активный центр – это сложная трёхмерная структура, и в её образовании принимают участие группы, принадлежащие разным частям линейной последовательности аминокислот. Радикалы аминокислот, образующих активный центр, оказываются вблизи друг от друга в результате формирования третичной структуры белка (рисунок 3.3). Поэтому при воздействии факторов, вызывающих денатурацию (нагревание, концентрированные кислоты и щёлочи) утрачивается конформация активного центра и фермент теряет свою активность. 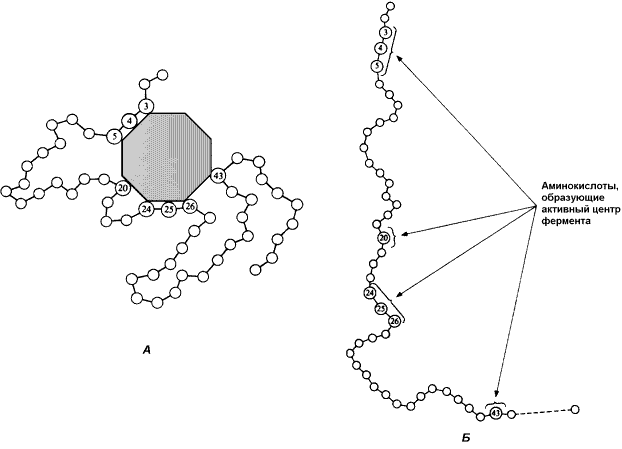 Рисунок 3.3. А. Участие аминокислотных остатков, образующих активный центр фермента, во взаимодействии с субстратом. Б. Положение этих аминокислотных остатков в первичной структуре фермента. В-третьих, активный центр имеет форму узкого углубления или щели, в которую ограничен доступ воде, за исключением тех случаев, когда вода является одним из реагирующих веществ. В этом углублении присутствует несколько полярных аминокислотных остатков, необходимых для связывания субстрата и катализа. В-четвёртых, в составе активного центра можно условно выделить две части: а) контактный или якорный участок, где происходит связывание субстрата в нужной ориентации; б) каталитический участок, обеспечивающий протекание реакции. 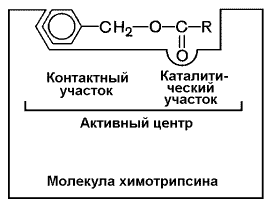 Рисунок 3.4. Состав активного центра фермента (на примере химотрипсина). В-пятых, субстраты относительно слабо связываются с ферментами. В связывании и превращении субстрата принимают участие следующие группировки аминокислотных радикалов:
У сложных ферментов в формировании активных центров принимают участие также функциональные группы коферментов. В образовании фермент-субстратных комплексов принимают участие те же молекулярные взаимодействия, что и обеспечивают формирование пространственной структуры макромолекул, межклеточные контакты и другие процессы в биологических системах:
Эти три основных типа нековалентных связей различаются по своей геометрии, энергии, специфичности. Коферменты относятся к сложным органическим веществам, их молекулы значительно меньше по размеру, чем молекулы ферментов. Коферменты могут проникать через биологические мембраны, нагревание обычно не вызывает изменения их структуры. Функцией кофермента является участие в катализируемой реакции, причём количество фермента и его химическое строение внешне остаются неизменными. В действительности кофермент является одним из субстратов ферментативной реакции, т.е. выступает как косубстрат. В ходе реакции кофермент претерпевает химические превращения, в точности противоположные тем, которые происходят в субстрате. Например, в окислительно-восстановительных реакциях молекула субстрата окисляется, а молекула кофермента восстанавливается. При последующих сопряжённых реакциях изменения в коферменте протекают в обратном направлении и он воспроизводится в первоначальной форме. Таким образом, коферменты могут быть охарактеризованы как переносчики определённых атомов, электронов или химических групп на соответствующий акцептор. Строение апофермента определяет специфичность этой реакции, а строение кофермента – её тип. |