Зачем врачу нужна биологическая химия
 Скачать 6.47 Mb. Скачать 6.47 Mb.
|
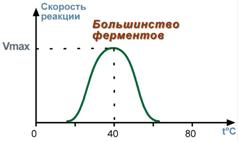
От чего зависит активность ферментов?Свойства ферментов1. Зависимость скорости реакции от температурыЗависимость активности ферментов (скорости реакции) от температуры описывается колоколообразной кривойс максимумом скорости при значениях оптимальной температуры для данного фермента. Закон о повышении скорости реакции в 2-4 раза при повышении температуры на 10°С справедлив и для ферментативных реакций, но только в пределах до 55-60°С, т.е. до температур денатурациибелков. Наряду с этим, как исключение, имеются ферменты некоторых микроорганизмов, существующих в воде горячих источников и гейзеров. При понижении температуры активность ферментов понижается, но не исчезает совсем. Иллюстрацией может служить зимняя спячка некоторых животных (суслики, ежи), температура тела которых понижается до 3-5°С. Это свойство ферментов также используется в хирургической практике при проведении операций на грудной полости, когда больного подвергают охлаждению до 22°С.
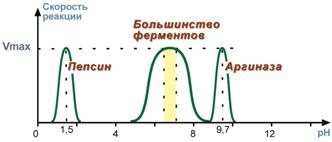
2. Зависимость скорости реакции от рНЗависимость также описывается колоколообразной кривой с максимумом скорости при оптимальном для данного фермента значении рН. Для каждого фермента существует определенный узкий интервал рН среды, который является оптимальным для проявления его высшей активности. Например, оптимальные значения рН для пепсина 1,5-2,5, трипсина 8,0-8,5, амилазы слюны 7,2, аргиназы 9,7, кислой фосфатазы 4,5-5,0, сукцинатдегидрогеназы 9,0.
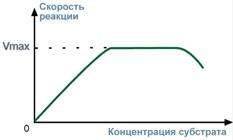
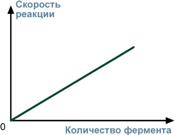
3. Зависимость скорости реакции от концентрации субстратаПри увеличении концентрации субстрата скорость реакции сначала возрастает соответственно подключению к реакции новых молекул фермента, затем наблюдается эффект насыщения, когда все молекулы фермента взаимодействуют с молекулами субстрата. При дальнейшем увеличении концентрации субстрата между его молекулами возникает конкуренция за активный центр фермента и скорость реакции снижается. 4. Зависимость от концентрации ферментаПри увеличении количества молекул фермента скорость реакции возрастает непрерывно и прямо пропорционально количеству фермента, т.к. большее количество молекул фермента производит большее число молекул продукта.
Ферменты проявляют специфичностьСпецифичность, т.е. высокая избирательность действия ферментов, основана на комплементарностиструктуры субстрата и активного центра фермента. 1. Стереоспецифичность– катализ только одного из стереоизомеров, например:
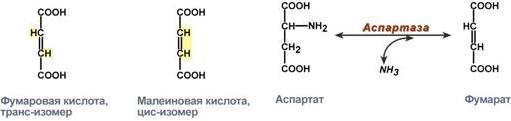 Стереоспецифичность аспартазы к транс-изомеру субстрата
2. Абсолютная специфичность – фермент производит катализ только одного вещества. Например, расщепление мочевины уреазой. 3. Групповая специфичность – катализ субстратов с общими структурными особенностями, т.е. при наличии определенной связи или химической группы:
4. Относительная групповая специфичность – превращение субстратов с некоторыми общими признаками. Например, цитохром Р450 окисляет только гидрофобные вещества, которых насчитывается около 7000. Механизмы специфичностиВ общем виде все сводится к комплементарному взаимодействию фермента и субстрата. При этом функциональные группы субстрата взаимодействуют с соответствующими им функциональными группами фермента. Наличие субстратной специфичности объясняют две гипотезы: 1. Теория Фишера (модель "жесткой матрицы", "ключ-замок") – активный центр фермента строго соответствует конфигурации субстрата и не изменяется при его присоединении. Эта модель хорошо объясняет абсолютную специфичность, но не групповую.  Схематичное представление теории Фишера2. Теория Кошланда (модель "индуцированного соответствия", "рука-перчатка") – подразумевает гибкость активного центра. Присоединение субстрата к якорному участку фермента вызывает изменение конфигурации каталитического центра таким образом, чтобы его форма соответствовала форме субстрата.  Схематичное представление теории Кошланда |