Значение биохимии в подготовке врача. Биологическая химия
 Скачать 8.33 Mb. Скачать 8.33 Mb.
|
|
Регуляция пируватдегидрогеназного комплекса. Регуляция на уровне ПДК имеет важное значение для обеспечения цитратного цикла "топливными" молекулами ацетил-КоА. Образование ацетил-КоА из пирувата - необратимый ключевой этап метаболизма. Животные не способны к превращению ацетил-КоА в глюкозу. Активность пируватдегидрогеназного комплекса регулируется различными способами: доступностью субстратов, ингибированием продуктами реакции, аллостерически и путём ковалентной модификации. Ковалентная модификация ПДК осуществляется фосфорилированием и дефосфорилированием. В состав ПДК входят 2 регуляторных субъединицы. Одна из них, киназа ПДК, фосфорилирует ПДК в определённых участках по остаткам серина. При фосфорилировании ПДК инактивируется. Другая регуляторная субъединица, фосфатаза, дефосфорилирует фермент, превращая его в активную форму (рис. 6-26). При повышении концентрации АДФ ПДК находится в нефосфорилированной активной форме. Этот эффект усиливается в некоторых клетках при повышении концентрации внутриклеточного Са2+, который активирует фосфатазу ПДК. Такой механизм активации ПДК особенно важен в мышцах и жировой ткани. Продукты пируватдегидрогеназной реакции (ацетил-КоА и NADH) аллостерически активируют киназу ПДК. Активированная киназа фос-форилирует и инактивирует ПДК. Таким образом, при накоплении NADH и ацетил-КоА тормозится превращение пирувата в ацетил-КоА. Такая ситуация создаётся, например, в печени при голодании: из жировых депо в печень поступают жирные кислоты, из которых образуется ацетил-КоА. В присутствии высокомолекулярных жирных кислот ингибирование ПДК усиливается. Пируват при этом не окисляется и может быть использован для синтеза глюкозы (см. раздел 7). Пируват аллостерически активирует нефосфорилированную форму ПДК, действуя согласованно с другими субстратами - NAD+ и КоА. Активация ПДК происходит также под влиянием инсулина. Один из эффектов инсулина - повышение концентрации внутримитохондриального Са2+. При повышении концентрации Са2+ ПДК активируется (см. рис. 6-26). Этот механизм особенно важен в жировой ткани, где ацетил-КоА необходим для синтеза жирных кислот (см. раздел 8). В клетках миокарда ПДК активируется адреналином, однако это влияние адреналина не связано с изменением концентрации цАМФ. 53. Цикл лимонной кислоты: последовательность реакций и характеристика ферментов. Роль цикла в метаболизме. Цикл лимонной кислоты (цитратный цикл, цикл Кребса, цикл трикарбоновых кислот, ЦТК) - заключительный этап катаболизма, в котором углерод ацетильного остатка ацетил-КоА окисляется до 2 молекул СО2. Атомы водорода, освобождающиеся в окислительно-восстановительных реакциях, доставляются в ЦПЭ при участии NAD- и FAD-зависимых дегидрогеназ, в результате чего происходят синтез воды и окислительное фосфорилирование АДФ. Связь между атомами углерода в ацетил-КоА устойчива к окислению. В условиях организма окисление ацетильного остатка происходит в несколько этапов, образующих циклический процесс из 8 реакций. Последовательность реакций цитратного цикла 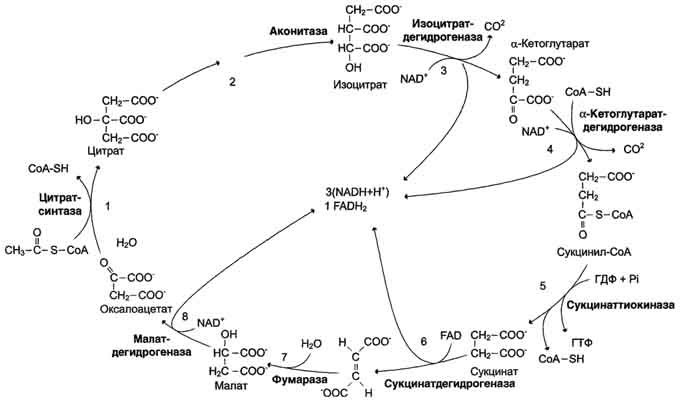 Регуляция цитратного цикла. В большинстве случаев скорость реакций в метаболических циклах определяется их начальными реакциями. В ЦТК важнейшая регуляторная реакция - образование цитрата из оксалоацетата и ацетил-КоА, катализируемая цитратсинтазой. Эта реакция ускоряется при повышении концентрации оксалоацетата - субстрата реакции и тормозится продуктом реакции - цитратом. Когда отношение NADH/NAD+ снижается, скорость окисления маната в оксалоацетат возрастает. Повышение концентрации оксалоацетата ускоряет цитратсинтазную реакцию. Скорость реакции снижается при повышении концентрации АТФ, сукцинил-КоА и длинноцепочечных жирных кислот. Однако точный механизм влияния этих метаболитов на цитратсинтазу недостаточно ясен (рис. 6-27). Изоцитратдегидрогеназа, олигомерный фермент, состоит из 8 субъединиц. Присоединение изоцитрата к первой субъединице вызывает кооперативное изменение конформации других, увеличивая скорость присоединения субстрата. Фермент аллостерически активируется АДФ и Са2+, которые присоединяются к ферменту в разных аллостерических центрах. В присутствии АДФ конформация всех субъединиц меняется таким образом, что связывание изоцитрата происходит значительно быстрее. Таким образом, при концентрации изоцитрата, которая существует в митохондриальном матриксе, небольшие изменения концентрации АДФ могут вызвать значительное изменение скорости реакции. Увеличение активности изоцитратдегидрогеназы снижает концентрацию цитрата, что, в свою очередь, уменьшает ингибирование цитратсинтазы продуктом реакции. При повышении концентрации NADH активность фермента снижается. α-Кетоглутаратдегидрогеназный комплекс, имеющий сходное строение с пируватдегидрогеназным, в отличие от последнего, не имеет в своём составе регуляторных субъединиц. Главный механизм регуляции α-кетоглутаратдегидрогеназного комплекса - ингибирование реакции NADH и сукцинил-КоА. α-Кетоглутаратдегидрогеназный комплекс, как и Изоцитратдегидрогеназа, активируется Са2+, а при повышении концентрации АТФ скорости обеих реакций снижаются. В регуляции цитратного цикла существует множество дополнительных механизмов, обеспечивающих необходимый уровень метаболитов и их участие в других метаболических путях. Компартментализация ферментов, участвующих в реакциях окислительного декарбоксилирования пирувата и цикла лимонной кислоты, играет важную роль в регуляции этих процессов. Внутренняя мембрана митохондрий непроницаема для анионов и катионов, в том числе и для промежуточных продуктов цитратного цикла, которые могут быть перенесены через мембрану только при участии специальных белков. Поэтому ферменты цитратного цикла имеют больше возможностей для взаимодействия с продуктами предыдущих реакций, чем в случае свободного удаления этих продуктов из митохондрий. Доступность субстратов возрастает также в результате образования ферментных комплексов. Малатдегидрогеназа и цитратсинтаза образуют непрочные комплексы, в которых цитратсинтаза может использовать оксалоацетат, непосредственно образующийся малатдегидрогеназой. В ПДК и α-кетоглутаратдегидрогеназном комплексе субстраты непосредственно передаются от одного фермента к другому: только транса-цилаза может взаимодействовать с промежуточным продуктом, связанным с ТДФ, а дигидролипоилдегидрогеназа- с дигидролипоевой кислотой. 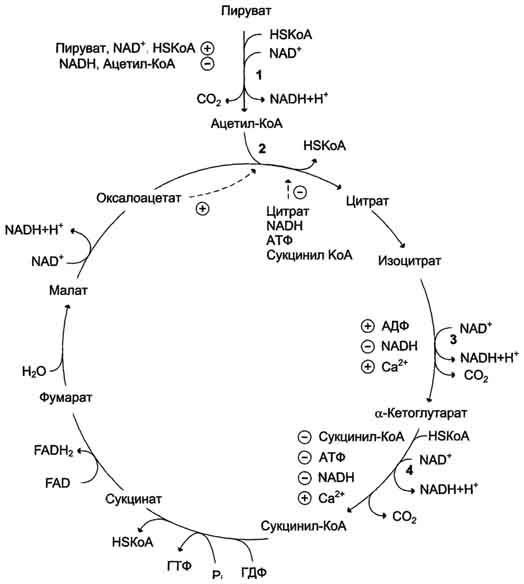 Рис. 6-27. Регуляция общего пути катаболизма. 1 - ПДК активируется пируватом, NAD+, КоА; ингибируется NADH и ацетил-КоА; 2 - цитратсинтаза (реакция ускоряется при повышении концентрации оксалоацетата и замедляется при повышении концентрации цитрата, NADH, АТФ и сукцинил-КоА); 3 - изоцитратдегидрогеназа аллостерически активируется АДФ, ионами кальция, ингибируется NADH; 4 - α-кетоглутаратдегидрогеназный комплекс ингибируется NADH, АТФ и сукцинил-КоА, а активируется ионами кальция. NAD+, NADH, КоА, ацетил-КоА и сукцинил-КоА не имеют транспортных белков в мембране митохондрий. Поэтому эти соединения не могут пройти через митохондриальную мембрану. Накопление ацил-КоА производных, таких как ацетил-КоА или сукцинил-КоА, в митохон-дриальном матриксе ингибирует другие реакции, для которых необходим КоА. Тесная связь цитратного цикла и ЦГКЭ поддерживается благодаря использованию в этих реакциях общего фонда NAD+ и NADH. 54. Цикл лимонной кислоты, схема процесса. Связь цикла с цепью переноса электронов и протонов. Регуляция цикла лимонной кислоты. Анаболические и анаплеротические функции цитратного цикла. Связь окислительного декарбоксилирования пирувата с ЦПЭ Окислительное декарбоксилирование пирувата сопровождается образованием NADH, поставляющим электроны в дыхательную цепь и обеспечивающим синтез 3 молей АТФ на 1 моль пирувата путём окислительного фосфорилирования. Так как отношения ДДФ/АТФ и NADH/NAD+ в клетке относительно постоянны, ускорение утилизации АТФ приводит к повышению концентрации АДФ и ускорению окисления NADH в дыхательной цепи. Повышение концентрации NAD+, в свою очередь, стимулирует окислительное декарбоксилирование пирувата. Напротив, повышение концентрации АТФ и NADH снижает скорость этого процесса. Таким образом, изменения отношений АДФ/АТФ и NADH/ NAD+ - важнейшие сигналы, отражающие энергетические потребности клетки и регулирующие скорость окислительного декарбоксилирования пирувата. Каталитическая активность пируват-дегидрогеназного комплекса снижается, когда в клетках имеется достаточно "топлива" в виде жирных кислот и ацетил-КоА. В. Анаболические функции цитратного цикла Цикл лимонной кислоты - один из амфиболических путей метаболизма. В нём осуществляются не только окислительные превращения энергетических субстратов до конечных продуктов 291 СО2 и Н2О, но и происходит образование субстратов для других метаболических путей (рис. 6-28). Некоторые промежуточные продукты цикла лимонной кислоты: α-кетоглутарат, сукцинат, оксалоацетат могут использоваться для синтеза заменимых аминокислот (см. раздел 9). Убыль промежуточных продуктов цикла восполняется в реакциях, катализируемых специфическими ферментами. В нормальных условиях реакции, отвлекающие промежуточные продукты из цикла и восполняющие их убыль, находятся в состоянии динамического равновесия, так что концентрация этих продуктов в митохондриях остаётся постоянной. Реакции, обеспечивающие пополнение фонда промежуточных продуктов ЦТК, называются анаплеротическими (пополняющими). Важнейшая из них - реакция синтеза оксалоацетата из пирувата. Эту реакцию катализирует митохондриальный фермент - пируваткарбоксилаза. 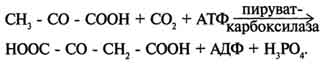 Пируваткарбоксилаза - сложный олигомерный фермент. Молекула фермента содержит 4 простетические группы, представленные биотином (см. раздел 3), который ковалентно связан амидной связью с е-аминогруппами остатков лизина, находящегося в активном центре фермента (рис. 6-29). Если для цикла лимонной кислоты не хватает оксалоацетата или какого-нибудь другого промежуточного продукта, то карбоксилирование пирувата ускоряется. В этой реакции в качестве источника энергии используется АТФ. Реакция протекает в 2 стадии. На первой стадии происходит активация СО2 путём присоединения к одному из атомов азота в молекуле биотина. Эта реакция сопряжена с гидролизом АТФ. АТФ + СО2+ Е-биотин + Н2О → АДФ + Н3РО4 + Е-биотин-СОО- + 2 Н+. На второй стадии активированная карбоксильная группа переносится на пируват. Е-биотин-СОО" + Пируват -" Е-биотин + Оксалоацетат. Пируваткарбоксилаза - регуляторный фермент. Если концентрация ацетил-КоА увеличивается, то он действует как аллостерический активатор пируваткарбоксилазы, ускоряя образование оксалоацетата. Таким образом, избыток ацетил-КоА способствует активации цитратного цикла. Метаболиты цитратного цикла используются не только как субстраты синтеза углеродного скелета ряда соединений, но и являются донорами водорода для образования восстановленных коферментов, участвующих в реакциях синтеза жирных кислот, стероидов и других веществ (см. разделы 8, 10, 11). Два метаболита нитратного цикла могут дегидрироваться при участии NADP-зависимых дегидрогеназ: малата и изоцитрата. Например, малат может поступать из митохондрий в цитозоль клетки. В цитозоле находится NADP-зависимая дегидрогеназа (малик-фермент), катализирующая реакцию: 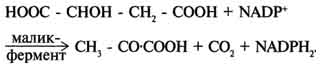 Малат и изоцитрат обеспечивают образование около половины общего фонда NADPH, используемого в восстановительных синтезах; вторая половина образуется в пентозофосфатном пути превращения глюкозы. 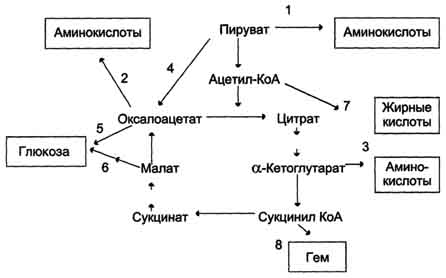 55. Основные углеводы животных, биологическая роль. Углеводы пищи, переваривание углеводов, особенности у детей. Всасывание продуктов переваривания. Основные углеводы пищи, переваривание 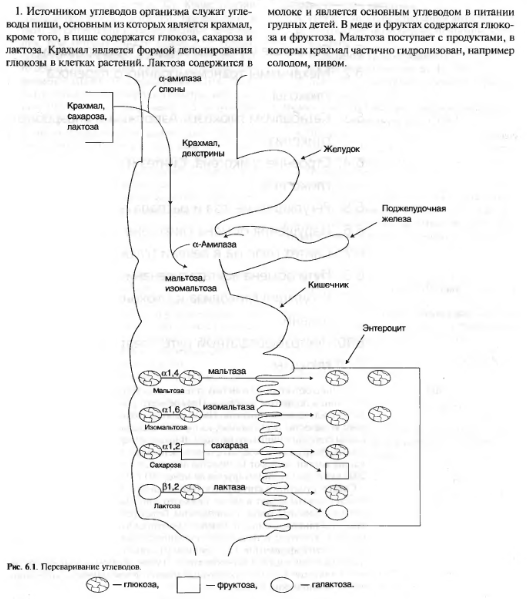    Переваривание углеводов в ротовой полости В ротовой полости пища измельчается при пережёвывании, смачиваясь при этом слюной. Слюна на 99% состоит из воды и обычно имеет рН 6,8. В слюне присутствует гидролитический фермент α-амилаза (α-1,4-гликозидаза), расщепляющая в крахмале α-1,4-гликозидные связи. В ротовой полости не может происходить полное расщепление крахмала, так как действие фермента на крахмал кратковременно. Кроме того, амилаза слюны не расщепляет α- 1,6-гликозидные связи (связи в местах разветвлений), поэтому крахмал переваривается лишь частично с образованием крупных фрагментов - декстринов и небольшого количества мальтозы. Следует отметить, что амилаза слюны не гидролизует гликозидные связи в дисахаридах. Действие амилазы слюны прекращается в резко кислой среде содержимого желудка (рН 1,5-2,5). Однако внутри пищевого комка активность амилазы может некоторое время сохраняться, пока рН не изменится в кислую сторону. Желудочный сок не содержит ферментов, расщепляющих углеводы. В желудочном содержимом возможен лишь незначительный кислотный гидролиз гликозидных связей. Б. Переваривание углеводов в кишечнике Последующие этапы переваривания нерасщеплённого или частично расщеплённого крахмала, а также других углеводов пищи происходит в тонком кишечнике в разных его отделах под действием гадролитических ферментов - гликозидаз. Панкреатическая α-амилаза В двенадцатиперстной кишке рН среды желудочного содержимого нейтрализуется, так как секрет поджелудочной железы имеет рН 7,5-8,0 и содержит бикарбонаты (НСО3-). С секретом поджелудочной железы в кишечник поступает панкреатическая α-амилаза. Этот фермент гидролизует α-1,4-гликозидные связи в крахмале и декстринах. Продукты переваривания крахмала на этом этапе - дисахарид мальтоза, содержащая 2 остатка глюкозы, связанные α-1,4-связью. Из тех остатков глюкозы, которые в молекуле крахмала находятся в местах разветвления и соединены α-1,6-гликозидной связью, образуется дисахарид изомальтоза. Кроме того, образуются олигосахариды, содержащие 3-8 остатков глюкозы, связанные α-1,4- и α-1,6-связями. α-Амилаза поджелудочной железы, так же, как α-амилаза слюны, действует как эндогликозидаза. Панкреатическая α-амилаза не расщепляет α-1,6-гликозидные связи в крахмале. Этот фермент также не гидролизует (3-1,4-гликозидные связи, которыми соединены остатки глюкозы в молекуле целлюлозы. Целлюлоза, таким образом, проходит через кишечник неизменённой. Тем не менее непереваренная целлюлоза выполняет важную функцию балластного вещества, придавая пище дополнительный объём и положительно влияя на процесс переваривания. Кроме того, в толстом кишечнике целлюлоза может подвергаться действию бактериальных ферментов и частично расщепляться с образованием спиртов, органических кислот и СО2. Продукты бактериального расщепления целлюлозы важны как стимуляторы перистальтики кишечника. Мальтоза, изомальтоза и триозосахариды, образующиеся в верхних отделах кишечника из крахмала, - промежуточные продукты. Дальнейшее их переваривание происходит под действием специфических ферментов в тонком кишечнике. Дисахариды пищи сахароза и лактоза также гидролизуются специфическими дисахаридазами в тонком кишечнике. Особенность переваривания углеводов в тонком кишечнике заключается в том, что активность специфических олиго- и дисахаридаз в просвете кишечника низкая. Но ферменты активно действуют на поверхности эпителиальных клеток кишечника. Тонкий кишечник изнутри имеет форму пальцеобразных выростов - ворсинок, покрытых эпителиальными клетками. Эпителиальные клетки, в свою очередь, покрыты микроворсинками, обращёнными в просвет кишечника. Эти клетки вместе с ворсинками образуют щёточную каёмку, благодаря которой увеличивается поверхность контакта гидролитических ферментов и их субстратов в содержимом кишечника. На 1 мм2 поверхности тонкой кишки у человека приходится 80-140 млн ворсинок. Ферменты, расщепляющие гликозидные связи в дисахаридах (дисахаридазы), образуют ферментативные комплексы, локализованные на наружной поверхности цитоплазматической мембраны энтероцитов. |
