Значение биохимии в подготовке врача. Биологическая химия
 Скачать 8.33 Mb. Скачать 8.33 Mb.
|
|
В. Разобщение дыхания и фосфорилирования Некоторые химические вещества (протонофоры) могут переносить протоны или другие ионы (ионофоры) из межмембранного пространства через мембрану в матрикс, минуя протонные каналы АТФ-синтазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это явление называют разобщением дыхания и фосфорилирования. В результате разобщения количество АТФ снижается, а АДФ увеличивается. В этом случае скорость окисления NADH и FADH2 возрастает, возрастает и количество поглощённого кислорода, но энергия выделяется в виде теплоты, и коэффициент Р/О резко снижается. Как правило, разобщители - липофильные вещества, легко проходящие через липидный слой мембраны. Одно из таких веществ - 2,4-динитрофенол, легко переходящий из ионизированной формы в неионизированную, присоединяя протон в межмембранном пространстве и перенося его в матрикс. Примерами разобщителей могут быть также некоторые лекарства, например дикумарол - антикоагулянт или метаболиты, которые образуются в организме, билирубин - продукт катаболизма тема, тироксин - гормон щитовидной железы. Все эти вещества проявляют разобщающее действие только при их высокой концентрации. Г. Терморегуляторная функция ЦПЭ На синтез молекул АТФ расходуется примерно 40-45% всей энергии электронов, переносимых по ЦПЭ, приблизительно 25% тратится на работу по переносу веществ через мембрану. Остальная часть энергии рассеивается в виде теплоты и используется теплокровными животными на поддержание температуры тела. Кроме того, дополнительное образование теплоты может происходить при разобщении дыхания и фосфорилирования. Разобщение окислительного фосфорилирования может быть биологически полезным. Оно позволяет генерировать тепло для поддержания температуры тела у новорождённых, у зимнес-пящих животных и у всех млекопитающих в процессе адаптации к холоду. У новорождённых, а также зимнеспящих животных существует особая ткань, специализирующаяся на теплопродукции посредством разобщения дыхания и фосфорилирования - бурый жир. Бурый жир содержит много митохондрий. В мембране митохондрий имеется большой избыток дыхательных ферментов по сравнению с АТФ-синтазой. Около 10% всех белков приходится на так называемый разобщающий белок (РБ-1) - термогенин. Бурый жир имеется у новорождённых, но его практически нет у взрослого человека. В последние годы появились факты, свидетельствующие о существовании в митохондриях разных органов и тканей млекопитающих разобщающих белков, похожих по своей структуре на РБ-1 бурой жировой ткани. По своей структуре термогенин близок к АТФ/АДФ-антипортеру, но не способен к транспорту нуклеотидов, хотя сохранил способность переносить анионы жирных кислот, служащих разобщителями. На внешней стороне мембраны анион жирной кислоты присоединяет протон и в таком виде пересекает мембрану; на внутренней стороне мембраны диссоциирует, отдавая протон в матрикс и тем самым снижает протонный градиент. Образующийся анион возвращается на наружную сторону мембраны с помощью АТФ/ АДФ-антипортера. При охлаждении стимулируется освобождение норадреналина из окончаний симпатических нервов. В результате происходят активация липазы в жировой ткани и мобилизация жира из жировых депо. Образующиеся свободные жирные кислоты служат не только "топливом", но и важнейшим регулятором разобщения дыхания и фосфорилирования. 50. Образование активных форм кислорода(синглетный кислород, пероксид водорода, гидроксильный радикал). Место образоваия, схемы реакций. Физиологическая роль АФК. Установлено, что в процессе обменных реакций с участием кислорода в клетках организма неизбежно образуются гораздо более активные, более сильные и агрессивные окислители, чем сам кислород, - так называемые активные формы кислорода. В это понятие включаются все активированные метаболиты кислорода радикальной и нерадикальной природы. Физиологическая роль активных форм кислорода Активные формы кислорода принимают участие в клеточной системе иммунитета, обеспечивая функцию всех фагоцитов в борьбе с инфекцией Регуляция синтеза простагландинов, тромбоксанов и лейкотриенов. Окислительное разрушение ксенобиотиков (чужеродных для организма экзогенных веществ), деструкция собственных поврежденных или аномальных клеток. Регуляция роста, пролиферации и дифференцировки клеток. Участие в обновлении и модификации клеточных мембран. Регуляция апоптоза. АКТИВНЫЕ ФОРМЫ КИСЛОРОДА (АФК) О2° - супероксидный анион радикал НО2° – гидропероксидный радикал НО° – гидроксил-радикал Н2О2 – пероксид водорода НОСl – гипохлорная кислота Н2О2 и НОСl генерируют свободные радикалы в присутствии Fe2+ и О2°: Н2О2 + Fe2+ → НО° + ОН° + Fe3+ (реакция Фентон) Н2О2 + О2° → НО° + ОН° + О2 (реакция Хабера-Вайса) НОСl + О2° → НО° + СIО2 В свою очередь, О2° способен превращаться в НО2° и Н2О2 согласно реакциям: О2° + Н+ → НО2° НО2° + НО2° → Н2О2 + О2 Кроме того, к АФК относят окись азота (NO°), образующую с О2° пероксинитрит: NO° + О2° → ONOO° => ONOOH > НО° + NO2° Образование активных форм кислорода может происходить: в процессе переноса электронов в митохондриальной дыхательной цепи; в реакциях, которые катализируются оксидазами (образуется перекись водорода), в том числе в свободнорадикальных процессах, совершающихся в фагоцитах; в реакциях микросомального окисления при обезвреживании веществ с участием цитохрома Р-450; в реакциях самопроизвольного (неферментативного) окисления веществ (гемоглобина, ферредоксинов, адреналина и др.); в биологических системах с наличием ионов металлов с переменной валентностью и, прежде всего, железа (свободных атомов, так называемых внегемовых)ю Значительное число АФК при воспалениях образуется в остром периоде нейтрофильными гранулоцитами крови и макрофагами во время "кислородно-метаболического взрыва лейкоцитов". Поступление в кровь АФК и продуктов ПОЛ способствует выработке и высвобождению провоспалительных цитокинов, медиаторов воспаления, а также медленно реагирующей субстанции анафилаксии и обуславливает резкую активацию системы комплемента по альтернативному пути с высвобождение анафилаксина. В этот период происходит резкая активация калликреин-кининовой системы, а также нарушается нормальное функционирование систем фибринолиза и гемостаза. Интенсивный выброс цитокинов и медиаторов воспаления макрофагами и иммунокомпетентными клетками, активация эндотелиоцитов и рост их тромбогенного потенциала, а также замедление периферического кровотока на фоне избыточной адренэргической стимуляции вызывают во многих органах выраженное в той или иной степени воспаление, не имеющее биологической цели, т.е. защитно-приспособительного значения, что обуславливает вторичное повреждение тканей и разрушение структурно-функциональных единиц органов. 51. Механизм повреждающего действия активных форм кислорода на клетки (ПОЛ, окисление белков и нуклеиновых кислот). Примеры реакций. Наиболее серьезными следствием токсического действия активных форма кислорода являются: 1. Выраженная активация свободнорадикального перекисного окисления липидов; 2. Повреждение ДНК и РНК 3. Повреждение белков, в том числе и белков- ферментов. По существу эти три события и составляют молекулярную основу окислительного стресса. Избыточная активация перекисного окисления липидов, происходящая главным образом, в клеточных и субклеточных мембранах, приводит к глубокому нарушению их структуры и функции. Для защиты организма от повреждающего действия активных форм кислорода, особенно, от кислородных радикалов, существует т.н. антиоксидантная система. Именно антиоксидантная система поддерживает такой баланс продукции и дезактивации свободных радикалов и других активированных метаболитов кислорода, при котором их концентрация находится на достаточно низком, но всегда отличном от нуля и постоянном уровне, оптимальном для организма. Можно условно разделить всю антиоксидантную систему на две части – анатомо-физиологическую и биохимическую
Целый ряд причин вызывает активацию ПОЛ в тканях: снижение поступления в организм алиментарных антиоксидантов (АО), таких как: токоферол, аскорбат, биофлавоноиды и др.; стресс различного генеза, в частности эмоциональный (под влиянием катехоламинов и кортикостероидов в кровь поступает избыток жирных кислот и кислород); внешние химические прооксиданты (пестициды, лекарственные окислители, алкоголь, продукты смога и т.д.); физические факторы (повышенный радиоактивный фон, ультрафиолетовое облучение, электромагнитное поле, ультразвук с интенсивностью выше 2 Вт/см ); избыточное и несбалансированное потребление жиров и углеводов на фоне недостаточного их расходования; гипокинезия с низким уровнем биологического окисления ферментов, т.е. сниженный уровень восстановления пиридиннуклеотидов; врожденные энзимопатии антиоксидантных ферментов (каталазы, глутатионредуктазы, глутатионпероксидазы, глюкозо-6-фосфат-дегидрогеназы); падение с возрастом активности антиоксидантных ферментов. 52. Катаболизм основных пищевых веществ в клетке – углеводов, жиров, АК. Понятие о специфических и общих путях катаболизма. Окислительное декарбоксилирование пировиноградной кислоты, характеристика процесса. Пируват дегидрогеназный комплекс. Регуляция. Катаболизм основных пищевых веществ Расщепление в пищеварительном тракте. Это гидролитические реакции, превращающие сложные пищевые вещества в относительно небольшое число простых метаболитов: глюкоза, аминокислоты, глицерин, жирные кислоты. Специфические пути катаболизма. Простые метаболиты подвергаются специфическим реакциям расщепления, в результате которых образуется либо пировиноградная кислота, либо ацетил - СоА. Причем ацетил - СоА может образоваться из пирувата в результате окислительного декарбоксилирования. Могут также образоваться другие соединения, непосредственно включающиеся в цитратный цикл. Цитратный цикл и дыхательная цепь завершают расщепление пищевых веществ до конечных продуктов - СО2 и Н2О. Следовательно, начиная со стадии образования пирувата происходит унификация путей катаболизма. Из большого числа исходных соединений образуется всего два - пируват и ацетил - СоА. Процесс, начинающийся от пирувата, называется общим путем катаболизма и в свою очередь включает: окислительное декарбоксилирование пирувата цитратный цикл. Именно в общем пути катаболизма образуется основная масса субстратов для реакций дегидрирования. Совместно с дыхательной цепью и окислительным фосфорилированием общий путь катаболизма является основным источником энергии в форме АТР. 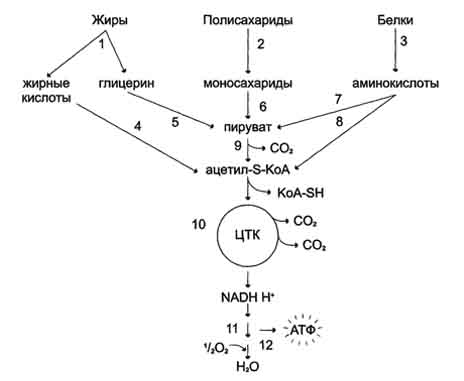 Окислительное декарбоксилирование пирувата происходит в матриксе митохондрий. Транспорт пирувата в митохондриальный матрикс через внутреннюю мембрану митохондрий осуществляется при участии специального белка-переносчика по механизму симпорта с Н+. Превращение пирувата в ацетил-КоА описывают следующим суммарным уравнением: СН3-СО-СООН + NAD+ + HSKoA → CH3-CO ∼SKoA + NADH + H+ + CO2 В ходе этой реакции происходит окислительное декарбоксилирование пирувата, в результате которого карбоксильная группа удаляется в виде СО2, а ацетильная группа включается в состав ацетил- КоА. Один атом водорода оказывается в составе NADH, а другой в виде Н+ поступает в среду. Реакция необратима, поскольку ΔG0' = -33,5 кДж/моль. 1. Строение пируватдегидрогеназного комплекса Процесс окислительного декарбоксилирования пирувата катализирует сложнооргани-зованный пируватдегидрогеназный комплекс. В пируватдегидрогеназный комплекс (ПДК) входят 3 фермента: пируватдекарбоксилаза (Е1), дигидролипоилтрансацетилаза (Е2) и дигидролипоилдегидрогеназа (Е3), а также 5 коферментов: тиаминдифосфат (ТДФ), липоевая кислота,. FAD, NAD+ и КоА. Кроме того, в состав комплекса входят регуляторные субъединицы: протеинкиназа и фосфопротеинфосфатаза. Все эти ферменты и коферменты объединены в мультиферментную систему, содержащую разные количества каждого из ферментов и имеющую молекулярную массу более 6×106. В центре комплекса располагается дигидролипоилтрансацетилаза (Е2), образуя его ядро. К дигидролипоилтрансацетилазе присоединены молекулы: пируватдекарбоксилазы (Е1) и дигидролипоилдегидрогеназы (Е3). Пируватдекарбоксилаза содержит прочно связанный с белковой частью ТДФ, а дигидроли-поилдегидрогеназа - FAD. Липоиллизиновые группы центрального фермента (Е2) функционируют как поворотные "кронштейны", переносящие атомы водорода и ацетильные группы от одной ферментной молекулы комплекса к другой. 2. Окислительное декарбоксилирование пирувата Превращение пирувата в ацетил-КоА включает 5 стадий (рис. 6-21). Стадия I.На этой стадии пируват соединяется с ТДФ в составе Е1 и подвергается декарбоксилированию. Пируват + Е1-ТДФ → Гидроксиэтил-ТДФ + CO2. 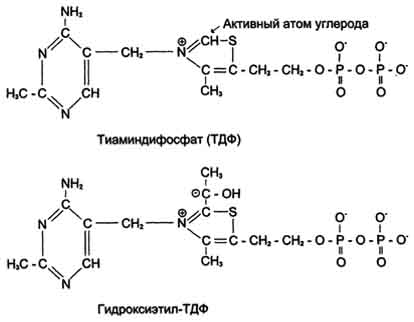 В результате этой реакции образуется производное ТДФ с гидроксиэтильной группой при тиазоловом кольце. Стадия П.Дигидролипоилтрансацетилаза (Е2) катализирует перенос атома водорода и ацетильной группы от ТДФ на окисленную форму липоиллизиновых групп с образованием ацетилтиоэфира липоевой кислоты (рис. 6-21). Стадия III.На стадии III КоА взаимодействует с ацетильным производным Е2, в результате чего образуются ацетил-КоА и полностью восстановленный липоильный остаток, простетическая группа Е2 (рис. 6-23). Стадия IV.На стадии IV дигидролипоилде-гидрогеназа (Е3) катализирует перенос атомов водорода от восстановленных липоильных групп на FAD - простетическую группу фермента Е3. Стадия V. На стадии V восстановленный FADH2 передаёт водород на NAD+ с образованием NADH. Пируватдегидрогеназный комплекс характеризуется большим отрицательным окислительно-восстановительным потенциалом, который обеспечивает наряду с восстановлением кофермента (NADH) образование высокоэнергетической тиоэфирной связи в ацетил-КоА. Структурное объединение 3 видов ферментов создаёт возможности для координации отдельных этапов сложной ферментативной реакции. Все промежуточные продукты реакции окислительного декарбоксилирования пирувата прочно связаны с комплексом, что увеличивает суммарную скорость процесса и сводит к минимуму побочные реакции. Пируватдегидрогеназный комплекс, как и все белки, участвующие в реакциях ЦТК, кодируется ядерной ДНК. Транспорт субъединиц ПДК в митохондрии происходит сложным путём за счёт энергии АТФ или трансмембранного электрохимического потенциала при участии белков теплового шока, или шаперонов (см. раздел 1), предотвращающих их преждевременный фолдинг до поступления в митохон-дриальный матрикс или внутреннюю мембрану митохондрий. 3. Связь окислительного декарбоксилирования пирувата с ЦПЭ Окислительное декарбоксилирование пирувата сопровождается образованием NADH, поставляющим электроны в дыхательную цепь и обеспечивающим синтез 3 молей АТФ на 1 моль пирувата путём окислительного фосфорилирования. Так как отношения ДДФ/АТФ и NADH/NAD+ в клетке относительно постоянны, ускорение утилизации АТФ приводит к повышению концентрации АДФ и ускорению окисления NADH в дыхательной цепи. Повышение концентрации NAD+, в свою очередь, стимулирует окислительное декарбоксилирование пирувата. Напротив, повышение концентрации АТФ и NADH снижает скорость этого процесса. Таким образом, изменения отношений АДФ/АТФ и NADH/ NAD+ - важнейшие сигналы, отражающие энергетические потребности клетки и регулирующие скорость окислительного декарбоксилирования пирувата. Каталитическая активность пируват-дегидрогеназного комплекса снижается, когда в клетках имеется достаточно "топлива" в виде жирных кислот и ацетил-КоА. Регуляция общего пути катаболизма Скорость синтеза АТФ строго соответствует энергетическим потребностям клетки. Это достигается согласованной регуляцией всех этапов заключительного пути катаболизма, включающего превращение пирувата в ацетил-КоА, цитратный цикл и ЦПЭ. В большинстве тканей, где главная функция общего пути катаболизма - обеспечение клетки энергией, важную роль в регуляции играет дыхательный контроль. Увеличение скорости утилизации АТФ для совершения различных видов работы увеличивает концентрацию АДФ, что ускоряет окисление NADH в ЦПЭ и, следовательно, повышает скорость реакций, катализируемых NAD-зависимыми дегидрогеназами. Окисление пирувата и ацетил-КоА может происходить только в том случае, если электроны и протоны от NADH и FADH2 поступают в ЦПЭ. Таким образом, отношения АДФ/АТФ и NADH/NAD+ - главные модуляторы скорости реакций общего пути катаболизма (ОПК). Как известно, скорость метаболических путей, которые должны обеспечивать постоянный уровень конечных продуктов, таких, как АТФ, регулируется на уровне реакций, катализируемых регуляторными ферментами. На заключительном этапе катаболизма наиболее важные регуляторные ферменты - пируватдегадрогеназный комплекс, цитратсинтаза, изоцигратдегидрогеназа и α-кетоглутаратдегидрогеназный комплекс. |
