|
|
Значение биохимии в подготовке врача. Биологическая химия
Механизм реакции трансаминирования непрост и протекает по типу "пинг-понг". Катализируют реакцию ферменты аминотрансферазы, Они являются сложными ферментами, в качестве кофермента имеют пиридоксальфосфат (активная форма витамина В6). В тканях насчитывают около 10 аминотрансфераз, обладающие групповой специфичностью и вовлекающие в реакции все аминокислоты, кроме пролина, лизина, треонина, которые не подвергаются трансаминированию.
Весь перенос аминогруппы совершается в две стадии:
1.к пиридоксальфосфату сначала присоединяется первая аминокислота, отдает аминогруппу, превращается в кетокислоту и отделяется. Аминогруппа при этом переходит на кофермент и образуется пиридоксаминфосфат.
2. на второй стадии к пиридоксаминфосфату присоединяется другая кетокислота, получает аминогруппу, образуется новая аминокислота и пиридоксальфосфат регенерирует.
Роль и превращение пиридоксальфосфата сводится к образованию промежуточных соединений – шиффовых оснований (альдимин и кетимин). В первой реакции после отщепления воды образуется иминовая связь между остатком аминокислоты и пиридоксальфосфатом. Полученное соединение называется альдимин. Перемещение двойной связи приводит к образованию кетимина, который гидролизуется водой по месту двойной связи. От фермента отщепляется готовый продукт – кетокислота. 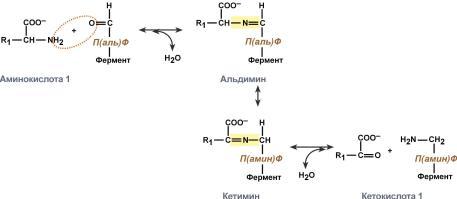
После отщепления кетокислоты к комплексу пиридоксамин-фермент присоединяется новая кетокислота и процесс идет в обратном порядке: образуется кетимин, затем альдимин, после чего отделяется новая аминокислота. Чаще всего аминокислоты взаимодействуют со следующими кетокислотами: пировиноградной с образованием аланина, щавелевоуксусной с образованием аспартата, α-кетоглутаровой с образованием глутамата. Однако аланин и аспартат в дальнейшем все равно передают свою аминогруппу на α-кетоглутаровую кислоту. Таким образом, в тканях осуществляется поток избыточных аминогрупп на один общий акцептор – α-кетоглутаровую кислоту. В итоге образуется большое количество глутаминовой кислоты. Далее глутаминовая кислота может вовлекается в процессы связывания аммиака (синтез глутамина) либо в прямое окислительное дезаминирование.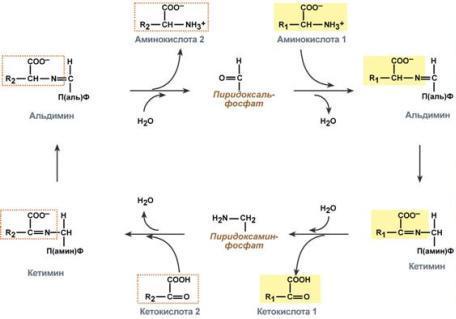
В медицине нашло практическое применение определение активности двух ферментов трансаминирования – аланинаминотрансферазы (АЛТ, АлАТ) и аспартатаминтрансферазы (АСТ).
Оба фермента обратимо взаимодействуют с α-кетоглутаровой кислотой и переносят на нее аминогруппы от соответствующих аминокислот с образованием глутаминовой кислоты и кетокислот. Хотя активность обоих ферментов значительно возрастает при заболеваниях сердечной мышцы и печени, при поражении клеток миокарда наибольшая активность в сыворотке крови обнаруживается для АСТ, при гепатитах – для АЛТ.
73. Дезаминирование аминокислот: прямое, непрямое. Виды прямого дезаминирования. Окислительное дезаминирование. Оксидазы L-аминокислот. Глутаматдегидрогеназа. Схема реакции, кофактор, регуляция процесса.
Дезаминирование аминокислот - реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака.
Прямое дезаминирование – отщепление аминогруппы в виде аммиака. Аммиак выделяется в кровь и очень токсичен (этому виду дезаминирования подвергаются все аминокислоты, кроме лизина). Это не главный путь дезаминирования.
Виды прямого дезаминирования:
окислительное
восстановительное
гидролитическое
внутримолекулярное
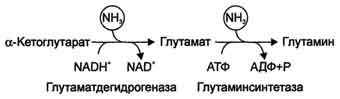
Окислительное дезаминирование. Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты. Реакцию катализирует фермент глутаматдегидрогеназа,коферментом глутаматдегидрогеназы является NAD+. Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование а-иминоглутарата, затем - неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется а-кетоглутарат.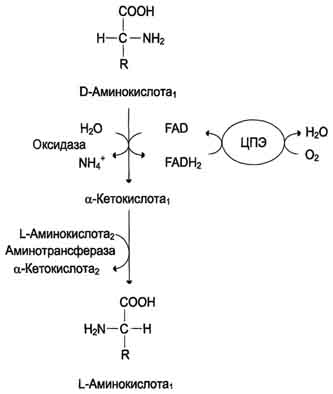 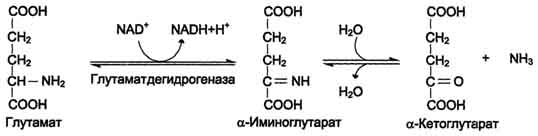
Окислительное дезаминирование глутамата - обратимая реакция и при повышении концентрации аммиака в клетке может протекать в обратном направлении, как восстановительное шинирование α-кетоглутарата.
Глутаматдегидрогеназа очень активна в митохондриях клеток практически всех органов, кроме мышц. Этот фермент - олигомер, состоящий из 6 субъединиц (молекулярная масса 312 кД). Глутаматдегидрогеназа играет важную роль, так как является регуляторным ферментом аминокислотного обмена. Аллостерические ингибиторы глутаматдегидрогеназы (АТФ, ГТФ, NADH) вызывают диссоциацию фермента и потерю глутаматдегидрогеназной активности. Высокие концентрации АДф активируют фермент. Таким образом, низкий энергетический уровень в клетках стимулирует разрушение аминокислот и образованиеα-кетоглутарата, поступающего в ЦТК как энергетический субстрат. Глутаматдегидрогеназа может индуцироваться стероидными гормонами (кортизолом).
Оксидаза L-аминокислот. В печени и почках обнаружен фермент оксидаза L-аминокислот,способный дезаминировать некоторые L-аминокислоты.
Коферментом в данной реакции выступает FMN. Однако вклад оксидазы L-аминокислот в дезаминирование, очевидно, незначителен, так как оптимум её действия лежит в щелочной среде (рН 10,0). В клетках, где рН среды близок к нейтральному, активность фермента очень низка.
Оксидаза D-аминокислоттакже обнаружена в почках и печени. Это FAD-зависимый фермент. Оптимум рН этой оксидазы лежит в нейтральной среде, поэтому фермент более активен, чем оксидаза L-аминокислот. Роль оксидазы D-аминокислот невелика, так как количество D-изомеров в организме крайне мало, потому что в белки пищи и белки тканей человека и животных входят только природные L-аминокислоты. Вероятно, оксидаза D-аминокислот способствует их превращению в соответствующие L-изомеры.
Большинство аминокислот подвергается в клетке непрямому дезаминированию, которое включает 2 стадии: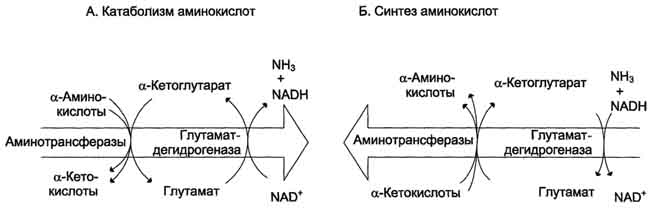
Трансаминирование с α-кетоглутаратом, образование Глу в цитозоле клетки
Окислительное дезаминирование Глу в митохондриях
Центральную роль в непрямом дезаминировании играют глутамат и α-кетоглутарат
Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: аминотрансферазы (кофермент ПФ) и глутаматдегидрогеназы (кофермент NAD+).
74. Непрямое дезаминирование аминокислот. Схема процесса, субстраты, ферменты, кофакторы.


Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: аминотрансферазы (кофермент ПФ) и глутаматдегидрогеназы (кофермент NAD+).
Биологическая роль непрямого дезаминирования. А - при катаболизме почти все природные аминокислоты сначала передают аминогруппу на а-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогена-зы, в результате чего получаются а-кетоглутарат и аммиак; Б - при необходимости синтеза аминокислот и наличии необходимых а-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования а-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей а-кетокислотой, что приводит к синтезу новой аминокислоты.
75. Основные источники аммиака в организме человека. Токсичность аммиака. Роль глутамина и аспарагина в обезвреживании аммиака. Глутаминаза почек, образование и выведение солей аммония.
ужат мышцы, мозг и печень. С током крови глутамин транспортируется в кишечник и почки.
В клетках кишечникапод действием фермента глутаминазы происходит гидролитическое освобождение амидного азота в виде аммиака:
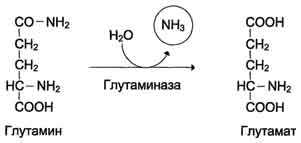
Образовавшийся в реакции глутамат подвергается трансаминированию с пируватом. ос-Аминогруппа глутаминовой кислоты переносится в состав аланина (рис. 9-10). Большие количества аланина поступают из кишечника в кровь воротной вены и поглощаются печенью. Около 5% образовавшегося аммиака удаляется в составе фекалий, небольшая часть через воротную вену попадает в печень, остальные
90% выводятся почками.
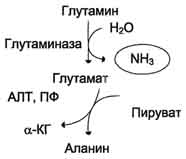
Рис. 9-10. Метаболизм азота глутамина в кишечнике.
В почкахтакже происходит гидролиз глутамина под действием глутаминазы с образованием аммиака. Этот процесс является одним из механизмов регуляции кислотно щелочного равновесия в организме и сохранения важнейших катионов для поддержания осмотического давления. Глутаминаза почек значительно индуцируется при ацидозе, образующийся аммиак нейтрализует кислые продукты обмена и в виде аммонийных солей экскретируется с мочой (рис. 9-11). Эта реакция защищает организм от излишней потери ионов Na+ и К+, которые также могут использоваться для выведения анионов и утрачиваться. При алкалозе количество глутаминазы в почках снижается.
В почках образуется и выводится около 0,5 г солей аммония в сутки.
Высокий уровень глутамина в крови и лёгкость его поступления в клетки обусловливают использование глутамина во многих анаболических процессах. Глутамин - основной донор азота в организме.Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых
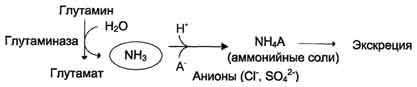
Рис. 9-11. Метаболизм амидного азота глутамина в почках.
479
нуклеотидов, аспарагина, аминосахаров и других соединений (рис. 9-12).
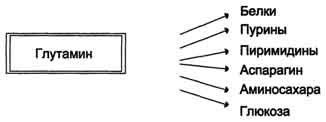
Рис. 9-12. Пути использования глутамина в организме.
Ещё одной реакцией обезвреживания аммиака в тканях можно считать синтез аспарагинапод действием аспарагинсинтетазы.
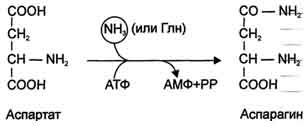
Существуют 2 изоформы этого фермента - глутаминзависимая и аммиакзависимая, которые используют разные доноры амидных групп. Первая функционирует в животных клетках, вторая преобладает в бактериальных клетках, но присутствует и у животных. Однако такой путь обезвреживания аммиака в клетках человека используется редко и к тому же требует больших энергетических затрат (энергию двух макроэргических связей), чем синтез глутамина.
Наиболее значительные количества аммиака обезвреживаются в печени путём синтеза мочевины.В первой реакции процесса аммиак связывается с диоксидом углерода с образованием карбамоилфосфата, при этом затрачиваются 2 молекулы АТФ. Реакция происходит в митохондриях гепатоцитов под действием фермента карбамоилфос-фатсинтетазы I. Карбамоилфосфатсинтетаза II локализована в цитозоле клеток всех тканей и участвует в синтезе гшримидиновых нуклеотидов (см. раздел 10). Карбамоилфосфат затем включается в орнитиновый цикл и используется для синтеза мочевины.
В мозге и некоторых других органах может протекать восстановительное аминирование α-кетоглутаратапод действием глутаматдегидрогеназы, катализирующей обратимую реакцию. Однако этот путь обезвреживания аммиака в тканях используется слабо, так как глутаматдегидрогеназа катализирует преимущественно реакцию дезаминирования глутамата. Хотя, если учитывать последующее образование глутамина, реакция выгодна для клеток, так как способствует связыванию сразу 2 молекул NH3.
Из мышц и кишечника избыток аммиака выводится преимущественно в виде аланина. Этот механизм необходим, так как активность глутаматдегидрогеназы в мышцах невелика и непрямое дезаминирование аминокислот малоэффективно. Поэтому в мышцах существует ещё один путь выведения азота. Образование аланина в этих органах можно представить следующей схемой (см. схему ниже).
Аминогруппы разных аминокислот посредством реакций трансаминирования переносятся на пируват, основным источником которого служит процесс окисления глюкозы.
Мышцы выделяют особенно много аланина в силу их большой массы, активного потребления
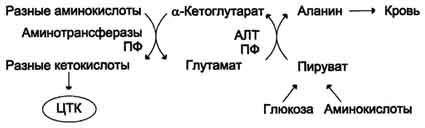
Схема
480
глюкозы при физической работе, а также потому, что часть энергии они получают за счёт распада аминокислот. Образовавшийся аланин поступает в печень, где подвергается непрямому дезаминированию. Выделившийся аммиак обезвреживается, а пируват включается в глюконеогенез. Глюкоза из печени поступает в ткани и там, в процессе гликолиза, опять окисляется до пирувата (рис. 9-13).
Образование аланина в мышцах, его перенос в печень и перенос глюкозы, синтезированной в печени, обратно в мышцы составляют глюкозо-аланиновый цикл,работа которого сопряжена с работой глюкозо-лактатного цикла (см. раздел 7).
Совокупность основных процессов обмена аммиака в организме представлена на рис. 9-14. Доминирующими ферментами в обмене аммиака служат глутаматдегидрогеиаза и глутаминсинтетаза.
76. Оринитиновый цикл мочевинообразования. Химизм, место протекания процесса. Энергетический эффект процесса, его регуляция. Возрастные особенности использования аммиака в детском возрасте. Количественное определение мочевины сыворотки крови, клиническое значение.
Окислительное дезаминирование глутамата происходит в митохондриях. Ферменты орнитинового цикла распределены между митохондриями и цитозолем. Поэтому необходим трансмембранный перенос глутамата, цитруллина и орнитина с помощью специфических транслоказ. На схеме показаны пути включения азота двух разных аминокислот (аминокислота 1 и аминокислота 2) в молекулу мочевины: • одна аминогруппа - в виде аммиака в матриксе митохондрии; • вторую аминогруппу поставляет аспартат цитозоля.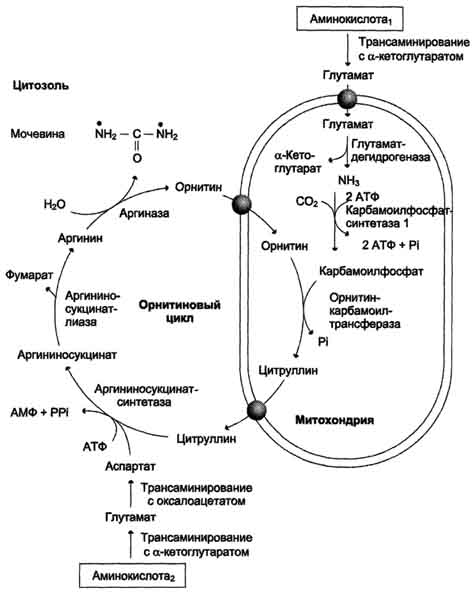
Энергетический баланс процесса
В реакциях орнитинового цикла расходуются четыре макроэргических связи трёх молекул АТФ на каждый оборот цикла. Однако процесс превращения аминокислот в безазотистые остатки и мочевину имеет пути компенсации энергозатрат:
при включении фумарата в ЦТК на стадии дегидрирования малата образуется NADH, который обеспечивает синтез 3 молекул АТФ;
при окислительном дезаминировании глу-тамата в разных органах также образуется NADH, соответственно - ещё 3 молекулы АТФ.
Количественное определение мочевины в сыворотке крови.
Принцип метода. Диацетилмонооксим в кислой среде и в присутствии тиосемикарбазида и ионов трехвалентного железа образует с мочевиной красный комплекс.
Техника выполнения.
Смешать реактивы, на 10 минут поместить в кипящую водяную баню все три пробирки, предварительно закрыв их отверстие фольгой. Затем быстро охлаждают все пробирки водой и колориметрируют при длине волны 490-540 нм опытную и калибровочную пробы против контроля в кюветах толщиной 0,5 см. Формула для расчета:
Аоп./Аэ×16,6 (ммоль/л).
Норма содержания мочевины в крови: 2,5-8,3 ммоль/л. Уровень мочевины в крови характеризует выделительную функцию почек.
Аммиак выделяется в моче в виде солей серной и фосфорной кислот. За счет аммиака у детей выделяется относительно больше азота, чем у взрослых.
Избыток аммиака в детской моче зависит от неполного превращения его в мочевину. Аммиак входит в состав солей серной и фосфорной кислот, образующихся при расщеплении белка и фосфорсодержащих органических соединений. У взрослого это осуществляется отчасти за счет щелочных земель (Na, К, Са, Mg), поступающих в достаточном количестве с пищей. Детский организм эти соли использует для пластических целей; кроме того, всасывание их в кишечнике несколько затруднено образованием мыл вследствие относительно большого содержания жира в пище ребенка.
Повышенное содержание аммиака в моче не говорит об ацидозе и ацидурии, а скорее об алкалопении, указывая на некоторый недостаток щелочей. У старших детей количество аммиака в моче зависит от характера пищи, главным образом от характера ее зольного остатка; при большом количестве овощей поступает много щелочей и, следовательно, меньше выделяется аммиака с мочой; при мясной пище, наоборот, больше образуется кислых продуктов межуточного обмена, нейтрализуемых аммиаком и выделяющихся с мочой в виде соответствующих соединений.
77. Декрбоксилирование АК. Биогенные амины: гистамин, серотонин, ГАМК. Реакции их образования, ферменты и коферменты. Биороль биогенных аминов. Дезаминирование и метилирование аминов как пути из обезвреживания.
|
|
|
 Скачать 8.33 Mb.
Скачать 8.33 Mb.