Значение биохимии в подготовке врача. Биологическая химия
 Скачать 8.33 Mb. Скачать 8.33 Mb.
|
|
Декарбоксилирование аминокислот и их производных Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию - отщеплению ос-карбоксильной группы. В тканях млекопитающих декарбоксилированию может подвергаться целый ряд аминокислот или их производных: Три, Тир, Вал, Гис, Глу, Цис, Apr, Орнитин, SAM, ДОФА, 5-окситриптофан и др. Продуктами реакции являются СО2 и амины, которые оказывают выраженное биологическое действие на организм (биогенные амины): 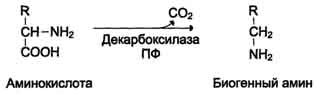 Реакции декарбоксилирования необратимы и катализируются ферментами декарбоксилазами. Простетическая группа декарбоксилаз в клетках животных - пиридоксальфосфат. Некоторые декарбоксилазы микроорганизмов могут содержать вместо ПФ остаток пирувата - гистидиндекарбоксилаза Micrococcusи Lactobacilus,SAM-декарбоксилаза Е. coliи др. Механизм реакции напоминает 512 реакцию трансаминирования с участием пиридоксальфосфата и также осуществляется путём формирования шиффова основания ПФ и аминокислоты на первой стадии. Амины, образовавшиеся при декарбоксилировании аминокислот, часто являются биологически активными веществами. Они выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК и др.), гормонов (норадреналин, адреналин), регуляторных факторов местного действия (гистамин, карнозин, спермин и др.). 1. Синтез и биологическая роль серотонина Серотонин - нейромедиатор проводящих путей. Образуется в надпочечниках и ЦНС из аминокислоты 5-гидрокситриптофана в результате действия декарбоксилазы ароматических аминокислот. Этот фермент обладает широкой специфичностью и способен также декарбоксилировать триптофан и ДОФА, образующийся из тирозина. 5-Гидрокситриптофан синтезируется из триптофана под действием фенилаланингидроксилазы с коферментом Н4БП (этот фермент обладает специфичностью к ароматическим аминокислотам и гидроксидирует также фенилаланин) (см. схему ниже). Серотонин может превращаться в гормон мелатонин, регулирующий суточные и сезонные изменения метаболизма организма и участвующий в регуляции репродуктивной функции. Серотонин- биологически активное вещество широкого спектра действия. Он стимулирует сокращение гладкой мускулатуры, оказывает сосудосуживающий эффект, регулирует АД, температуру тела, дыхание, обладает антидепрессантным действием. По некоторым данным он может принимать участие в аллергических реакциях, поскольку в небольших количествах синтезируется в тучных клетках. Синтез и биологическая роль γ-аминомасляной кислоты В нервных клетках декарбоксилирование глутамата (отщепление α-карбоксильной группы) приводит к образованию γ-аминомасляной кислоты (ГАМК), которая служит основным тормозным медиатором высших отделов мозга (см. схему на с. 514). 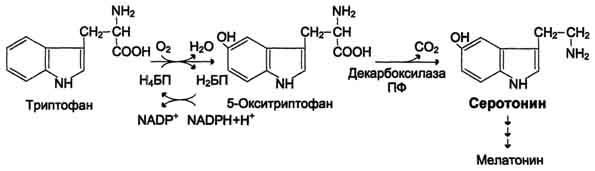 Схема 513 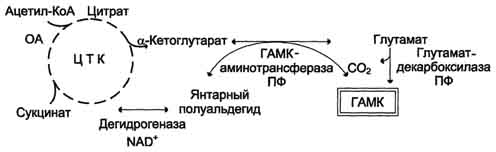 Схема Цикл превращений ГАМК в мозге включает три сопряжённые реакции, получившие название ГАМК-шунта. Первую катализирует глутаматдекарбоксилаза, которая является пиридоксальзависимым ферментом. Эта реакция является регуляторной и обусловливает скорость образования ГАМК в клетках мозга. Продукт реакции - ГАМК. Последующие 2реакции можно считать реакциями катаболизма ГАМК. ГАМК-аминотрансфераза, также пиридоксальзависимая, образует янтарный полуальдегид, который затем подвергается дегидрированию и превращается в янтарную кислоту. Сукцинат используется в цитратном цикле. Инактивация ГАМК возможна и окислительным путём под действием МАО. Содержание ГАМК в головном мозге в десятки раз выше других нейромедиаторов. Она увеличивает проницаемость постсинаптических мембран для ионов К+, что вызывает торможение нервного импульса; повышает дыхательную активность нервной ткани; улучшает кровоснабжение головного мозга. ГАМК в виде препаратов гаммалон или аминалон применяют при сосудистых заболеваниях головного мозга (атеросклероз, гипертония), нарушениях мозгового кровообращения, умственной отсталости, эндогенных депрессиях и травмах головного мозга, а также заболеваниях ЦНС, связанных с резким возбуждением коры мозга (например, эпилепсии). Синтез и биологическая роль гистамина Гистамин образуется путем декарбоксилирования гистидина в тучных клетках соединительной ткани (см. схему А на с. 516). Гистамин образует комплекс с белками и сохраняется в секреторных гранулах тучных клеток. Секретируется в кровь при повреждении ткани (удар, ожог, воздействие эндо- и экзогенных веществ), развитии иммунных и аллергических реакций. Гистамин выполняет в организме человека следующие функции:
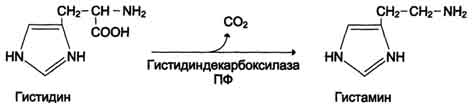 Схема А
Дезаминирование аминокислот - реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака. Дальнейшие превращения продуктов дезаминирования аминокислот представлены на рис. 9-7. Аммиак токсичен для ЦНС, поэтому в организме человека и млекопитающих он превращается в нетоксичное хорошо растворимое соединение - мочевину. В виде мочевины, а также в виде солей аммония аммиак выводится из организма. Безазотистый остаток используется для образования аминокислот в реакциях трансаминирования, 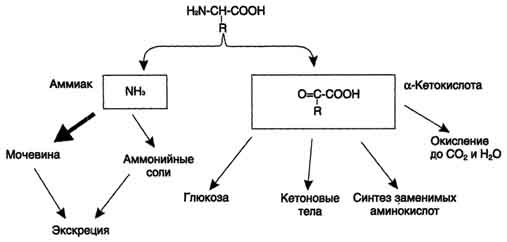 Рис. 9-7. Судьба продуктов дезаминирования аминокислот. в процессах глюконеогенеза, кето-генеза, в анаплеротических реакциях для восполнения убыли метаболитов ОПК, в реакциях окисления до СО2 и Н2О. Существует несколько способов дезаминирования аминокислот:
1. Окислительное дезаминирование Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты. Реакцию катализирует фермент глутаматдегидрогеназа, коферментом глутаматдегидрогеназы является NAD+. Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование а-иминоглутарата, затем - неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется а-кетоглутарат (см. схему ниже). Окислительное дезаминирование глутамата - обратимая реакция и при повышении концентрации аммиака в клетке может протекать в обратном направлении, как восстановительное шинирование α-кетоглутарата. Глутаматдегидрогеназа очень активна в митохондриях клеток практически всех органов, кроме мышц. Этот фермент - олигомер, состоящий из 6 субъединиц (молекулярная масса 312 кД). Глутаматдегидрогеназа играет важную роль, так как является регуляторным ферментом аминокислотного обмена. Аллостерические ингибиторы глутаматдегидрогеназы (АТФ, ГТФ, NADH) вызывают диссоциацию фермента и потерю глутаматдегидрогеназной активности. Высокие концентрации АДф активируют фермент. Таким образом, низкий энергетический уровень в клетках стимулирует разрушение аминокислот и образованиеα-кетоглутарата, поступающего в ЦТК как энергетический субстрат. Глутаматдегидрогеназа может индуцироваться стероидными гормонами (кортизолом). 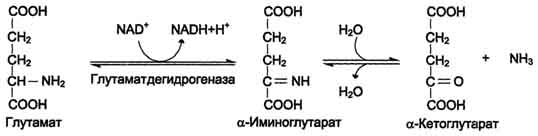 Схема 2. Непрямое дезаминирование (трансдезаминирование) Большинство аминокислот не способно дезаминироваться в одну стадию, подобно Глу. Аминогруппы таких аминокислот в результате трансаминирования переносятся на α-кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию. Такой механизм дезаминирования аминокислот в 2 стадии получил название трансдезаминирования, или непрямого дезаминирования: 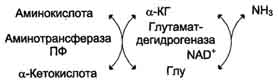 Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: аминотрансферазы (кофермент ПФ) и глутаматдегидрогеназы (кофермент NAD+). Значение этих реакций в обмене аминокислот очень велико, так как непрямое дезаминирование - основной способ дезаминирования большинства аминокислот. Обе стадии непрямого дезаминирования обратимы (рис. 9-9), что обеспечивает как катаболизм аминокислот (рис. 9-9, А), так и возможность образования практически любой аминокислоты из соответствующей α-кетокислоты (рис. 9-9, Б). В мышечной ткани активность глутаматдегидрогеназы низка, поэтому в этих клетках при интенсивной физической нагрузке функционирует ещё один путь непрямого дезаминирования с участием цикла ИМФ-АМФ. Вначале происходит перенос аминогруппы аминокислот на аспартат, затем на инозиновую кислоту (ИМФ) и в завершение - дезаминирование АМФ. Представленная схема отражает последовательность реакций непрямого неокислительного дезаминирования: 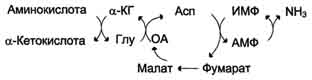 Можно выделить 4 стадии процесса:
Перенос аминогруппы от аспартата и синтез АМФ происходят следующим образом (см. схему А на с. 476). Реакция дезаминирования адениловой кислоты происходит под действием фермента АМФ дезаминазы (см. схему Б на с. 476). 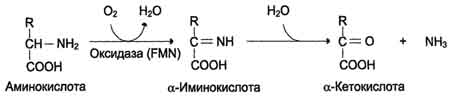 \ 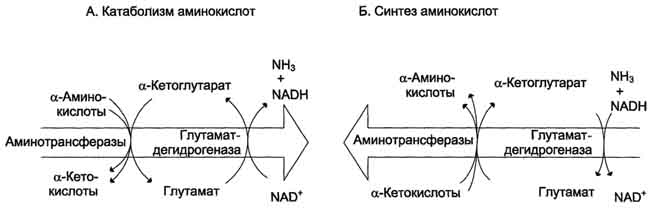 Рис. 9-9. Биологическая роль непрямого дезаминирования. А - при катаболизме почти все природные аминокислоты сначала передают аминогруппу на а-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогена-зы, в результате чего получаются а-кетоглутарат и аммиак; Б - при необходимости синтеза аминокислот и наличии необходимых а-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования а-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей а-кетокислотой, что приводит к синтезу новой аминокислоты. 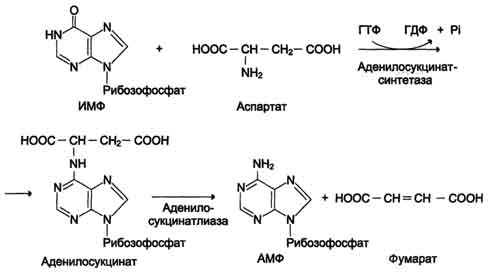 Схема А 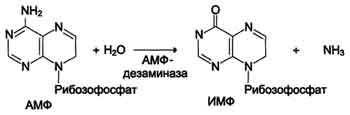 Схема Б. Этот путь дезаминирования преобладает в мышцах при интенсивной работе, в результате которой накапливается молочная кислота. Выделяющийся аммиак предотвращает закисление среды в клетках, вызванное образованием лактата. 3. Неокислительное дезамитровате В печени человека присутствуют специфические ферменты, катализирующие реакции дезаминирования аминокислот серина, треонина и гистидина неокислительным путём. Неокислительное дезаминирование серина катализирует сериндегидратаза (см. схему А на с. 477). Реакция начинается с отщепления молекулы воды и образования метиленовой группы, затем происходит неферментативная перестройка молекулы, в результате которой образуется иминогруппа, слабо связанная с а-углеродным атомом. Далее в результате неферментативного гидролиза отщепляется молекула аммиака и образуется пируват. Неокислительное дезаминирование треонина катализирует фермент треониндегидратаза. Механизм реакции аналогичен дезаминированию серина (см. схему Б на с. 477). Эти ферменты гшридоксальфосфатзависимые. Неокислительное дезаминирование гистидина под действием фермента гистидазы (гистидин-аммиаклиазы) является внутримолекулярным, так как образование молекулы аммиака происходит из атомов самой аминокислоты без участия молекулы воды. Эта реакция происходит только в печени и коже (см. схему В на с. 477). 78. Обмен фенилаланина и тирозина. Особенности обмена тирозина в разных тканях. Синтез катихоламинов, меланинов, йодтиронинов. Наследственные биохимические блоки в распаде фенилаланина и тирозина: паркинсонизм, фенилкетонурия, алкаптонурия, альбинизм, диагностика и лечение. Фенилаланин - незаменимая аминокислота, так как в клетках животных не синтезируется её бензольное кольцо. Тирозин - условно заменимая аминокислота, поскольку образуется из фенилаланина. Содержание этих аминокислот в пищевых белках (в том числе и растительных) достаточно велико. Фенилаланин и тирозин используются для синтеза многих биологически Схема ГГлутатион 504 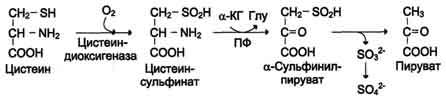 Схема A 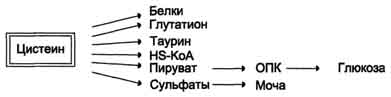 Схема Б активных соединений. В разных тканях метаболизм этих аминокислот происходит поразному. 1. Метаболизм феиилаланина Основное количество фенилаланина расходуется по 2 путям:
Превращение фенилаланина в тирозин прежде всего необходимо для удаления избытка фенилаланина, так как высокие концентрации его токсичны для клеток. Образование тирозина не имеет большого значения, так как недостатка этой аминокислоты в клетках практически не бывает. Основной путь метаболизма фенилаланина начинается с его гидроксилирования (рис. 9-29), в результате чего образуется тирозин. Эта реакция катализируется специфической монооксиге-назой - фенилаланингидр(жсилазой, кофермен-том которой служит тетрагидробиоптерин (Н4БП). Активность фермента зависит также от наличия Fe2+. Реакция необратима. Н4БП в результате реакции окисляется в дигидробиоптерин (Н2БП). Регенерация последнего происходит при участии дигидроптеридинредуктазы с использованием NADPH + H+. 2. Особенности обмена тирозина в разных тканях Обмен тирозина значительно сложнее, чем обмен фенилаланина. Кроме использования в синтезе белков, тирозин в разных тканях выступает предшественником таких соединений, как катехоламины, тироксин, меланины, и ка-таболизируется до СО2 и Н2О. Катаболизм тирозина в печени В печени происходит катаболизм тирозина до конечных продуктов. Специфический путь катаболизма включает несколько ферментативных реакций, завершающихся образованием фумарата и ацетоацетата (см. схему А на с. 507):
Обмен фенилаланина и тирозина связан со значительным количеством реакций гидроксилирования, которые катализируют оксигеназы. Ферменты оксигеназы (гидроксилазы) используют молекулу О2 и кофермент-донор водорода (чаще - Н4БП). Для катализа оксигеназам не- 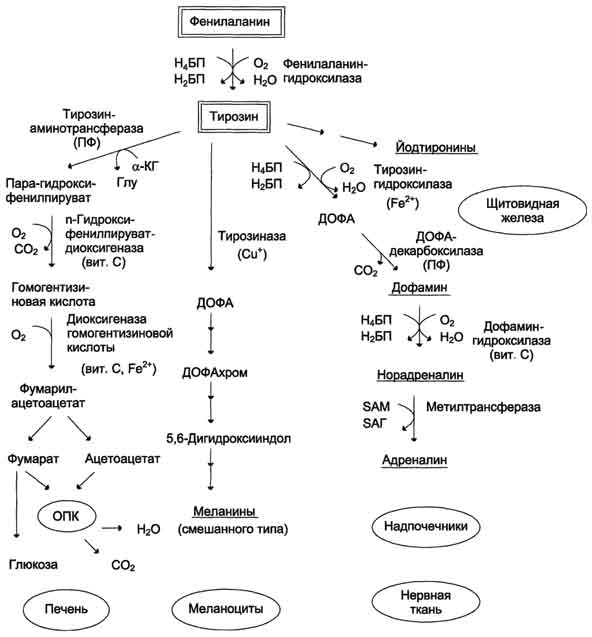 |
