Значение биохимии в подготовке врача. Биологическая химия
 Скачать 8.33 Mb. Скачать 8.33 Mb.
|
|
Часть молекул холестерола в кишечнике под действием ферментов бактерий восстанавливается по двойной связи в кольце В, в результате чего образуютря 2 типа молекул - холестанол и копростанол, выводимые с фекалиями. В сутки из организма выводится от 1,0 г до 1,3 г холестерола, основная часть удаляется с фекалиями. Концентрация холестерола в крови взрослых людей составляет 200±50 мг/дл (5,2±1,2 ммоль/л) и, как правило, увеличивается с возрастом. Превышение нормальной концентрации холестерола в крови называют гиперхолестеролемией. 70. Роль липопротеинов низкой и высокой плотности (ЛПНП и ЛПВП) в обмене холестерина. Биохимические основы развития атеросклероза Количественное определение общего холестерина в сыворотке крови. Клиническое значение определения. Особенности липидного состава крови у детей. Липиды являются в основе своей гидрофобными молекулами, они транспортируются в водной фазе крови в составе особых частиц – липопротеинов. Такие транспортные липопротеины можно сравнить с орехом, который имеет скорлупу и ядро. Поверхность липопротеиновой частицы ("скорлупа") гидрофильна и сформирована белками, фосфолипидами и свободным холестеролом. Триацилглицеролы и эфиры холестерола составляют гидрофобное ядро. Белки в липопротеинах обычно называются апобелками, выделяют несколько их типов – А, В, С, D, Е. В каждом классе липопротеинов находятся соответствующие ему апобелки, выполняющие структурную, ферментативную и кофакторную функции. ЛП различаются по соотношению триацилглицеролов, холестерола и его эфиров, фосфолипидов и как сложные белки состоят из четырех классов. хиломикроны (ХМ), липопротеины очень низкой плотности (ЛПОНП, пре-β-липопротеины, пре-β-ЛП), липопротеины низкой плотности (ЛПНП, β-липопротеины, β-ЛП), липопротеины высокой плотности (ЛПВП, α-липопротеины, α-ЛП). Хиломикроны и ЛПОНП ответственны, в первую очередь, за транспорт жирных кислот в составе ТАГ. ЛП высокой и низкой плотности – за транспорт холестерола и жирных кислот в составе эфиров ХС. Транспорт триацилглицеролов от кишечника к тканям (экзогенные ТАГ) осуществляется в виде хиломикронов (ХМ), от печени к тканям (эндогенные ТАГ) – в виде липопротеинов очень низкой плотности.В транспорте ТАГ к тканям можно выделить последовательность следующих событий: 1.Образование незрелых первичных ХМ в кишечнике. 2.Движение первичных ХМ через лимфатические протоки в кровь. 3.Созревание ХМ в плазме крови – получение белков апоС-II и апоЕ от ЛПВП. 4.Взаимодействие с липопротеинлипазой (ЛПЛ) эндотелия, которая отщепляет жирные кислоты от ТАГ. Жирные кислоты переходят непосредственно в данную ткань или, связываясь с альбумином, разносятся по организму. В результате количество ТАГ в хиломикроне резко снижается и образуются остаточные ХМ. 5.Переход остаточных ХМ в гепатоциты и полный распад их структуры. 6.Синтез ТАГ в печени из пищевой глюкозы. Использование ТАГ, пришедших в составе остаточных ХМ. 7.Образование первичных ЛПОНП в печени. 8.Созревание ЛПОНП в плазме крови – получение белков апоС-II и апоЕ от ЛПВП. 9.Взаимодействие с липопротеинлипазой эндотелия и потеря большей части ТАГ. Образование остаточных ЛПОНП (по-другому липопротеины промежуточной плотности, ЛППП). 10.Остаточные ЛПОНП переходят в гепатоциты и полностью распадаются, либо остаются в плазме крови. После воздействия на них печеночной ТАГ-липазы в синусоидах печени ЛПОНП превращаются в ЛПНП. ЛП очень низкой плотности (пребеталипопротеиды): -синтезируются в печени из эндогенных и экзогенных липидов, -в их составе преобладают ТАГ, около 40% от массы составляют белок, фосфолипиды и холестерол (8% белка, 60% ТАГ, 6% ХС, 12% эфиров ХС, 14% фосфолипидов), -основным белком является апоВ-100, выполняющий структурную функцию, -в норме концентрация 1,3-2,0 г/л, -слабо атерогенны. Функция: Транспорт эндогенных и экзогенных ТАГ от печени в ткани, запасающие и использующие жиры, т.е. в те же ткани, что и хиломикроны (в сутки в печни обр-ся от 20 до 50 г жира на экспорт) Метаболизм: 1. Первичные ЛПОНП образуются в печени из пищевых жиров, достигающих гепатоцитов с остаточными хиломикронами, и новосинтезированных из глюкозы жиров, содержат только апоВ-100; 2. В крови первичные ЛПОНП взаимодействуют с ЛПВП и приобретают от них апоС-II и апоЕ, образуя зрелые формы. 3. Аналогично хиломикронам, на эндотелии капилляров ряда тканей зрелые ЛПОНП подвергаются воздействию липопротеинлипазы, которая находится на поверхности кл эндотелия сосудов с образованием свободных жирных кислот и глицерина. Жирные кислоты перемещаются в клетки органов и используются как Е материал, либо остаются в плазме крови и в комплексе с альбумином разносятся с кровью в другие ткани. 4. Остаточные ЛПОНП (также называемые липопротеины промежуточной плотности, ЛППП) либо эвакуируются в гепатоциты посредством эндоцитоза, связанного с рецепторами к апоЕ и апоВ-100-белкам, либо после воздействия на них печеночной ТАГ-липазы (только в сосудах печени) превращаются в следующий класс липопротеинов – липопротеины низкой плотности (ЛПНП). ЛП низкой плотности (ЛПНП или beta-липопротеипы): Образуются в крови. Состоят из 25% белка и 75% липидов. Главным компонентом является холестерин (примерно50%) в виде эфиров с линолевой кислотой и фосфолипиды. У здоровых людей до 2/3 всего холестерина плазмы находится в составе ЛПНП. Они являются главным поставщиком холестерина в ткани. ЛПНП регулируют синтез холестерина de novo. Большинство ЛПНП являются продуктами расщепления ЛПОНП липопротеидлипазой. На клеточных мембранах имеются рецепторы для ЛПНП, они взаимодействуют с апопротеинами ЛПНП. После узнавания проникают в клетки путем эндоцитоза, там распадаются под действием ферментов гидролаз в лизосомах. Освободившийся холистерин идёт на построение мембран и метаболические нужды клеток. Функция: транспорт холестерина в ткани, в том числе в печени. ЛП высокой плотности (ЛПВП или а-липопротеины): Состав: 50% белков, 25% фосфолипидов, 20% эфиров холестерина и очень мало триацилглицеринов. Образуются главным образом в печени. В поверхностном слое ЛПВПобразуют комплексы с ферментом лецитинхолестеролацилтрансферазой (ЛХАТ). С помощью этого фермента остаток ж к-ты переносится с лицитина на свободный холестерин ЛПВП, превращая его в эфир (холестерид) и лизофосфотидилхолин. Холестерид является гидрофобным соединением, поэтому перемещается в ядро ЛПВП. Т.о. он нагружается эфирами холестерина, увел-ся в размерах и из дисковидного превращается в частицу сферической формы – зрелый ЛПВП. Далее он транспортируется в печень, где холестерин исп-ся на синтез желчных к-т. ЛПВП, благодаря ЛХАТ, забирают холестерин от других липопротеидов и транспортируют его в печень, предотвращая накопление его в клетках. Концентрация ЛПВП меняется в зависимости от ритма питания. Их мах кол-во ч/з 4-5 часов после еды. Ч/з 10-12 часов хиломикронов 0%, ЛПОНП 15%, ЛПНП 60%, ЛПВП 25%. ЛПОНП и ЛПНП считают атерогенными, то есть вызыва¬ющими атеросклероз. ЛПВП — антитиатерогенными. Нарушения липидного обмена могут быть как первичными, так и вторичными, т.е. вызванными патологией эндокринной системы или компенсаторные при различных заболеваниях. Нарушения переваривания и всасывания липидов сопровождаются развитием стеатореи (повышенное содержание липидов и жирных кислот в кале) и обусловливаются одной из следующих причин: 1.Дефицит панкреатической липазы, связанный с заболеваниями поджелудочной железы. 2.Дефицит желчи в кишечнике, обсуловленный заболеваниями печени или желчевыводящих путей. 3.Угнетение ферментных систем ресинтеза триглицеридов в стенке кишечника при его заболеваниях. Повышение липопротеидов называется гиперлипопротеидемией. Главная опасность этого состояния связана с тем, что повыш-ся вер-ть возникновения атеросклероза. Вер-ть заболевания тем выше, чем больше отношение ЛПНП к ЛПВП в крови. Атеросклероз -это патология, которая характеризуется отложением, главным образом, холестерина в стенке крупных сосудов (аорта, коронарные сосуды, сосуды мозга и т.д.) с образованием вначале пятен, полосок. Затем на их месте образуются утолщения (атеросклеротические бляшки). Эти липидные бляшки являются сво¬еобразным инородным телом, вокруг которого развивается со¬единительная ткань, затем наступает кальцификация пораженного участка сосуда. Сосуды становятся неэластичными, плотными, ухудшается кровоснабжение ткани, а на месте бляшек могут возникать тромбы. В стенке сосудов есть два защитных механизма от избыточного отложения холестерина: Работа липопротеидлипазы, которая расщепляет жир липопротеидов, делает их меньше по размеру;ЛПВП, которые уносят холестерин.Ожирение: У нормально упитанного человека жиры составляют около 15% массы тела. При сбалансированном питании количество жира в организме не изменяется. При этом жиры жировой ткани все время обновляются, то есть одновременно идут липолиз и липогенез с равными скоростями. В результате жиры жировой ткани за несколько дней обновляются полностью. При длительном голодании и физических нагрузках липолиз идет с большей скоростью, чем липогенез. В результате количество депонированного жира уменьшается. Если липогенез опережает липолиз, наступает ожирение. Наиболее частой причиной ожирения является несоответствие между количеством потребляемой пищи и энергетическими тратами организма. Такое несоответствие возникает при переедании (особенно углеводов, так как они легко переходят в жиры), при гиподинамии (при этом мобилизация жира идет с более низкой скоростью) и, особенно, при сочетании этих факторов. Кроме того, ожирение является характерным признаком многих эндокринных заболеваний. Генетические заболевания, при которых происходит неполное расщепление полимерных веществ и их накопление, получили название лизосомные болезни накопления, так как они обусловлены дефектами специфических лизосомальных гидролаз. В случае накопления липидов такие болезни называются липидозы. При липидозах нарушается нормальный катаболизм липидов до соответствующих мономеров. Болезнь Вольмана – редкое аутосомно-рецессивное заболевание из-за дефекта кислой эстеразы лизосом, что обусловливает накопление эфиров холестерола в лизосомах печени, селезенки, надпочечников, костного мозга и тонкого кишечника. Проявляется в первые недели жизни рвотой, диареей и стеатореей, гепатоспленомегалией и двусторонним кальцинозом надпочечников. Больные умирают в возрасте до 6 мес. Болезнь Шюллера-Кристиана аутосомно-рецессивное заболевание характеризуется отложением в плоских костях, твердой мозговой оболочке и коже холестерола и его эфиров. Характерными являются деструктивные изменения в костях, остеопороз, мозжечковые расстройства. Заболевание обычно начинается в возрасте до 10 лет, реже позднее. Мужчины болеют в 2 раза чаще, чем женщины. Течение заболевания прогрессирующее. Дефектный фермент неизвестен. Болезнь Гоше – отложение цереброзидов в макрофагальных клетках селезенки, печени, лимфатических узлов и костного мозга. Возникает в связи с аутосомно-рецессивным отсутствием гликоцереброзидазы (β-глюкозидазы). Основными симптомами заболевания являются спленомегалия, увеличение печени и селезенки, а также изменения в костях, проявляющиеся в виде остеопороза. При болезни Нимана-Пика наблюдается отложение сфингомиелина в клетках различных органов из-за дефицита сфингомиелиназы. Болезнь наследуется аутосомно-рецессивно, проявляется резким увеличением печени и селезенки, замедлением психического развития ребенка, появлением слепоты и глухоты. Чаще всего дети погибают в возрасте до 2 лет. Болезнь Тея-Сакса (амавротическая семейная идиотия) является результатом дефекта N-ацетилгексозаминидазы, при котором происходит отложение ганглиозидов в клетках головного мозга, что сопровождается атрофией зрительных нервов, слепотой, слабоумием и смертью в младенческом возрасте. Содержание липидных фракций новорожденных отличается от спектра этих веществ у более старших детей и взрослых тем, что у них значительно увеличено содержание альфа-липопротеинов и понижено количество. 71. Общая схема источников поступления и путей расходования аминокислот в тканях. Динамическое состояние белков в организме. Причины необходимости постоянного обновления белков организма. «Незаменимые» аминокислоты. АК, класс органических соединений, объединяющих в себе свойства кислот и аминов, т.е. содержащих наряду с карбоксильной группой - COOH аминогруппу - NH2. АК играют важную роль в жизни организмов, т.к. все белковые вещества построены из аминокислот. Все белки при полном гидролизе (расщеплении с присоединением воды) распадаются до свободных аминокислот, играющих роль мономеров в полимерной белковой молекуле. Источники АК в клетке – поступление с пищей, из крови, распад собственных внутриклеточных белков и синтез заменимых аминокислот, кетокислот. Основным экзогенными источником аминокислот являются белки пищи. Белки переводятся в доступную для организма форму при переваривании под действием протеолитических ферментов, входящих в состав желудочно-кишечных секретов. Свободные аминокислоты всасываются и после транспорта кровью включаются в клетках в различные пути использования. Путь дальнейшего превращения аминокислот зависит от вида и функции клетки, условий ее существования и гормональных влияний. Спектр веществ, получаемых клеткой из аминокислот, чрезвычайно широк. Главным путь испол-я - синтез собственных белков. АК используются для синтеза других азотсодержащих соединений, например таких, как тироксин, адреналин, гистамин, выполняющих специфические функции. Аминокислоты используются также как источники энергии, включаясь в путь катаболизма. Многие растения и бактерии могут синтезировать все необходимые им аминокислоты из простых неорганических соединений. Большинство аминокислот синтезируются в теле человека и животных из обычных безазотистых продуктов обмена веществ и усвояемого азота. Однако восемь аминокислот (валин, изолейцин, лейцин, лизин, фенилаланин, метионин, треонин, триптофан) являются незаменимыми, т.е. не могут синтезироваться в организме животных и человека, и должны доставляться с пищей. Суточная потребность взрослого человека в каждой из незаменимых аминокислот составляет в среднем около 1 грамма. При недостатке этих аминокислот (чаще триптофана, лизина, метионина) или в случае отсутствия в пище хотя бы одной из них невозможен синтез белков и многих других биологически важных веществ, необходимых для жизни. В организме человека возможен синтез восьми заменимых аминокислот: Ала, Асп, Асн, Сер, Гли, Глу, Глн, Про. Углеродный скелет этих аминокислот образуется из глюкозы. α-аминогруппа вводится в соответствующие α-кетокислоты в результате реакций трансаминирования. Универсальным донором α-аминогруппы служит глутамат. Путём трансаминирования α-кетокислот, образующихся из глюкозы, синтезируются аминокислоты. Глутамат также образуется при восстановительном аминировании α-кетоглутарата глутаматдегидрогеназой. Эти реакции обратимы и играют большую роль как в процессе синтеза аминокислот, так и при их катаболизме. Такие реакции, выполняющие двойную функцию, называют амфиболическими. Бднако безбелковое питание (особенно продолжительное) вызывает серьёзные нарушения обмена и неизбежно заканчивается гибелью организма. Исключение даже одной незаменимой аминокислоты из пищевого рациона ведёт к неполному усвоению других аминокислот и сопровождается развитием отрицательного азотистого баланса, истощением, остановкой роста и нарушениями функций нервной системы. Конкретные проявления недостаточности одной из аминокислот были выявлены у крыс, которым скармливали белки, лишённые определённой аминокислоты. Так, при отсутствии цистеина (или цистина) возникал острый некроз печени, гистидина - катаракта; отсутствие метионина приводило к анемии, ожирению и циррозу печени, облысению и геморрагии в почках. Исключение лизина из рациона молодых крыс сопровождалось анемией и внезапной гибелью (этот синдром отсутствовал у взрослых животных). Недостаточность белкового питания приводит к заболеванию, получившему в Центральной Африке название "квашиоркор", что в переводе означает "золотой (или красный) мальчик". Заболевание развивается у детей, которые лишены молока и других животных белков, а питаются исключительно растительной пищей, включающей бананы, таро, просо и, чаще всего, кукурузу. Квашиоркор характеризуется задержкой роста, анемией, гипопротеинемией (часто сопровождающейся отёками), жировым перерождением печени. У лиц негроидной расы волосы приобретают красно-коричневый оттенок. Часто это заболевание сопровождается атрофией клеток поджелудочной железы. В результате нарушается секреция панкреатических ферментов и не усваивается даже то небольшое количество белков, которое поступает с пищей. Происходит поражение почек, вследствие чего резко увеличивается экскреция свободных аминокислот с мочой. Без лечения смертность детей составляет 50-90%. Даже если дети выживают, длительная недостаточность белка приводит к необратимым нарушениям не только физиологических функций, но и умственных способностей. Заболевание исчезает при своевременном переводе больного на богатую белком диету, включающую большие количества мясных и молочных продуктов. Один из путей решения проблемы - добавление в пищу препаратов лизина. 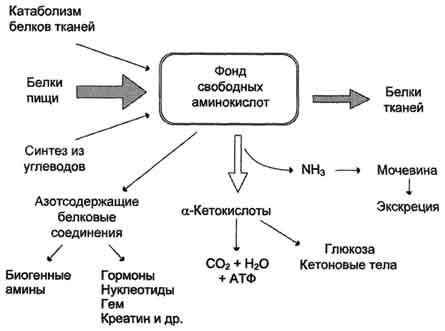 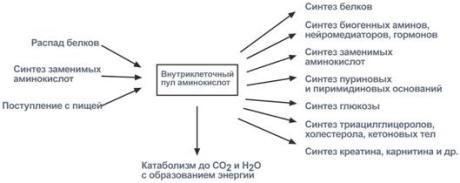 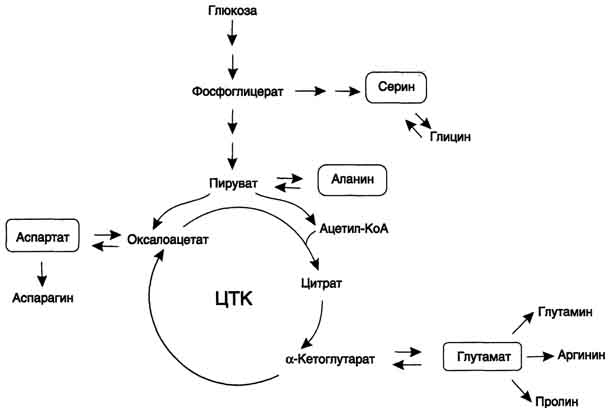 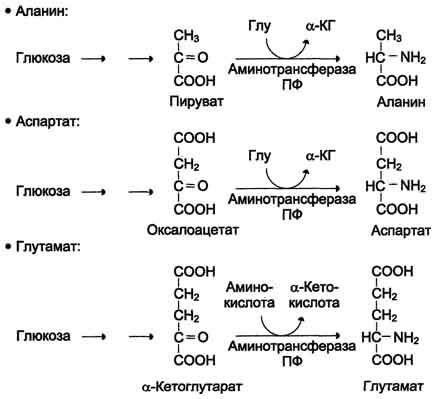 72. Катаболизм аминокислот. Общие пути распада аминокислот. Трансаминирование аминокислот. Схема реакций, ферменты, роль витамина В6. Биологическое значение трансаминирования. Диагностическое значение определения трансаминаз в сыворотке крови. Непрямое окислительное дезаминирование (трансдезаминирование). Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма. 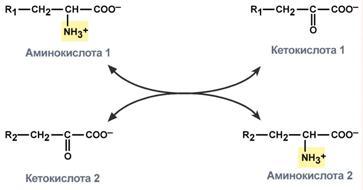 Первый этап заключается в обратимом переносе NH2-группы с аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты – этот перенос называется трансаминирование и его механизм довольно сложен. В качестве кетокислоты-акцептора ("кетокислота 2") в организме обычно используется α-кетоглутаровая кислота, которая превращается в глутамат ("аминокислота 2"). В результате трансаминирования свободные аминокислоты теряют α-NH2-группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в цикл трикарбоновых кислот и тканевое дыхание, где сгорает до СО2 и Н2О. При необходимости (например, голодание) углеродный скелет глюкогенных аминокислот может использоваться для синтеза глюкозы в глюконеогенезе. Второй этап состоит в отщеплении аминогруппы от аминокислоты 2 – дезаминирование. В организме человека дезаминированию подвергается только глутаминовая кислота. Второй этап осуществляется глутаматдегидрогеназой (перейти вверх). В организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, и только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма, кроме мышечных. Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминирование. Если реакция идет в митохондриях печени, аммиак используется для синтеза мочевины, которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза. Т.к. НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН. Роль трансаминирования и трансдезаминирования: 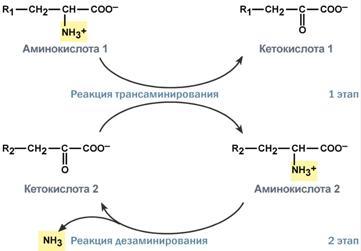 Реакции трансаминирования: -активируются в печени, мышцах и других органах при поступлении в клетку избыточного количества тех или иных аминокислот – с целью оптимизации их соотношения, -обеспечивают синтез заменимых аминокислот в клетке при наличии их углеродного скелета (кетоаналога), -начинаются при прекращении использования аминокислот на синтез азотсодержащих соединений (белков, креатина, фосфолипидов, пуриновых и пиримидиновых оснований) – с целью дальнейшего катаболизма их безазотистого остатка и выработки энергии, -необходимы при внутриклеточном голодании, например, при гипогликемиях различного генеза – для использования безазотистого остатка аминокислот в печени для кетогенеза и глюконеогенеза, в других органах – для его прямого вовлечения в реакции цикла трикарбоновых кислот. -при патологиях (сахарный диабет, гиперкортицизм) обуславливают наличие субстратов для -глюконеогенеза и способствуют патологической гипергликемии. Продукт трансаминирования глутаминовая кислота: -является одной из транспортных форм аминного азота в гепатоциты, -способна реагировать со свободным аммиаком, обезвреживая его. Процесс трансдезаминирования идет в организме непрерывно, потому что сопряженные реакции трансаминирования и дезаминирования создают поток лишнего аминного азота из периферических клеток в печень для синтеза мочевины и в почки для синтеза аммонийных солей. 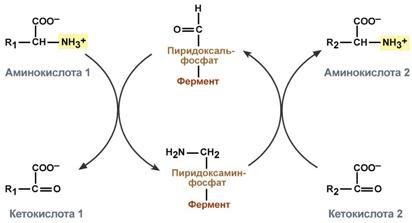 |
