Значение биохимии в подготовке врача. Биологическая химия
 Скачать 8.33 Mb. Скачать 8.33 Mb.
|
|
Рис. 12-1. Метаболизм и выведение ксенобиотиков из организма. RH - ксенобиотик; К - группа, используемая при конъюгации (глутатион, глюкуронил и др.); М - молекулярная масса. Из множества цитохром Р450 - зависимых реакций на рисунке приведена только одна - схема гидроксилирования ксенобиотика. В ходе первой фазы в структуру вещества RH вводится полярная группа ОН-. Далее происходит реакция конъюгации; конъюгат в зависимости от растворимости и молекулярной массы удаляется либо почками, либо с фекалиями. 617 Таблица 12-1. Возможные модификации ксенобиотиков в первой фазе обезвреживания
В метаболизме ксенобиотиков могут принимать участие ферменты почек, лёгких, кожи и ЖКТ, но наиболее активны они в печени. К группе микросомальных ферментов относят специфические оксидазы, различные гидролазы и ферменты конъюгации. Вторая фаза - реакции конъюгации, в результате которых чужеродное вещество, модифицированное ферментными сисгемами ЭР, связывается с эндогенными субстратами - глюкуроновой кислотой, серной кислотой, глицином, глутатионом. Образовавшийся конъюгат удаляется из организма. А. Микросомальное окисление Микросомальные оксидазы - ферменты, локализованные в мембранах гладкого ЭР, функционирующие в комплексе с двумя внемитохондриальными ЦПЭ. Ферменты, катализирующие восстановление одного атома молекулы О2 с образованием воды и включение другого атома кислорода в окисляемое вещество, получили название микросомальных оксидаз со смешанной функцией или микросомальных монооксигеназ. Окисление с участием монооксигеназ обычно изучают, используя препараты микросом. 1. Основные ферменты микросомальных электронтранспортных цепей Микросомальная сисгема не содержит растворимых в цитозоле белковых компонентов, все ферменты - мембранные белки, активные центры которых локализованы на цитоплазматической поверхности ЭР. Сисгема включает несколько белков, составляющих электронтранспортные цепи (ЦПЭ). В ЭР существуют две такие цепи, первая состоит из двух ферментов - NADPH-P450 редуктазы и цитохрома Р450, вторая включает фермент NADH-цитохром-b5 редуктазу, цитохром b5 и ещё один фермент - стеароил-КоА-десатуразу. Электронтранспортная цепь - NADPH-P450 редуктаза - цитохром Р450. В большинстве случаев донором электронов (e) для этой цепи служит NADPH, окисляемый NАDРН-Р450 редуктазой. Фермент в качестве простетической группы содержит 2 кофермента - флавинаденинди-нуклеотид (FAD) и флавинмононуклеотид (FMN). Протоны и электроны с NADPH переходят последовательно на коферменты NADPH-P450 редуктазы. Восстановленный FMN (FMNH2) окисляется цитохромом Р450(см. схему ниже). Цитохром Р450 - гемопротеин, содержит простетическую группу гем и имеет участки связывания 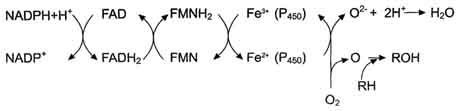 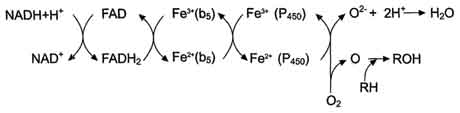 для кислорода и субстрата (ксенобиотика). Название цитохром Р450 указывает на то, что максимум поглощения комплекса цитохрома Р450 лежит в области 450 нм. Окисляемый субстрат (донор электронов) для NADH-цитохром b5 -редуктазы - NADH (см. схему выше). Протоны и электроны с NADH переходят на кофермент редуктазы FAD, следующим акцептором электронов служит Fe3+ цитохрома b5. Цитохром b5 в некоторых случаях может быть донором электронов (e) для цитохрома Р450 или для стеароил-КоА-десатуразы, которая катализирует образование двойных связей в жирных кислотах, перенося электроны на кислород с образованием воды (рис. 12-2). NADH-цитохром b5 редуктаза - двухдоменный белок. Глобулярный цитозольный домен связывает простетическую группу - кофермент FAD, а единственный гидрофобный "хвост" закрепляет белок в мембране. Цитохром b5- гемсодержащий белок, который имеет домен, локализованный на поверхности мембраны ЭР, и короткий "заякоренный" в липидном бислое спирализованный домен. NADH-цитохром b5 -редуктаза и цитохром b5, являясь "заякоренными" белками, не фиксированы строго на определённых участках мембраны ЭР и поэтому могут менять свою локализацию. 2. Функционирование цитохрома Р450 Известно, что молекулярный кислород в триплетном состоянии инертен и не способен взаимодействовать с органическими соединениями. Чтобы сделать кислород реакционно-способным, необходимо его превратить в синглетный, используя ферментные системы его восстановления. К числу таковых принадлежит моноксигеназная сисгема, содержащая цитохром Р450. Связывание в активном центре цитохрома Р450 липофильного вещества RH и молекулы кислорода повышает окислительную активность фермента. 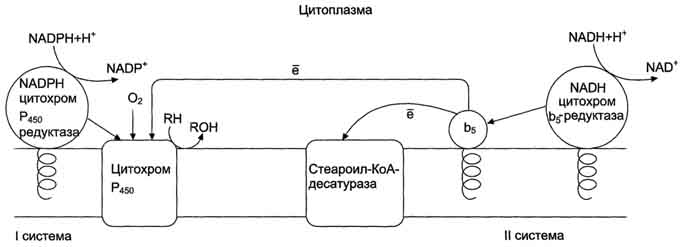 Рис. 12-2. Электронтранспортные цепи ЭР. RH - субстрат цитохрома Р450; стрелками показаны реакции переноса электронов. В одной системе NADPH окисляется NADPH цитохром Р450-редуктазой, которая затем передаёт электроны на целое семейство цитохромов Р450. Вторая сисгема включает в себя окисление NADH цитохром b5-редуктазой, электроны переходят на цитохром b5; восстановленную форму цитохрома b5 окисляет стеароил-КоА-десатураза, которая переносит электроны на О2. 619 Один атом кислорода принимает 2 е и переходит в форму О2-. Донором электронов служит NADPH, который окисляется NADPH-цитохром Р450 редуктазой. О2- взаимодействует с протонами: О2- + 2Н+→ Н2О, и образуется вода. Второй атом молекулы кислорода включается в субстрат RH, образуя гидроксильную группу вещества R-OH (рис. 12-3). Суммарное уравнение реакции гидроксилирования вещества RH ферментами микросомального окисления: RH + О2 + NADPH + Н+ → ROH + Н2О + NADP+ . Субстратами Р450 могут быть многие гидрофобные вещества как экзогенного (лекарственные препараты, ксенобиотики), так и эндогенного (стероиды, жирные кислоты и др.) происхождения. Таким образом, в результате первой фазы обезвреживания с участием цитохрома Р450 происходит модификация веществ с образованием функциональных групп, повышающих растворимость гидрофобного соединения. В результате модификации возможна потеря молекулой её биологической активности или даже формирование более активного соединения, чем вещество, из которого оно образовалось. 3. Свойства системы микросомального окисления Важнейшие свойства ферментов микросомального окисления: широкая субстратная специфичность, которая позволяет обезвреживать самые разнообразные по строению вещества, и регуляция активности по механизму индукции. Широкая субстратная специфичность. Изоформы Р450 К настоящему времени описано около 150 генов цитохрома Р450, кодирующих различные изоформы фермента. Каждая из изоформ Р450 имеет много субстратов. Этими субстратами могут быть как эндогенные липофильные вещества, модификация которых входит в путь нормального метаболизма этих соединений, так и гидрофобные ксенобиотики, в том числе лекарства. Определённые изоформы цитохрома 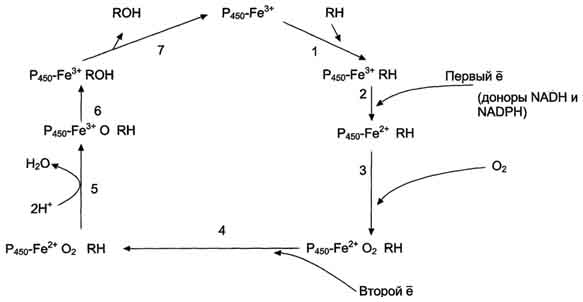 Рис. 12-3. Транспорт электронов при монооксигеназном окислении с участием Р450. Связывание (1) в активном центре цитохрома Р450 вещества RH активирует восстановление железа в теме - присоединяется первый электрон (2). Изменение валентности железа увеличивает сродство комплекса P450-Fe2+·RH к молекуле кислорода (3). Появление в центре связывания цитохрома Р450 молекулы О2 ускоряет присоединение второго электрона и образование комплекса P450-Fe2+O2--RH (4). На следующем этапе (5) Fe2+ окисляется, второй электрон присоединяется к молекуле кислорода P450-Fe3+O22-. Восстановленный атом кислорода (О2-) связывает 2 протона, и образуется 1 молекула воды. Второй атом кислорода идёт на построение ОН-группы (6). Модифицированное вещество R-OH отделяется от фермента (7). Р450 участвуют в метаболизме низкомолекулярных соединений, таких как этанол и ацетон. Регуляция активности микросомальной системы окисления Регуляция активности микросомальной системы осуществляется на уровне транскрипции или посттранскрипционных изменений. Индукция синтеза позволяет увеличить количество ферментов в ответ на поступление или образование в организме веществ, выведение которых невозможно без участия системы микросомального окисления. В настоящее время описано более 250 химических соединений, вызывающих индукцию микросомальных ферментов. К числу этих индукторов относят барбитураты, полициклические ароматические углеводороды, спирты, кетоны и некоторые стероиды. Несмотря на разнообразие химического строения, все индукторы имеют ряд общих признаков; их относят к числу липофильных соединений, и они служат субстратами для цитохрома Р450. Б. Конъюгация - вторая фаза обезвреживание веществ Вторая фаза обезвреживания веществ - реакции конъюгации, в ходе которых происходит присоединение к функциональным группам, образующимся на первом этапе, других молекул или групп эндогенного происхождения, увеличивающих гидрофильность и умеНbшающих токсичность ксенобиотиков (табл. 12-2). 93. Распад гема. Схема процесса, место протекания. Понятие «прямой» и «непрямой» билирубин. Диагностическое значение определения билирубина в крови и моче. Первая реакция катаболизма гема происходит при участии NADPH-зависимого ферментативного комплекса гемоксигеназы. Ферментная сисгема локализована в мембране ЭР, в области электронтранспортных цепей микросомального окисления. Фермент катализирует расщепление связи между двумя пиррольными кольцами, содержащих винильные остатки. 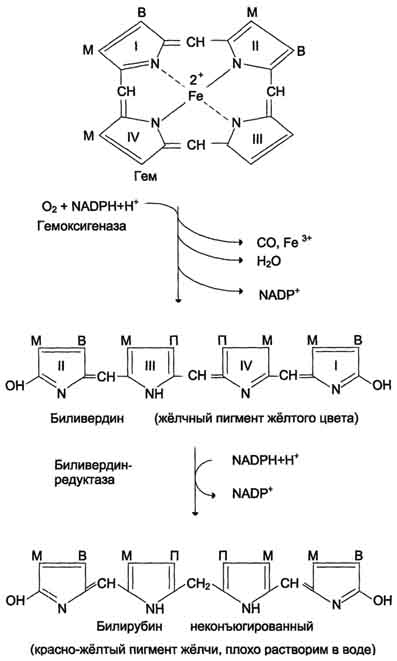 В ходе реакции образуются линейный тетрапир-рол - биливердин(пигмент жёлтого цвета) и монооксид углерода (СО), который получается из углерода метениловой группы. Гем индуцирует транскрипцию гена гемоксигеназы, абсолютно специфичной по отношению к тему. Ионы железа, освободившиеся при распаде гема, могут быть использованы для синтеза новых молекул гемоглобина или для синтеза других железосодержащих белков. Биливердин восстанавливается до билирубина NADPH-зависимым ферментом биливердинредуктазой. М - (-СН3) - метильная группа; В - (-СН=СН2) - винильная группа; П - (-CH2-CH2-COOH) - остаток пропионовои кислоты. В ходе реакции одна метильная группа превращается в окись углерода и, таким образом, раскрывается структура кольца. Образованный биливердин под действием биливердинредуктазы превращается в билирубин. Билирубин плохо растворяется в воде, поэтому в печень транспортируется в виде комплекса с белками крови - альбуминами («непрямой» или неконьюгированный билирубин). В печень билирубин переносится через мембрану гепатоцитов белками – лигандом и протеином Z. Эти белки обнаружены так же в клетках почек и кишечника. В гладком ЭПР гепатоцитов к билирубину присоединяются две глюкуроновой кислоты, образуя билирубиндиглюкуронид («прямой», или коньюгированный билирубин). Этот коньюгат хорошо растворим в воде. Донором глюкуроновой кислоты служит УДФ-глюкуронат. Реакция катализируется уридинфосфоглюкуронилтрансферазой. Индукция синтеза УДФ-глюкуронилтрансферазы происходит под действием фенобарбитала. Билирубин – диглюкуронид активным транспортом переносится с желчью в кишечник. 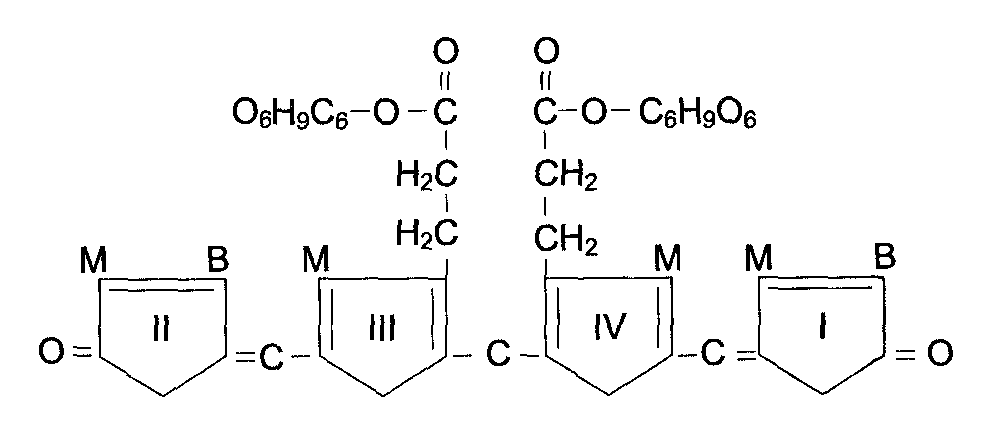 В кишечнике билирубинглюкуронид гидролизуется бактериальными ферментами β-глюкуронидазами. Освободившийся билирубин под действием кишечной микрофлоры восстанавливается в уробилиногены. (прямой билирубин) Билирубин в сыворотке (плазме) крови определяется по методу Ван дер Берга (1916 год), основанным на диазореакции. В норме содержание билирубина в плазме составляет 1.7 -17 мкмоль/л, 75% от него составляет «непрямой» билирубин. «Прямой» билирубин называется так потому, что он прямо взаимодействует с диазореагентом, будучи хорошо растворимым в воде. Не прямой билирубин гидрофобен, поэтому перед его измерением необходимо осадить альбумин, с которым он связан. Такой билирубин даёт цветную реакцию диазотирования только после осаждения альбумина. Гипербилирубинемия – повышение содержания билирубина в крови. При достижении концентрации билирубина в крови более 50 мкмоль/л он начинает диффундировать в ткани и окрашивает их в жёлтый цвет. Пожелтение тканей из-за отложения в них билирубина называется желтухой. 94. Нарушения обмена гема. Желтухи: гемолитическая, паренхиматозная, обтурационная, желтуха новорожденных. Причины развития синдрома, дифференциальная диагностика. Нарушения синтеза гема – Порфирии Порфирии – болезни, связанные с нарушением работы ферментов синтеза гема. Первичные порфирии обусловлены генетическими дефектами ферментов синтеза гема, вторичные связаны с нарушениями регуляции синтеза гема. В зависимости от основной локализации патологического процесса различают печёночные и эритропоэтические наследственные порфирии. При этом эритропоэтические порфирии сопровождаются накоплением порфиринов в нормобластах и эритроцитах, а печёночные – в гепатоцитах. Порфириногены не окрашены, но на свету они легко переходят в порфирины, которые проявляют красную флуоресценцию в ультрафиолетовых лучах. В коже на солнце кислород реагирует с порфиринами и переходит в синглетное состояние. В этой форме он вызывает ПОЛ клеточных мембран и разрушение клеток, поэтому порфирии часто сопровождаются фотосенсибилизацией и изъязвлением открытых участков кожи. Аминолевулинат и порфириногены являются нейротоксинами, что приводит к нейропсихическим расстройствам. Приём лекарств – индукторов АЛК – синтетазы – сульфаниламидов, барбитуратов, диклофенака, вольтарена, стероидов, истогенов – может вызвать обострение порфирии. В период полового созревания при повышении образования β-стероидов идёт индукция синтеза АЛК-синтетазы и проявляются симптомы порфирий. Порфирии наблюдаются и при отравлении солями свинца, т.к. свинец ингибирует АЛК-дегидратазу и феррохелатазу. Некоторые виды порфирий: Острая перемежающая (острая интермитирующая). Начинается после наступления половойзрелости. Причиной является блокада превращения порфобилиногена в уропорфириноген III, дефект фермента уропорфириноген 1-синтетазы. При этом идёт накопление АЛК и порфобилиногена. Симптомы: моча на воздухе имеет вишнёвый цвет, острые боли в животе, нарушение сердечной деятельности, артериальная гипертензия. Поражены клетки печени, но поражение кожи отсутствует. Причиной этих симптомов является вегетативная нейропатия вследствие биохимического поражения нервной системы. Острая эритропоэтическая порфирия. Начинается до 5 лет. Причиной является дисбаланс между работой промежуточных реакций образования уропорфирина I и III. Уропорфирин легко окисляется и даёт окрашенные продукты. Симптомы: поражение кожи, чувствительность к свету, свечение зубов в ультрафиолетовых лучах. Тяжёлая кожная порфирия. Может начаться в любом возрасте, но, как правило, не ранее 35 лет. Причиной служит снижение активности печёночной уропорфириногендекарбоксилазы, болезнь печени. |
