Значение биохимии в подготовке врача. Биологическая химия
 Скачать 8.33 Mb. Скачать 8.33 Mb.
|
|
Энзимодиагностика Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека. Принципы энзимодиагностики основаны на следующих позициях:
1. Причины, приводящие к увеличению количества ферментов в крови Ферменты плазмы крови можно разделить на 2 группы. Первая, относительно небольшая группа ферментов активно секретируется в плазму крови определёнными органами. Например, печень синтезирует неактивные предшественники ферментов свёртывающей системы крови. Ко второй относят большую группу ферментов, высвобождающихся из клеток во время их 119 нормального функционирования. Обычно эти ферменты выполняют свою функцию внутри клетки и не имеют физиологического значения в плазме крови. У здорового человека активность этих ферментов в плазме низкая и достаточно постоянная, так как постоянно соотношение скоростей высвобождения их из клеток и скоростей разрушения. При многих заболеваниях происходит повреждение клеток, и их содержимое, в том числе и ферменты, высвобождаются в кровь. К причинам, вызывающим высвобождение внутриклеточного содержимого в кровь, относят нарушение проницаемости мембраны клеток (при воспалительных процессах) или нарушение целостности клеток (при некрозе). Определение в крови активности ряда ферментов хорошо налажено в биохимических лабораториях, что используют для диагностики заболеваний сердца, печени, скелетной мускулатуры и других тканей. Уровень активности ферментов в плазме коррелирует со степенью повреждения клеток. Для энзимодиагностики имеют большое значение знания о субклеточной локализации ферментов. Так, появление в плазме крови ферментов, имеющих только цитозольную локализацию, свидетельствует о воспалительном процессе; при обнаружении митохондриальных или ядерных ферментов можно говорить о более глубоких повреждениях клетки, например о некрозе. Однако повышение концентрации ферментов не всегда связано с повреждением тканей. При избыточной клеточной пролиферации, например при онкопролиферативных процессах, при повышенной скорости синтеза некоторых ферментов в клетках или при нарушенном клиренсе (способности вьпюдиться почками) наблюдают повышение концентрации в крови определённых ферментов. Врачам следует учитывать, что нормальные значения активности ферментов в крови детей и беременных женщин отличаются от показателей, характерных для взрослых здоровых людей. 2. Изоферменты Ферменты, катализирующие одну и ту же химическую реакцию, но отличающиеся по первичной структуре белка, называют изофермен-тами, или изоэнзимами. Они катализируют один и тот же тип реакции с принципиально одинаковым механизмом, но отличаются друг от друга кинетическими параметрами, условиями активации, особенностями связи апофермента и кофермента. Природа появления изоферментов разнообразна, но чаще всего обусловлена различиями в структуре генов, кодирующих эти изоферменты. Следовательно, изоферменты различаются по первичной структуре белковой молекулы и, соответственно, по физико-химическим свойствам. На различиях в физико-химических свойствах основаны методы определения изоферментов. По своей структуре изоферменты в основном являются олигомерными белками. Причём та или иная ткань преимущественно синтезирует определённые виды протомеров. В результате определённой комбинации этих протомеров формируются ферменты с различной структурой - изомерные формы. Обнаружение определённых изоферментных форм ферментов позволяет использовать их для диагностики заболеваний. Изоформы лактатдегидрогеназы.Фермент лак-татдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты) (см. раздел 7). 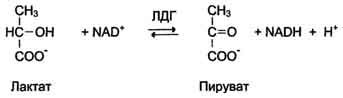 Лактатдегидрогеназа- олигомерный белок с молекулярной массой 134 000 Д, состоящий из 4 субъединиц 2 типов: М (от англ, muscle -мышца) и Н (от англ, heart- сердце). Комбинация этих субъединиц лежит в основе формирования 5 изоформ лактатдегидрогеназы (рис. 2-35, А). ЛДГ1 и ЛДГ2 наиболее активны в сердечной мышце и почках, ЛДГ4 и ЛДГ5 - в скелетных мышцах и печени. В остальных тканях имеются различные формы этого фермента.
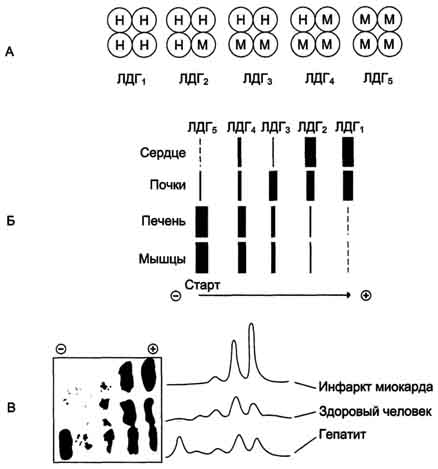 Рис. 2-35. Изоформы лактатдегидрогеназы. А - строение различных изоформ ЛДГ; Б - распределение на электрофореграмме и относительные количества изоформ ЛДГ в различных органах; В - содержание изоформ ЛДГ в плазме крови в норме и при патологии (электрофореграммы - слева и фотометрическое сканирование - справа).
Изоформы креатинкиназы.Креатинкиназа (КК) катализирует реакцию образования креатинфосфата: 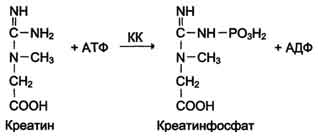 121 Молекула КК - димер, состоящий из субъединиц двух типов: М (от англ, muscle -мышца) и В (от англ, brain -мозг). Из этих субъединиц образуются 3 изофермента - ВВ, MB, MM. Изофермент ВВ находится преимущественно в головном мозге, ММ - в скелетных мышцах и MB - в сердечной мышце. Изоформы КК имеют разную электрофоретическую подвижность (рис. 2-36). Активность КК в норме не должна превышать 90 МЕ/л. Определение активности КК в плазме крови имеет диагностическое значение при инфаркте миокарда (происходит повышение уровня МВ-изоформы). Количество изоформы ММ может повышаться при травмах и повреждениях скелетных мышц. Изоформа ВВ не может проникнуть через гематоэнцефалический барьер, поэтому в крови практически не определяется даже при инсультах и диагностического значения не имеет. 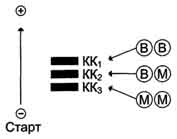 Рис. 2-36. Структура и электрофоретическая подвижность различных изоформ креатинкиназы. 3. Энзимодиагностика при инфаркте миокарда Примерно 30% больных инфарктом миокарда имеют атипичную клиническую картину этого заболевания. Поэтому необходимо проводить дополнительные методы исследования для подтверждения повреждения сердечной мышцы. При инфаркте миокарда наблюдают достоверные изменения в крови активности ферментов КК, ЛДГ и аспартатаминотрансферазы - ACT, которые зависят от времени, прошедшего от начала развития инфаркта и от зоны тканевого повреждения. Типичную кривую изменения активности этих ферментов можно видеть на рис. 2-37. После закупорки (окклюзии) коронарного сосуда в крови вначале отмечают повышение активности КК изоформы MB, однако фермент быстро удаляется из кровотока. Обнаружение повышенной активности КК в плазме крови - основной энзимодиагностический критерий инфаркта миокарда. Если у пациента с загрудинными болями не обнаружено изменения в активности КК, диагноз инфаркта миокарда маловероятен. Дополнительным подтверждением диагноза инфаркта миокарда служит обнаружение активностей ферментов ACT и ЛДГ в крови больных. Динамика изменений этих активностей также представлена на этом рисунке. Активность ACT в норме составляет 5-40 МЕ/л. При инфаркте миокарда активность ACT повышается через 4-6 ч; максимум активности наблюдают в течение 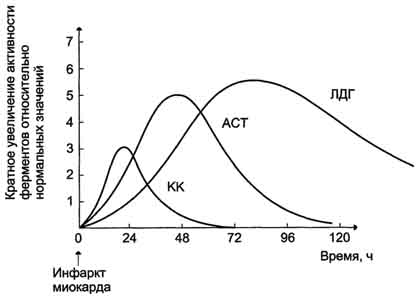 Рис. 2-37. Изменение активности ферментов в плазме крови при инфаркте миокарда. 122 2-3 дней. Уровень ЛДГ также увеличивается в плазме крови через несколько часов после закупорки кровеносного сосуда; максимум активности наблюдают на 3-4-й день, затей наступает постепенная нормализация активности. Уровень повышения активности ЛДГ коррелирует с размерами повреждения сердечной мышцы. 99. Коллаген: особенности аминокислотного состава, первичной и пространственной структуры. Особенности биосинтеза и созревания коллагена. Роль аскорбиновой кислоты в созревании коллагена. Коллаген - основной структурный белок межклеточного матрикса. Он составляет от 25 до 33% общего количества белка в организме, т.е. -6% массы тела. Название "коллаген" объединяет семейство близкородственных фибриллярных белков, которые являются основным белковым элементом кожи, костей, сухожилий, хряща, кровеносных сосудов, зубов. В разных тканях преобладают разные типы коллагена, а это, в свою очередь, определяется той ролью, которую коллаген играет в конкретном органе или ткани. Например, в пластинчатой костной ткани, из которой построено большинство плоских и трубчатых костей скелета, коллагеновые волокна имеют строго ориентированное направление: 687 продольное - в центральной части пластинок, поперечное и под углом - в периферической. Это способствует тому, что даже при расслоении пластинок фибриллы одной пластинки могут продолжаться в соседние, создавая таким образом единую волокнистую структуру кости. Поперечно ориентированные коллагеновые волокна могут вплетаться в промежуточные слои между костными пластинками, благодаря чему достигается прочность костной ткани. В сухожилиях коллаген образует плотные параллельные волокна, которые дают возможность этим структурам выдерживать большие механические нагрузки. В хрящевом матриксе коллаген образует фибриллярную сеть, которая придаёт хрящу прочность, а в роговице глаза коллаген участвует в образовании гексагональных решёток десцеметовых мембран, что обеспечивает прозрачность роговицы, а также участие этих структур в преломлении световых лучей. В дерме фибриллы коллагена ориентированы таким образом, что формируют сеть, особенно хорошо развитую в участках кожи, которые испытывают сильное давление (кожа подошв, локтей, ладоней), а в заживающей ране они агрегированы весьма хаотично. Аминокислотный состав и конформация коллагена описаны в подразделе "Фибриллярные белки" раздела 1. Здесь будут разобраны синтез и созревание коллагена, структуры, которые он образует, и их функции, а также заболевания, связанные с нарушением этих процессов. Полиморфизм коллагена Коллаген - ярко выраженный полиморфный белок. В настоящее время известно 19 типов коллагена, которые отличаются друг от друга по первичной структуре пептидных цепей, функциям и локализации в организме. Вариантов α-цепей, образующих тройную спираль, гораздо больше 19 (около 30). Для обозначения каждого вида коллагена пользуются определённой формулой, в которой тип коллагена записывается римской цифрой в скобках, а для обозначения α-цепей используют арабские цифры: например коллагены II и III типа образованы идентичными α-цепями, их формулы, соответственно [α1(II)]3 и [α1(III)]3; коллагены I и IV типов являются гетеротримерами и образуются обычно двумя разными типами α-цепей, их формулы, соответственно [α1(I)]2α2(I) и [α1(IV)]2α2(IV). Индекс за скобкой обозначает количество идентичных α-цепей. Распределение коллагенов по органам и тканям представлено в табл. 15-1. Гены коллагена называются соответственно типам коллагена и записываются арабскими цифрами, например COL1 -ген коллагена I типа, COL2- ген коллагена II типа, COL7- ген коллагена VII типа и т.д. К этому символу приписываются буква А (обозначает α-цепь) и арабская цифра (обозначает вид a-цепи). Например, COL1A1и COL1A2кодируют, соответственно, α1 и α2-цепи коллагена I типа. А. Этапы синтеза и созревания коллагена Синтез и созревание коллагена - сложный многоэтапный процесс, начинающийся в клетке, а завершающийся в межклеточном матриксе. Синтез и созревание коллагена включают в себя целый ряд посттрансляционных изменений (рис. 15-1):
Синтез полипептидных цепей коллагена Полипептидные цепи коллагена синтезируются на полирибосомах, связанных с мембранами ЭР, в виде более длинных, чем зрелые цепи, предшественников - препро-α-цепей. У этих предшественников имеется гидрофобный "сигнальный" пептид на N-конце, содержащий около 100 аминокислот. Основная функция сигнального пептида - ориентация синтеза пептидных цепей в полость ЭР. После выполнения этой функции сигнальный пептид сразу же отщепляется. Синтезированная молекула проколлагена содержит дополнительные участки - N- и С-концевые пропептиды, имеющие около 100 и 250 аминокислот, соответственно. В состав пропептидов входят остатки цистеина, которые образуют внутри- и межцепочечные (только в С-пептидах) S-S-связи. Концевые пропептиды не образуют тройную спираль, а формируют глобулярные домены. Отсутствие N- и С- 688 Таблица 15-1. Распределение коллагена в тканях и органах
концевых пептидов в структуре проколлагена нарушает правильное формирование тройной спирали. Посттрансляционные модификации коллагена Гидрокслирование пролина и лизина. Роль витамина С Гидроксилирование пролина и лизина начинается в период трансляции коллагеновой мРНК на рибосомах и продолжается на растущей полипептидной цепи вплоть до её отделения от рибосом. После образования тройной спирали дальнейшее гидроксилирование пролиловых и лизиловых остатков прекращается. Реакции гидроксилирования катализируют ок-сигеназы, связанные с мембранами микросом. Пролиловые и лизиловые остатки в Y-положении пептида (Гли-х-у)n подвергаются действию, соответственно, пролил-4-гидроксилазы и лизил-5-гидроксилазы. Пролил-3-гидроксилаза действует на некоторые остатки пролина в Х-положениях. Необходимыми компонентами этой реакции являются оскетоглутарат, О2 и витамин С (аскорбиновая кислота). Донором атома кислорода, который присоединяется к С-4 пролина, является молекула О2, второй атом О2 включается в сукцинат, который образуется при декарбоксилировании α-кетоглутарата, а из карбоксильной группы а-кетоглутарата образуется СО2 (см. схему А на с. 691). Гидроксилазы пролина и лизина содержат в активном центре атом железа Fe2+. Для сохранения атома железа в ферроформе необходим восстанавливающий агент. Роль этого агента выполняет кофермент гидроксилаз - аскорбиновая кислота, которая легко окисляется в дегидроаскорбиновую кислоту. Обратное превращение происходит в ферментативном процессе за счёт восстановленного глутатиона (см. схему Б на с. 691). 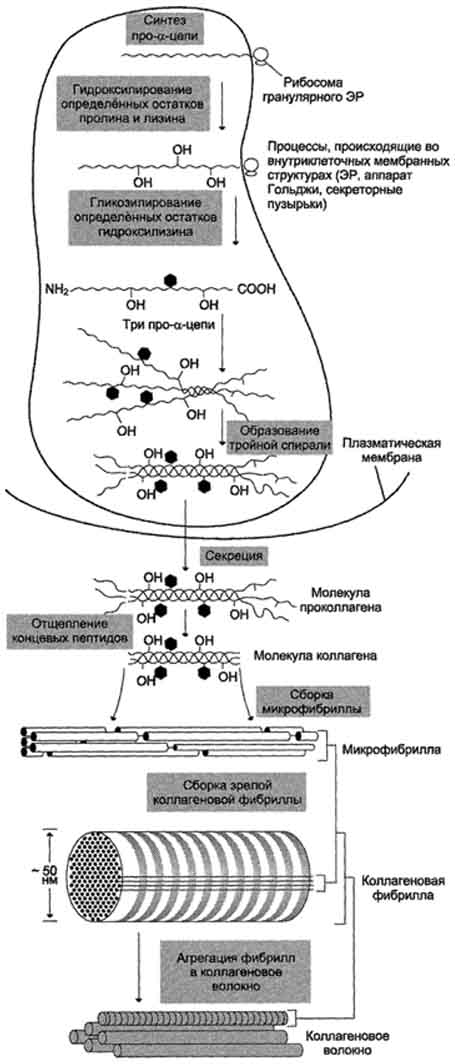 Рис. 15-1. Синтез и созревание коллагена. 690 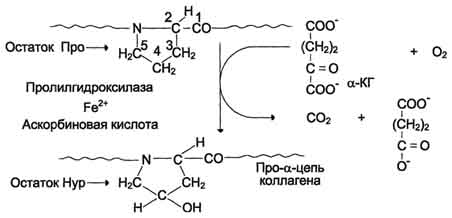 Схема А 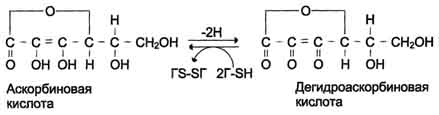 Схема Б Гидроксилирование пролина необходимо для стабилизации тройной спирали коллагена, ОН-группы гидроксипролина (Hyp) участвуют в образовании водородных связей. А гидроксилирование лизина очень важно для последующего образования ковалентных связей между молекулами коллагена при сборке коллагеновых фибрилл. При цинге - заболевании, вызванном недостатком витамина С, нарушается гидроксилирование остатков пролина и лизина. В результате этого образуются менее прочные и стабильные коллагеновые волокна, что приводит к большой хрупкости и ломкости кровеносных сосудов с развитием цинги. Клиническая картина цинги характеризуется возникновением множественных точечных кровоизлияний под кожу и слизистые оболочки, кровоточивостью дёсен, выпадением зубов, анемией. Гликозилирование гидроксилизина После завершения гидроксилирования при участии специфических гликозилтрансфераз в состав молекулы проколлагена вводятся углеводные группы. Чаще всего этими углеводами служат галактоза или дисахарид галактозилглюкоза (рис. 15-2). Они образуют ковалентную О-гликозидную связь с 5-ОН-группой гидроксилизина. Гликозилирование гидроксилизина происходит в коллагене, ещё не претерпевшем спирализации, и завершается после образования тройной спирали. Число углеводных единиц в молекуле коллагена зависит от вида ткани. Так, например, в коллагене сухожилий (тип I) это число равно 6, а в коллагене капсулы хрусталика (тип IV) - НО. Роль этих углеводных групп неясна; известно только, что при наследственном заболевании, причиной которого является дефицит лизилгидроксилазы (синдром Элерса - Данло-Русакова, тип VI), содержание гидроксилизина и углеводов в образующемся коллагене снижено; возможно, это является причиной ухудшения механических свойств кожи и связок у людей с этим заболеванием. Образование проколлагена и его секреция в межклеточное пространство После гидроксилирования и гликозилирования каждая про-α-цепь соединяется водородными связями с двумя другими про-α-цепями, образуя тройную спираль проколлагена. Эти процессы происходят ещё в просвете ЭР и начинаются 691 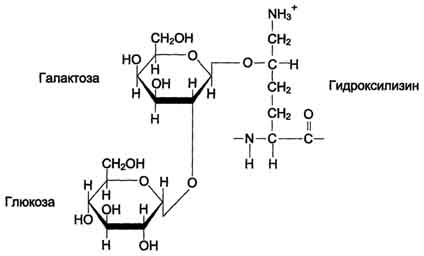 Рис. 15-2. Углеводные компоненты коллагена. после образования межцепочечных дисульфидных мостиков в области С-концевых пропептидов. Из ЭР молекулы проколлагена перемещаются в аппарат Гольджи, включаются в секреторные пузырьки и секретируются в межклеточное пространство. Образование тропоколлагена. Болезни, связанные с нарушениями этого процесса В межклеточном матриксе концевые пропептиды коллагенов I, II и III типов отщепляются специфическими проколлагенпептидазами, в результате чего образуются молекулы тропоколлагена, которые и являются структурной единицей коллагеновых фибрилл. При снижении активности этих ферментов (синдром Элерса - Данло - Русакова, тип VII) концевые пропептиды проколлагена не отщепляются, вследствие чего нарушается образование тропоколлагена и далее нарушается образование нормальных коллагеновых фибрилл. Нити коллагена видны под микроскопом в виде дезорганизованных пучков. Клинически это проявляется малым ростом, искривлением позвоночника, привычными вывихами суставов, высокой растяжимостью кожи. У коллагенов некоторых типов (IV, VIII, X) концевые пропептиды не отщепляются. Это связано с тем, что такие коллагены образуют не фибриллы, а сетеподобные структуры, в формировании которых важную роль играют концевые N- и С-пептиды. 100. Структурная организация межклеточного матрикса. Адгезивные белки межклеточного матрикса: фибронектин и ламинин, их строение и функции. Строение и функции гликозаминогликанов (гиалуроновой кислоты, хондроитинсульфатов, гепарина). Структура протеогликанов. Как уже говорилось, межклеточный матрикс представляет собой супрамолекулярный комплекс, образованный сложной сетью связанных между собой макромолекул. В организме человека межклеточный матрикс формирует такие высокоспециализированные структуры, как хрящ, сухожилия, базальные мембраны, а также (при вторичном отложении фосфата кальция) кости и зубы. Эти структуры различаются между собой как по молекулярному составу, так и по способам организации основных компонентов (белков и полисахаридов) в различных формах межклеточного матрикса. |
