биодоступность. Биологическая доступность почти готово. Биологическая доступность это скорость и степень, с которой лекарственный
 Скачать 178.04 Kb. Скачать 178.04 Kb.
|
|
Биологическая доступность – это скорость и степень, с которой лекарственный препарат или фармакологически активное соединение всасывается из места введе- ния в системный кровоток и становится доступным в месте биологического дейст- вия. Эта формулировка позволяет объединить определение биодоступности, данное Food and Drug Administration – FDA (США) и определение, предложенное американским фармацевтическим обществом. Согласно последней формулировке биодоступность - это степень и скорость, с какими активный ингредиент всасывается из лекарственного препарата и достигает системной циркуляции. При этом не упоминается о дальнейшей судьбе активного начала или его «активного метаболита». Согласно определению, предложенному Американским фармацевтическим обществом, оценка биодоступности осуществляется на основании данных о содержании активного начала в крови и его выведении из организма. Необходимо подчеркнуть, что время появления неизмененного лекарственного средства или его активного метаболита в крови может в значительной степени отличаться от времени его регистрации в месте действия. В то же время количественно оценить биодоступность большинства лекарственных веществ можно лишь путем определения их концентрации в крови или экскреции с мочой, поскольку определение концентрации в месте (местах) действия технически, как правило, неосуществимо. В литературе различают два вида биологической доступности – абсолютная и относительная, или биоэквивалентность. Абсолютная биодоступность определяется сравнением скорости и степени всасывания исследуемого препарата после его вне- системного введения, с одной стороны, и стандарта после внутрисистемного введе- ния – с другой. Относительная биодоступность, или биоэквивалентность определя- ется сравнением скорости и степени всасывания исследуемого препарата и скорости всасывании так называемого «стандарта» при одном и том же пути введения. Абсолютную и относительную биодоступность у человека чаще исследуют на здоровых людях для проведения чистого опыта и получения достоверных результатов. В настоящее время известно, что интенсивность и продолжительность фармакологического ответа являются не только собственной функцией лекарственного препарата. Эти показатели зависят от характеристик его всасывания, распределения, метаболизма и выведения. Основываясь на приведенном выше определении биодоступности, можно отметить, что все перечисленные характеристики неразрывно связаны с понятием биологической доступности. Скорость и степень всасывания лекарственного вещества – это прямые характеристики биодоступности. Распределение препарата определяет его проницаемость через различные барьеры и доставку к месту его действия. Скорость и интенсивность биотрансформации лекарственного вещества определяют «эффект его первопрохождения через печень» при внесосудистом введении. Биодоступность препарата находится в прямой зависимости от этого показателя, а также от скорости элиминации неизмененного вещества или его активных метаболитов. Биодоступность и биоэквивалентность лекарственных средствВ клинической практике уже давно отмечено, что препараты, содержащие одни и те же лекарственные вещества, но выпускаемые различными фармацевтическими фирмами, существенно различаются как по терапевтической эффективности, так и по частоте возникновения и выраженности побочных эффектов. Оказалось, что в большинстве случаев терапевтическая неэквивалентность препаратов, содержащих одни и те же лекарственные вещества, зависит от различий в их биологической доступности. В связи с этим возникло новое понятие – биоэквивалентность. Лекарственные препараты называют биоэквивалентными в тех случаях, когда они обеспечивают одинаковую концентрацию действующего вещества в крови и тканях организма. При изучении биоэквивалентных лекарственных препаратов наиболее значимы следующие параметры (табл. 1): максимум, или пик концентрации лекарственного вещества в крови; (Сmax) время достижения максимальной концентрации; (Tmax) площадь под кривой изменения концентрации вещества в плазме или сыворотке во времени (AUC). Сmax разных лекарственных форм должны показывать близкие значения и не должны выходить за пределы коридора минимальной эффективной (МЭК) и мини- мальной токсической (МТК) концентраций, то есть МЭК Сmax МТК. Тmax отражает скорость всасывания и скорость наступления терапевтического эф- фекта. AUC отражает количество лекарственного вещества, поступившего в кровь после однократного введения препарата и позволяет сравнивать лекарственные пре- параты (или лекарственные формы). Если AUC существенно не отличаются, значит сравниваемые препараты обеспечивают поступление в кровоток одинакового количества лекарственного вещества. Показатели, определяющие биоэквивалентность двух лекарственных форм препарата
Первоначально критерием степени всасывания лекарственного вещества был взят относительный уровень в крови, создающийся при введении вещества в изу- чаемой и стандартной форме. Сравнивали, как правило максимальные концентрации лекарственного вещества. Однако, такой подход к оценке всасывания является не- адекватным. Это побудило исследователей характеризовать степень всасывания не отдельными точками, а фармакокинетической кривой в целом, то есть зависимость концентрации лекарственного вещества в биологических жидкостях от времени. 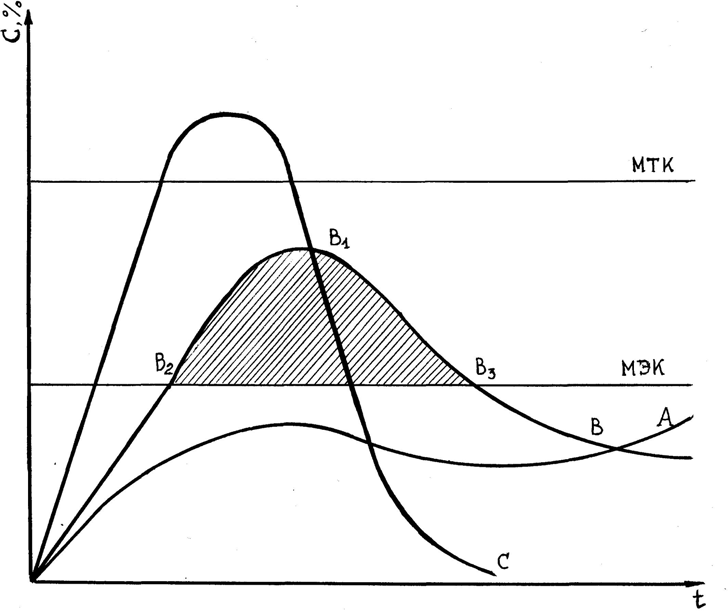 Рис. 5. Кривые фармакокинетики лекарственного вещества после введения его в лекарственных формах А, В и С. Биологическая доступность (БД) лекарственных веществ – это степень, с ко- торой оно всасывается из места введения в системный кровоток и скорость, с кото- рой этот процесс происходит. В этом определении нашли свое отражение интегральный (степень всасывания) и кинетический (скорость всасывания) аспекты оценки биодоступности. А так как интегральное представление о кривой можно по- лучить, измеряя площадь, ограниченную этой кривой с осью абсцисс, то и было предложено характеризовать степень всасывания лекарственного вещества величиной площади под соответствующей фармакокинетической кривой (AUC – area under curve). Методы определения биодоступности. Понятие об абсолютной и относительной биодоступностиСуществует два основных метода определения биодоступности: фармакокинетическийи фармакодинамический. Первый метод основан на измерении зависимости между концентрацией и временем или скоростью выделения лекарственного вещества с мочой после назначения одной или повторных доз. Второй сводится к измерениям фармакодинамических или биохимических ре- акций на лекарственное вещество и его активные метаболиты. Фармакодинамический метод является более сложным, поэтому определения чаще проводятся с помощью фармакокинетического метода, который позволяет установить, какое время и в какой концентрации лекарство находится в организме. Исследования биодоступности проводятся в виде сравнительных экспериментов, в которых исследуемой лекарство сравнивается со стандартной лекарственной формой того же лекарственного вещества. При этом используются одинаковые дозы стандартного и исследуемого лекарственного препарата. В качестве стандартной лекарственной формы при определении “абсолютной “биодоступности применяется раствор для внутривенного введения. Внутривенная инъекция дает наиболее четкие результаты, так как вся доза поступает в большой круг кровообращения, и биодотупность препарата в этом случае является наиболее полной, практически стопроцентной. Однако, более распространено, определение относительной биодоступности. При этом стандартной лекарственной формой, как правило, служит раствор для внутреннего применения и лишь в случаях, когда препарат не растворим или неус- тойчив в водном растворе, может использоваться другая лекарственная форма для приема внутрь, например, суспензия микронизированного препарата или микрони- зированный препарат в желатиновых капсулах. При фармакокинетическом методе определения биодоступности производят последовательно забор проб биологических жидкостей в течение определенного пе- риода времени и определяют в них концентрацию препарата. Эту зависимость “кон- центрация – время” отражают графически в виде кривой, которую называют фарма- кокинетической (рис. 5) Количественная оценка биодоступности (БД) должна включать две величины: степень биодоступности и скорость всасывания. Рис. 6 дает представление об основных процессах массопередачи при всасыва- нии ЛВ и позволяет математически определить параметры, характеризующие БД. После внесосудистого введения лекарственного вещества в той или иной ле- карственой форме доза (D) оказывается в организме в некотором депо (в желудочно- кишечном тракте при энтеральном введении, в мышечном депо при внутримышеч- ном введении), откуда постепенно поступает в системный кровоток.   Количество всосавшегося ЛВ за время t, Aa (t) ЛВ в месте всасывания Скорость всасывания a (t)   скорость элиминации e (t) скорость элиминации e (t)Потери ЛВ  Количество элиминировавшего ЛВ за время t, Ae (t) Рис. 6. Обобщенная схема, иллюстрирующая основные процессы при всасыва- нии лекарственного вещества. |
