Ацилирование. Федеральное агентство по образованию
 Скачать 1.37 Mb. Скачать 1.37 Mb.
|
|
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ Государственное образовательное учреждение высшего профессионального образования «Самарский государственный технический университет» _______________________________________________________________________________________________ М. Ю. СКОМОРОХОВ, А. К. ШИРЯЕВ, Ю. Н. КЛИМОЧКИНАЦИЛИРОВАНИЕМетодическое пособие Самара 2005 ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ Реакции ацилирования органических соединений являются важнейшими методами современной синтетической органической химии. При помощи этих реакций могут быть синтезированы различные типы органических соединений, например, сложные эфиры, первичные, вторичные и третичные амиды карбоновых кислот, алифатические и ароматические кетоны, карбоциклические системы и многие другие органические соединения. Ацилированием в органическом синтезе называют реакции введения ацильной группы (RCO-) в молекулы органических соединений путем замещения атома водорода. В более широком смысле ацилированием называют замещение любого атома или группы атомов на ацильную группу. В зависимости от типа атома, к которому присоединяется ацильная группа, различают С-ацилирование, N-ацилирование, О-ацилирование. Реакции, при которых вводится ацетильная группа (СН3СО-), называются ацетилированием, бензоильная группа (С6Н5СО-) – бензоилированием и т.д. Наиболее распространенные ацилирующие агенты - хлорангидриды и ангидриды карбоновых кислот (табл. 1, 2). Таблица 1. Основные производные насыщенных карбоновых кислот
Таблица 2. Основные производные ненасыщенных и ароматических карбоновых кислот
1. МЕТОДЫ ПОЛУЧЕНИЯ СЛОЖНЫХ ЭФИРОВ КАРБОНОВЫХ КИСЛОТ (О-ацилирование) Спирты могут реагировать с образованием сложных эфиров не только с карбоновыми кислотами, но и с некоторыми функциональными производными кислот: хлорангидридами, ангидридами, сложными эфирами (RCOZ).
большей скоростью протекает реакция ацилирования спиртов. По способности ацилировать спирты и фенолы производные кислот можно расположить в следующий ряд:  1.1. Реакции этерификации карбоновых кислот Реакцией этерификации называется взаимодействие спиртов с карбоновыми кислотами, приводящее к образованию сложных эфиров (алкоголиз карбоновых кислот). В этой реакции молекула спирта выступает в роли нуклеофильного агента, атакующего электронодефицитный атом углерода карбонильной группы. 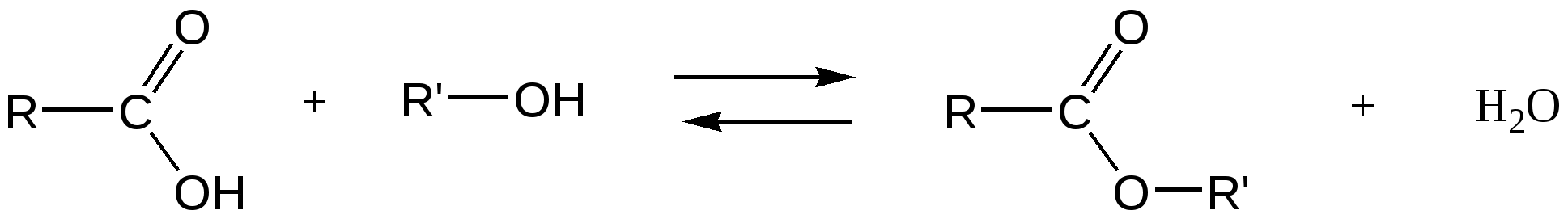 R = алкил, арил, гетерил; R’ = алкил Реакция этерификации обратима и, следовательно, ограничена состоянием равновесия (обратная реакция называется гидролизом сложного эфира). Превращение эквимолярных количеств кислоты и спирта в теоретически вычисленное количество сложного эфира невозможно. В результате реакции образуется некоторое максимальное количество сложного эфира (которое всегда ниже теоретически вычисленного), и остаются не вступившие в реакцию кислота и спирт. По мере того, как кислота и спирт реагируют друг с другом и происходит накопление продуктов их взаимодействия (сложного эфира и воды), скорость обратной реакции, вначале незначительная, возрастает; при этом скорость прямой реакции постепенно уменьшается. Наконец, наступает динамическое равновесие, когда в единицу времени в сложный эфир превращается столько молекул кислоты и спирта, сколько молекул сложного эфира распадается на кислоту и спирт. Постоянный состав смеси обусловлен одинаковыми скоростями этих двух противоположных процессов. Реакция этерификации протекает очень медленно. Основная причина заключается в том, что на атакуемом атоме углерода карбоксильной группы происходит уменьшение частичного положительного заряда вследствие влияния положительного мезомерного эффекта гидроксильной группы.  Для быстрейшего достижения равновесия реакцию этерификации проводят в присутствии катализаторов: минеральных кислот (серной или фосфорной кислот), сухого газообразного хлористого водорода, арилсульфокислот (например, п-толуолсульфокислоты, 4-СН3С6Н4SO3H), которые протонируют атом кислорода карбоксильной группы и тем самым увеличивают частичный положительный заряд (+) на атакуемом атоме углерода. Если при проведении реакции нежелательно присутствие кислот в реакционной смеси, то в качестве катализаторов используют ионообменные смолы (катиониты КУ-2, КУ-23). Следует иметь в виду, что катализаторы повышают скорость реакции этерификации, но не влияют на равновесие. Для изменения состояния равновесия и повышения выхода сложных эфиров (т.е. смещения равновесия вправо) применяют следующие способы:
 т.кип. 1180С т.кип. 780С т.кип. 770С При получении высококипящих сложных эфиров удобнее отгонять воду в процессе реакции. Вода в этом случае отгоняется в виде азеотропной смеси с парами соответствующего спирта. 

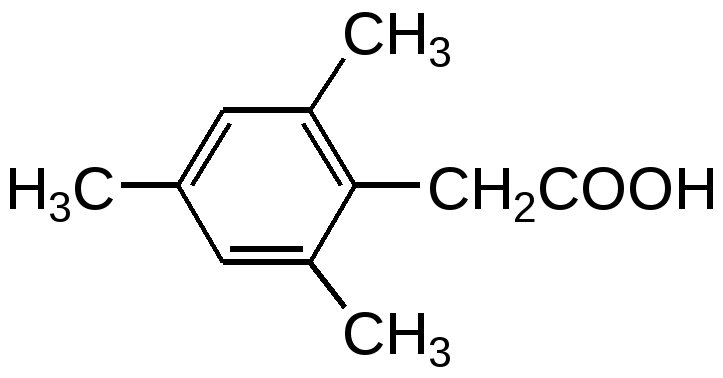
Использование метода «меченых атомов» дало возможность решить вопрос о месте разрыва связей при реакции этерификации. Оказалось, что обычно молекула воды образуется из НО-группы кислоты и атома водорода спирта. Следовательно, в молекуле кислоты разрывается связь С-О между ацильной группой и гидроксилом, а в молекуле спирта - связь Н-О в гидроксильной группе. Именно такой вывод следует из взаимодействия бензойной кислоты с метанолом, содержащим тяжелый изотоп кислорода 18О. Получаемый сложный эфир содержал в своём составе указанный изотоп кислорода.  Наиболее медленная стадия всего процесса - бимолекулярное взаимодействие протонированной кислоты с молекулой спирта (стадия 2), поэтому скорость реакции в первую очередь определяется величиной частичного положительного заряда на атакуемом атоме углерода карбонильной группы. Величина + на углероде этой группы зависит от характера радикала R в молекуле карбоновой кислоты. Более сильные карбоновые кислоты проявляют большую реакционную способность: электронодонорные группы, связанные с карбоксильным атомом углерода, понижают частичный положительный заряд (по сравнению с зарядом в муравьиной кислоте) и тем самым препятствуют взаимодействию кислоты с нуклеофилом - молекулой спирта:  электроноакцепторные заместители, напротив, делают кислоту более реакционноспособной:  Достаточно сильные кислоты, такие, как муравьиная, трифторуксусная и щавелевая, быстро реагируют со спиртами даже без добавок минеральной кислоты в качестве катализатора. Ароматические кислоты, особенно содержащие в ароматическом кольце электронодонорные заместители, взаимодействуют со спиртами значительно труднее и требуют больших количеств катализатора. Существенную роль в реакции этерификации играют стерические (пространственные) эффекты, так как атом углерода карбонильной группы кислоты в интермедиате II переходит из плоской тригональной структуры (sp2 -гибридизация) в тетраэдрическую структуру (sp3 - гибридизация). С увеличением объёма связанных с карбоксилом углеводородных радикалов (R) и с повышением объёма радикала в спирте (R") скорость этерификации уменьшается. Например, пивалевая кислота (2,2-диметилпропановая кислота) образует сложные эфиры с большим трудом вследствие того, что метильные группы затрудняют нуклеофильную атаку спирта на атом углерода карбонильной группы. По этим же причинам 2,4,6-триметилбензойная кислота (β-изодуриловая кислота) в обычных условиях с трудом образует сложные эфиры, в то время как 2,4,6-триметилфенилуксусная кислота (мезитилуксусная кислота) даёт сложные эфиры с хорошим выходом:
Для прямой этерификации пространственно-затрудненных кислот используют метод, заключающийся в растворении карбоновой кислоты в 100%-ной серной кислоте с последующей обработкой раствора спиртом. При растворении кислот такого типа в безводной серной кислоте образуется ацилий-катион, который и участвует в реакции:  Аналогичные пространственные затруднения оказывают и алкильные группы, находящиеся рядом с гидроксильной группой в спиртах. По этой причине первичные спирты при прочих равных условиях образуют сложные эфиры легче, чем вторичные и, тем более, чем третичные спирты, и по реакционной способности спирты можно расположить в следующий ряд:  При проведении этерификации третичными спиртами следует также учитывать возможность изменения механизма реакции и протекания конкурирующей реакции элиминирования с образованием алкенов:  В лабораторной практике для получения сложных эфиров реакцией прямой этерификации используют следующие методики. |