Краткая теория. Краткая теория для подготовки к экзамену. (Более подробно можно посмотреть из раздела эиос в лекционном блоке)
 Скачать 1.47 Mb. Скачать 1.47 Mb.
|
|
Краткая теория для подготовки к экзамену. (Более подробно можно посмотреть из раздела ЭИОС в лекционном блоке)
Лабораторная посуда и её назначение (см. тетрадь) Термодинамические системы бывают: изолированные – не обмениваются с окружающей средой ни веществом, ни энергией открытые – обмениваются с окружающей средой веществом и энергией закрытые – обмениваются с окружающей средой только энергией. гомогенная – система, внутри которой нет поверхности раздела и не различающаяся по свойствам в любой её точке. гетерогенная – система, внутри которой есть поверхность раздела. Термодинамические параметры: Энтальпия(Н) – термодинамическая функция, характеризующая общее энергосодержание системы. Стандартная энтальпия образования простого вещества равна нулю. Энтропия(S) – термодинамическая функция, характеризующая меру неупорядоченности системы. Энергия Гиббса(G) – термодинамическая функция, учитывающая энтальпийный и энтропийный факторы. Термодинамический процесс: изотермический (постоянная температура) изохорный (постоянный объем) изобарный (постоянное давление) адиабатический (без теплообмена с окружающей средой) I закон термодинамики Известен как закон сохранения энергии В любом процессе тепло, поглощенное системой, идет на изменение внутренней энергии и на совершение работы. I закон термодинамики определяет взаимосвязь теплоты, внутренней энергии и работы: Q = U + A При различных условиях I закон термодинамики выражается уравнениями: QV = U Qp = H Qp = U + рV II закон термодинамики. теплота не может самопроизвольно переходить от холодного тела к горячему энтропия изолированной системы возрастает в необратимом процессе и остается неизменной в обратимом процессе. Изменение энтропии в изолированной системе для необратимых процессов: Sо> 0 При G< 0 – процесс возможен при любых температурах При G> 0 – процесс невозможен при любых температурах При G = 0 – состояние равновесие Закон Гесса. Основным законом термохимии является закон Гесса. Тепловой эффект химической реакции зависит только от начального и конечного состояния реагирующих веществ и не зависит от пути, по которому протекает реакция. Экзотермический процесс – процесс с выделением тепла (H< 0) Эндотермический процесс – процесс с поглощением тепла (H> 0) Принцип энергетического сопряжения. Принцип энергетического сопряжения биохимических реакций заключается в том, что: эндэргонические реакции сопряжены с экзэргоническими реакциями сопряжение эндэргонических реакций с экзэргоническими реакциями возможно, если обе реакции имеют общее промежуточное соединение суммарный процесс на всех стадиях сопряженных реакций характеризуется отрицательным значением энергии Гиббса (G<0) Скорость химических реакций. Под скоростью химической реакции понимают изменение концентрации одного из реагирующих веществ в единицу времени. Факторы, влияющие на скорость реакции: Природа реагирующих веществ Концентрация реагирующих веществ Температура Катализатор При увеличении концентрации скорость увеличивается. Закон действующих масс. При постоянной температуре скорость простой гомогенной реакции прямопропорциональна произведению концентраций реагирующих веществ в степенях, численно равных порядку по реагенту. Кинетическое уравнение реакции А + В С: = kc(A)c(B) Кинетическое уравнение горения угля C(т) +CO2(г) = 2СО: = kcO2 Молекулярность реакции. Порядок реакции. Константа скорости. Экспериментально установлено, что кинетическое уравнение для реакции: 2NO(г) + O2(г) 2NO2(г)имеет вид = kc2(NO)c(O2), следовательно реакция является простой молекулярность равна 3 суммарный порядок равен 3 частный порядок по оксиду азота(II) равен 2 Для реакции 2СО(г) + О2(г)⇄ 2СО2(г), протекающей в одну стадию: общий порядок прямой реакции равен 3 (= kc2СОcO2) общий порядок обратной реакции равен 2 (= kc2СO2) частный порядок по кислороду равен 1 (= kc2СОcO2) Правило Вант-Гоффа При повышении температуры на каждые 10 К скорость большинства реакций увеличивается в 2-4 раза. Т2 = Т1 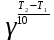 , где , где Т2 и Т1– скорости реакции соответственно при начальной Т1 и конечной Т2 температурах – температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры реагирующих веществ на 10 К. Химическое равновесие. Константа равновесия. Химическое равновесие – это состояние системы, при котором в обратимой реакции скорость прямой реакции равна скорости обратной реакции. Константа химического равновесия зависит от природы реагирующих веществ и температуры. Константа химического равновесия для реакции A + B⇄С + Д определяется по формуле 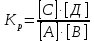 Принцип Ле-Шателье. Смещение равновесия. Если на систему, находящуюся в состоянии равновесия, оказывать действие извне (изменить Т, р, с), то равновесие сместится в сторону, ослабляющую это воздействие. При повышении температуры равновесие смещается в сторону эндотермической реакции (H>0), при уменьшении температуры равновесие смещается в сторону экзотермической реакции (H< 0). При увеличении давления равновесие сместится в сторону меньшего моль газов. При уменьшении давления равновесие сместится в сторону большего моль газов. При увеличении концентрации исходных веществ равновесие сместится в сторону продуктов. При уменьшении концентрации исходных веществ равновесие сместится в сторону исходных веществ. При увеличении концентрации продуктов реакции равновесие сместится в сторону исходных веществ. При уменьшении концентрации продуктов реакции равновесие сместится в сторону продуктов реакции. Для реакции: С(т) + СО2(г)⇄ 2СО, Н < 0 смещение химического равновесия вправо будет при понижении температуры, увеличении концентрации углекислого газа, уменьшении концентрации угарного газа, измельчении угля, понижении давления смещение химического равновесия влево будет при повышении температуры, увеличении концентрации угарного газа, уменьшении концентрации углекислого газа, увеличении давления на смещение химического равновесия не влияет увеличение концентрации угля и введение катализатора Равновесие реакции 2H2S(г) + SО2(г)⇄ 3S(т) + 2Н2О(ж), Н < 0 сместится вправо при понижении температуры повышении давления увеличении концентрации сероводорода увеличении концентрации SО2 уменьшении концентрации воды Для реакции: Н2(г) + J2(г)⇄ 2HJ(г), Н < 0 смещение химического равновесия вправо будет при понижении температуры, увеличении концентрации водорода, увеличении концентрации иода, уменьшении концентрации иодоводорода смещение химического равновесия влево будет при повышении температуры, увеличении концентрации иодоводорода, уменьшении концентрации водорода, уменьшении концентрации иода на смещение химического равновесия не влияет увеличение давления, уменьшение давления и введение катализатора Катализ и катализаторы. Явление «катализ» верно характеризуют утверждения: Отрицательный катализ протекает в присутствии ингибиторов В гетерогенном катализе катализатор и реагирующие вещества образуют систему из различных фаз Это явление изменения скорости реакции под воздействием небольших добавок катализаторов. В положительном катализе катализатор увеличивает скорость реакции, потому что процесс идет по более энергетически выгодному пути. Катализаторы – это специфические вещества, которые изменяют скорость химической реакции. Он в результате реакции не расходуется и выделяется в первоначальном виде. Действие ферментов в биологических и химических процессах в организме верно характеризуют утверждения: ферменты ускоряют реакции в 104 – 105 раз наибольшую активность большинство ферментов проявляют при рН = 7 ферменты обладают высокой специфичностью действия ферменты проявляют свою активность в температурном интервале 10 – 45С Фермент – это биологический катализатор. Активация – это усиление действия ферментов Ингибирование – замедление действия биокатализаторов Энергия активации. Энергия активации – это энергия, которую надо сообщить молекулам реагирующих веществ, чтобы превратить их в активные. Энергия активации – это энергия, которой должны обладать молекулы для эффективного столкновения. Энергия активации – это своеобразный энергетический барьер, который отделяет исходные вещества от конечных. Осмос. Осмотическое давление. Закон Вант-Гоффа. Онкотическое давление. Значение осмотических явлений в биологии и медицине. Осмос – это односторонняя диффузия молекул растворителя через полупроницаемую мембрану из раствора с меньшей концентрацией в раствор с большей концентрацией. Осмос возникает вследствие более низкого давления пара над раствором, чем над чистым растворителем, или разности давлений над растворами разных концентраций. Осмотическое давление – сила, вызывающая осмос, отнесенная к единице поверхности мембраны. Росм =cRT103Па (закон Вант-Гоффа) Онкотическое давление – это часть осмотического давления, обусловленного белками. Животные и растительные клетки отделены от окружающей среды мембраной. При помещении клетки в различные по концентрациям или давлениям растворы будут наблюдаться следующие явления: плазмолиз – уменьшение клетки в объеме. При этом клетку помещают в гипертонический раствор (раствор с бóльшим осмотическим давлением, чем осмотическое давление внутриклеточной жидкости) гемолиз (лизис) – увеличение клетки в объеме. При этом клетку помещают в гипотонический раствор (раствор с меньшим осмотическим давлением, чем осмотическое давление внутриклеточной жидкости) изоосмия – объем клетки не изменяется. При этом клетку помещают в изотонический раствор (осмотическое давлении растворов внутри клетки и снаружи одинаково). С помощью осмотических явлений поддерживается водно-солевой обмен в организме человека. Осмос – это основа механизма работы почек. Изотонический (физиологический) раствор NaCl (0,9%) используется при больших кровопотерях. Гипертонический раствор NaCl (10%) используют при накладывании марлевых повязок на гнойные раны. Изотонические растворы: 0,9% NaCl, 5% глюкоза, желчь Основные положения и понятия протолитической теории кислот и оснований. Протолиты. Кислота – это молекула или ион, способные отдавать протон (донор протонов). Основание – это молекула или ион, способные присоединять протон (акцептор протонов). Кислота и соответствующее ей сопряженное основание, а также основание и сопряжённая кислота образуют протолитическиепары (сопряжённые кислотно-основные пары). _________________________________________________________________ Н  аписать уравнение кислотной ионизации ортофосфорной кислоты в воде. аписать уравнение кислотной ионизации ортофосфорной кислоты в воде.Сопряжённые пары: Н3РО4 / Н2РО4– Н2О / Н3О+ _______________________________________________________________ Автопротолиз воды. Ионное произведение воды. Водородный показатель (рН) как количественная мера кислотности и щёлочности. Амфолиты – протолиты, обладающие как протонодонорными, так и протоноакцепторными свойствами. Например: вода, жидкий аммиак, спирты, карбоновые кислоты, анионы кислот (HSO4–, HCO3–, H2РO4–) Характерной реакцией амфолитов является реакция кислотно-основного диспропорционирования или автопротолиза (самоионизации). 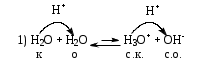 Сопряженные пары: Н2О – ОН– Н2О – Н3О+ Кw = [H+][OH –] = 10 – 14 В химически чистой воде [H+] = [OH –]. Это нейтральная среда. В растворе может быть [H+] > [OH –] – среда кислая или [H+] < [OH –] – среда щелочная Водородный показатель рН как количественная мера кислотности и основности растворов. Для количественного выражения кислотности или основности растворов используют показатель концентрации ионов водорода рН. рН = – lg [H+] Это величина отрицательного десятичного логарифма концентрации ионов водорода. Его значения для разных сред лежат в интервале 1-14  рН + рОН = 14 рН = 14 – рОН и рОН = 14 – рН рН – это водородный показатель, показатель кислотности среды, показатель концентрации ионов водорода в растворе. Водородный – это отрицательный десятичный логарифм концентрации свободных ионов водорода в растворе. рН = – lg[H+]. Изменяется от 0 до 14. рН = 7 – среда нейтральная ([H+] = [ОН]) рН > 7 – среда щелочная (избыток ионов ОH) рН < 7 – среда кислая (избыток ионов H+) рН + рОН = 14 ____________________________________________________________ Рассчитать рН раствора NaOHcC(NaOH) = 0,02 моль/л Решение: Поскольку NaOH относится к сильным электролитам, то (NaOHNa+ + ОН – )концентрация ионов ОН – будет равна концентрации NaOH, следовательно, запишем: рОН = – lg [ОН – ]; рОН = – lg 0,02 = 1,699 рН = 14 – рОН = 14 – 1,699 = 12,301 Ответ: рН = 12,301 _____________________________________________________________ рН желчи 6,9. Рассчитать [ОН – ] Решение: Используя логарифмическую форму ионного произведения воды рН + рОН = 14., выразим рОН: рОН = 14 – рН; рОН = 14 – 6,9 = 7,1 [ОН – ] = 10 – 7,1 = 7,9 10 – 8 моль/л Ответ: [ОН – ] = 7,9 10 – 8 моль/л _____________________________________________________________ Буферные системы. Буферные системы – системы, обладающие буферным действием. Буферное действие – способность раствора поддерживать практически постоянное значение рН при добавлении небольших количеств сильной кислоты или сильного основания или при разбавлении. Механизм буферного действия: 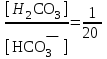 H2CO3+ ОН–⇄HCO3– + H2О HCO3–+ Н+H2CO3– ПК – потенциальная кислотность (концентрация недиссоциированных молекул кислоты) АК – активная кислотность (рассчитывается по формуле АК = [H+], концентрация свободных ионов водорода) ОК – общая кислотность (ОК = АК + ПК) Зона буферного действия – интервал рН работы буферного раствора.рН = рК 1 NaH2PO4 / Na2HPO4 КД = 6,3108 рК = 7,2 Зона буферного действия: рН = 7,2 1 = 6,2 8,2 Характеристики буферных систем: Буферная ёмкость – это мера буферного действия. Зависит от концентрации и соотношения компонентов буферной системы. Для максимальной буферной ёмкости должны быть большие концентрации компонентов и соотношение компонентов равное 1. Различают буферную ёмкость по кислоте и по щёлочи. Буферная ёмкость по кислоте – это количество моль-эквивалентов сильной кислоты, которое необходимо добавить к 1 л буферного раствора, чтобы изменить рН на единицу. 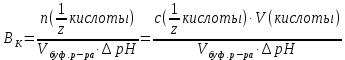 [моль/л] или [моль/л] [моль/л] или [моль/л]Буферная ёмкость по щёлочи – это количество моль-эквивалентов щёлочи, которое необходимо добавить к 1 л буферного раствора, чтобы изменить рН на единицу. 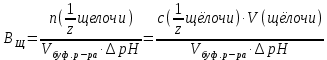 [моль/л] или [моль/л] [моль/л] или [моль/л]Ацидоз – повышенное содержание ионов водорода или снижение значения рН. Алкалоз – повышенное содержание гидроксид ионов или повышение уровня рН. Буферные системы крови: гидрокарбонатная (H2CO3 / HCO3–) или бикарбонатная гидрофосфатная (NaH2PO4 / Na2HPO4) белковая гемоглобиновая (HHb / KHb) Оксигемоглобиновая и гемоглобиновая буферные системы. В эритроцитах, в зависимости от их места нахождения (ткани, легкие) существуют три сопряжённые пары:  – концентрации и соотношения которых определяют КЩР. Сила кислот: HHb | ||||||||||||||||||||||

 )
) 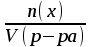 [моль/л]
[моль/л]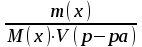
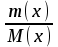 [моль] – количество вещества
[моль] – количество вещества (
(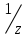 х) =
х) =  моль/л]
моль/л]
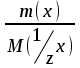 [моль] – количество эквивалента
[моль] – количество эквивалента ) Моляльная концентрация
) Моляльная концентрация [моль/кг]
[моль/кг]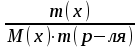
 ) Массовая доля
) Массовая доля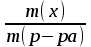 100%
100% ) Мольная доля или молярная доля
) Мольная доля или молярная доля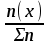
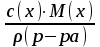 100%
100%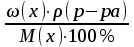
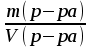 [г/см3 = г/мл = 1000 г/л] - плотность
[г/см3 = г/мл = 1000 г/л] - плотность