Сборник лекции. Химическая технология - лекция. Лекция Общие вопросы химической технологии. Лекции 2, Принципы создания ресурсосберегающих технологий
 Скачать 1.71 Mb. Скачать 1.71 Mb.
|
|
Химическая технология Лекция 1. Общие вопросы химической технологии. Лекции 2, 3. Принципы создания ресурсосберегающих технологий. Лекция 4. Химико-технологические системы. Их структура. Элементы ХТС.Типовые структуры ХТС. Исследование ХТС. Лекция 5. Химические реакторы. Лекция 6. Конструкции промышленных реакторов. Лекция 7. Идеальные химические реакторы. Лекции 8, 9. Применение кинетических моделей для выбора и оптимизации условий проведения химических процессов. Лекция 10. Влияние различных факторов на производительность процесса. Лекции 11, 12. Экономические критерии и их применение для оптимизации реакционного узла. Лекция 13. Важнейшие химические производства. Синтез аммиака. Лекция 14. Производство азотной кислоты. Лекции 15, 16. Производство серной кислоты. Лекция 17. Производство фосфорной кислоты. Лекции 18, 19. Производство минеральных удобрений. Лекция 20. Электрохимические производства. Основные направления применения электрохимических процессов. Электролиз раствора хлорида натрия. Теоретические основы процесса и технология. Лекция 21. Химическая переработка нефти. Лекция 22. Производство метанола. Лекция 23. Кумольный способ получения фенола. Общие вопросы химической технологии Химическая технология (ХТ) – прикладная наука о способах и процессах производства различных продуктов и материалов, осуществляемых с участием химических превращений на основе рационального (экономного) использования сырья и энергии. Своё название химическая технология берёт от трёх слов, химия, которая имеет свою этимологию, греческих «технос» - искусство, ремесло и «логос» - ученье, наука. Как наука ХТ имеет предмет изучения – химическое производство; цель изучения – создание целесообразного способа производства необходимых человеку продуктов; методы исследования – экспериментальный, моделирования, системный анализ. ХТ относится к естественным наукам поскольку имеет дело с материальными явлениями и объектами. Классификация процессов ХТ Процессы ХТ можно классифицировать по различным признакам: характеру используемых технологий, происхождению и характеру сырья, характеру и потребительским свойствам продуктов. Наиболее фундаментальным является отраслевой принцип классификации, определяющий принадлежность процессов к группам перерабатываемого сырья или потребительским свойствам производимых продуктов. В этом плане можно выделить следующие отрасли ХТ. 1. Неорганическая ХТ, включающая в себя следующие подотрасли: а) основной неорганический синтез, включающий в себя многотоннажные производства кислот, щелочей, солей, аммиака, минеральных удобрений на их основе и других неорганических веществ. б) тонкий неорганический синтез – малотоннажные производства, но крайне важных для самой химической промышленности неорганических веществ: катализаторов, неорганических препаратов, реактивов, редких элементов, материалов для электроники, лекарственных веществ и др. в) ядерно-химическая технология, включающая технологии обогащения и получения радиоактивных веществ и изотопов. г) металлургия – производства чёрных и цветных металлов. д) технология силикатов – производство вяжущих и строительных материалов, керамических изделий, стекла. 2. Технология органических веществ, включающая в себя следующие подотрасли: а) переработка ископаемого углеродсодержащего сырья – твёрдого топлива, нефти и газа – первичное разделение, очистка, облагораживание, конверсия углеводородного сырья в сам водород. б) нефтехимический синтез – производство органических продуктов и полупродуктов на основе переработки газообразных, жидких и твёрдых углеводородов, а также на основе оксидов углерода и водорода. в) основной органический синтез – производство базовых продуктов органического синтеза, дающего начало всем остальным процессам более глубокой переработки органического сырья. г) биотехнология – производство кормовых дрожжей, аминокислот, ферментов, антибиотиков и др. на основе биологических процессов. д) тонкий органический синтез – производство органических препаратов, реактивов, лекарственных веществ, душистых веществ, средств защиты растений и др. е) производство органических полупродуктов и красителей. ж) технология высокомолекулярных соединений (СК, пластмассы, химические волокна, плёнкообразующие вещества). з) технологии переработки растительного и животного сырья. В определённой степени приведённая классификация условна. Например, в технологии переработки растительного и животного сырья нередко используются биотехнологические методы, например, в производстве спирта, сыров, йогуртов и т.д. В соответствии с приведённой классификацией сырьевую основу соответствующей отрасли составляют: в неорганической ХТ 1) Атмосферный азот и в очень ограниченной степени натриевая селитра, запасы которой (Чили, Южная Африка) быстро истощаются; 2) Водород. В промышленности производится: а) конверсией метана  б) неполным окислением метана, который является комбинацией следующих реакций  с последующим взаимодействием СО с водяным паром  в) конверсией твёрдого углеродного топлива  г) электролиз воды или водных растворов NaCl. 3. Кислород или воздух. Если необходимо иметь чистый кислород, то его сжижают при высоких давлениях и пониженной температуре, а затем подвергают фракционной перегонке; 4. Источником получения серной кислоты и других продуктов на её основе является элементарная сера, пирит FeS2 и сульфиды цветных металлов; 5. Источником получения фосфорной кислоты и фосфат-содержащих удобрений являются фосфатные руды: апатиты и фосфориты. В этих рудах фосфор находится в нерастворимой форме, главным образом в виде фторапатита Ca5F(PO4)3 и трикальцийфосфата Ca3(PO4)2; Апатит – минерал, входящий в состав изверженных пород. В России на Кольском полуострове имеются крупнейшие залежи апатитонефелиновой руды. Нефелин (K,Na)2OAl2O32SiO22H2O – сырьё алюминиевой промышленности. Апатитонефелиновую породу, содержащую до 70% апатита и до 25% нефелина разделяют флотацией на апатитовый концентрат, в состав которого входит до 40% Р2О5 и нефелиновую фракцию, которая после повторного обогащения содержит до 30% Al2O3. Фосфориты – породы … происхождения. Содержание Р2О5 в фосфоритах колеблется от 20 до 30%. 6. Первичным сырьём для производства органических веществ являются природный газ, нефть, каменный уголь, в меньшей степени горючие сланцы и торф. Традиционные способы их первичной переработки – пиролиз. Последние годы всё большее значение приобретает синтез-газ получаемый из всех перечисленных видов сырья путём парокислородной конверсии. Это особенно важно для твёрдых горючих ископаемых, залежей которых должно хватить на несколько сотен лет. Синтез-газ является основой для получения небольшой группы базовых продуктов органического синтеза, которые в сырьевом балансе промышленных органических продуктов составляют 90%. Сюда относятся этилен, пропилен, 1,3-бутадиен, бензол, толуол и ксилолы. 7. Источником получения металлов в технически чистом виде являются природные минералы, содержащие, как правило, часть пустой породы. Минералы руд представляют в основном оксиды и сульфиды некоторых металлов (Fe3O4, Fe2O3, Cu2S, CuS, FeCuS2, ZnS и др.), содержащие оксиды соединений, составляющих пустую породу. В чёрной металлургии к ним относятся Al2O3, SiO2, CrO, MgO и т.п. В то же время некоторые из этих оксидов могут служить рудами цветных металлов (например, Al2O3 в производстве алюминия). Обобщая данные по минералам руд их можно подразделить на оксидные, сульфидные и самородные. Руды, в состав которых входят соединения разных металлов называют полиметаллическими. Типичными примерами таких руд являются медно-никелевые (содержат сульфиды свинца и цинка), свинцово-молибденовые и др. Энергетическая база химических производств Химическая промышленность и смежные с ней отрасли основанные на химических превращениях (нефтепереработка, нефтехимия, металлургия, целлюлозно-бумажная промышленность) являются крупнейшими потребителями энергии. Химическая промышленность и нефтеперерабатывающие производства потребляют около 20% от энергопотребления всей промышленности. По расходу тепловой энергии химическая промышленность занимает второе место среди других отраслей хозяйственной деятельности, а по расходу электроэнергии – третье. Химические процессы подразделяются на экзо- и эндотермические. Проведение эндотермических процессов требует дополнительного подвода тепла из вне и поэтому, как правило, характеризуется гораздо большим энергопотреблением. В экзотермических процессах такого подвода обычно не требуется, так как тепло реакции может быть использовано для поддержания необходимого температурного режима. В высокоэкзотермических процессах протекающих при высоких температурах (400-6000С) часть избыточного тепла реакции может быть преобразовано в механическую энергию для транспортировки реагентов или создания повышенных давлений. Это даёт существенную экономию энергии на производстве. Помимо затрат или экономии энергии, связанной с эндо- и экзотермичностью реакций реализация любого химического производства связана с расходом энергии на проведение вспомогательных операций, таких как подготовка и транспортировка сырья, отвод продуктов, физические операции дробления, фильтрации, перемешивания, дистилляции и др. В химической технологии используются почти все виды энергии: электрическая, тепловая, ядерная, химическая, световая и др. Наиболее широко используются тепловая и электрическая энергия. Принципы создания ресурсосберегающих технологий Сырьё, материалы и энергии являются важными ресурсами любого химического производства. Поскольку большинство видов сырья и значительная часть энергетических ресурсов являются невозобновляемыми, проблема их экономии является одной из важнейших при организации любого производства. Проблема экономии ресурсов и энергии имеет также важное природоохранное значение. Так, высокие затраты сырья означают необходимость обеспечения высоких мощностей горнодобывающих, металлургических, нефтеперерабатывающих и других предприятий характеризующихся наиболее высоким уровнем экологической опасности. С другой стороны чрезмерный расход материалов и энергии удорожает стоимость выпускаемой продукции. Наконец, такой перерасход сопряжён с прямой экологической опасностью. В частности перерасход сырья связан с образованием высокотоксичных и трудноутилизируемых побочных продуктов процессов. С другой стороны, перерасход энергии означает увеличение эмиссии в атмосферу СО2, а также образование твёрдых золоотвальных отходов. Стратегия создания ресурсосберегающих производств и её реализация основана на следующих принципах. 1. Создание высокоселективных химических процессов, основанных на использовании новых, высокоизбирательных каталитических систем и выборе оптимальных условий проведения самих химических процессов. Достижение высокой селективности является важной превентивной мерой по экономии сырьевых ресурсов, поскольку уже на стадии химического взаимодействия позволяет максимально использовать реагенты для получения целевых продуктов. Этот принцип можно проиллюстрировать следующими примерами Пример 1. Оксид этилена, важнейший многотоннажный продукт промышленного органического синтеза получают каталитическим окислением этилена в газовой фазе при 250-3000С и давлении 1-3МПа на серебряном катализаторе. Максимальный выход оксида этилена составляет 70% при 20% конверсии этилена. Из этих данных следует, что перерасход сырья по сравнению с теоретическим составляет 30%. Технология метода требует организации рецикла 80% этилена в процесс и, соответственно, дополнительных материальных и энергетических затрат. В то же время окислительная среда и жёсткие условия процесса (температура и давление) являются факторами быстрого износа оборудования. В конечном счете, перечисленные проблемы обусловливают высокую степень ресурсозатратности процесса. Альтернативой ему может стать окисление этилена, катализируемое газоассимилирующими бактериями. Ресурсосберегающий эффект такого способа окисления очевиден – он характеризуется 100%-ным выходом при 100% конверсии и осуществляется при обычных температуре и давлении. Благодаря этому можно организовать безотходное производство этиленоксида, не требующее организации рецикла и функционирующее в мягких условиях и обеспечивающих надёжную работу оборудования. В большинстве случаев катализаторы позволяют обеспечить высокую селективность процессов в сравнительно мягких условиях. Это открывает возможность существенно снизить расход материалов, сырья и энергии, износ оборудования, что в конечном счёте обусловливает ресурсосберегающий характер каталитических процессов. Показательным в этом отношении являются процессы получения азотных удобрений на основе синтеза аммиака 3H2 + N2 2NH3 + Q Обычные катализаторы этого процесса активны при температуре 400-500ºС. В этих условиях температура является мощным фактором смещения равновесия в сторону регентов. Чтобы увеличить степень превращения приходится повышать давление до высоких значений 10-100МПа. Поддержание указанных температур и давлений требует больших энергетических затрат, а совместное их действие приводит к быстрому износу оборудования. В тоже время фиксация связанного азота, необходимого для роста и функционирования растений, легко осуществляется в природе в мягких условиях, причём необходимая потребность растений в соединениях азота на 60% обеспечивается этими природными процессами. Очевидно, что перспектива создания экологически безопасного и ресурсосберегающего способа синтеза аммиака связана с разработкой каталитических систем, которые бы моделировали действие природных катализаторов – ферментов, содержащиеся в азотфиксирующих бактериях. 2. Принцип направленного совмещения процессов предполагает принудительное сочетание химических реакций с другими процессами (а иногда и другими химическими реакциями), обеспечивающее увеличение селективности процессов, степени превращения реагентов, а также поддержание условий процессов (температуры, соотношения реагентов и др.) на оптимальном уровне. Проиллюстрируем это рядом примеров. Пример 1. Синтез сложных эфиров описывается стехиометрическим уравнением: RCOOH+R′OH RCOOR′ +H2O В обычном жидкофазном процессе характеризуется низкими степенями превращения реагентов из-за обратимости реакции. Это означает, что после завершения процесса непрореагировавшие спирт и карбоновую кислоту необходимо выделить и снова направить на этерификацию. Такая операция называется рециклом. Очевидно, что организация рецикла требующая дополнительных энергетических и материальных затрат невыгодна с точки зрения ресурсосбережения. Если же этерификацию осуществлять совместно с отгонкой одного из легкокипящих продуктов (воды или эфира) из реакционной массы, то их концентрация в зоне реакции резко снизится и равновесие этерификации практически нацело сместится в правую сторону. В этих условиях затраты на рецикл можно свести к минимуму или вовсе отказаться от него. Пример 2. Реакции газофазного хлорирования сопровождаются вторичными побочными реакциями более глубокого хлорирования. Например, при хлорировании дихлорметана для получения хлороформа побочной реакцией является хлорирование самого хлороформа, что приводит к перерасходу хлора и дихлорметана. При этом образуется CCl4, являющийся одним из наиболее сильных разрушителей озонового слоя Земли. Если же процесс газофазного хлорирования СH2Cl2 проводить в режиме конденсации хлороформа, то последний быстро удаляется из реакционной зоны. В результате концентрация CHCl3 в газовой фазе будет существенно понижена, что приводит к подавлению побочной реакции с его участием. Это позволяет достичь высокой селективности по хлороформу при обеспечении глубоких конверсий по хлорметану. Пример 3. Одним из известных способов получения альдегидов и кетонов в промышленности является каталитическое дегидрирование первичных и вторичных спиртов RCH2O RCHO + H2 – Q1 (1) RCHOHR’ RCOR’ + H2 – Q2 (2) Степень превращения в таких реакциях ограничивается термодинамическим пределом – равновесной степенью превращения. Кроме того, высокая эндотермичность реакции обусловливает снижение температуры по длине каталитического слоя и резкое снижение скорости реакции. Из-за низких степеней превращения, связанных с указанными причинами, приходится выделять из реакционной массы непрореагировавшие спирты и возвращать их в процесс, т.е. организовывать рецикл. Если подобные процессы проводить в присутствии воздуха, то реакции (1) и (2) будут фактически совмещаться с реакцией окисления водорода H2 + 1/2O2 → H2O +Q3 которая является необратимой и её протекание приводит к смещению равноесий (1) и (2) в правую сторону. Суммируя реакции (1) или (2) с реакцией (3), приходим к уравнению совмещённого необратимого процесса RCH2O + 1/2O2 → RCHO + H2О – Q1 +Q3 RCHOHR’ + 1/2O2 → RCOR’ + H2О – Q2 +Q3 Таким образом, совмещение в едином реакционном пространстве экзотермической реакции диспропорционирования и реакции окисления водорода делает совмещённый процесс окислительного дегидрирования необратимым и позволяет осуществлять его до практически 100%-ных конверсий. С другой стороны совмещённый процесс в целом характеризуется слабой экзотермичностью (– Q1 +Q3<0, – Q2 +Q3<0) и выделяющегося тепла как раз хватает на компенсацию тепловых потерь. Это позволяет проводить его в условиях практической изотермичности поддерживая температуру на уровне её оптимального значения. 3. Реализация принципа “сопряжённых” процессов, основанных на стехиометрических особенностях химических реакций, лежащих в основе этих процессов и позволяющих получать из исходного сырья одновременно несколько ценных товарных продуктов. Пример 1. Кумольный способ получения фенола и ацетона, основанный на последовательности реализации стадий окисления изопропил бензола и разложения образующегося гидропероксида: 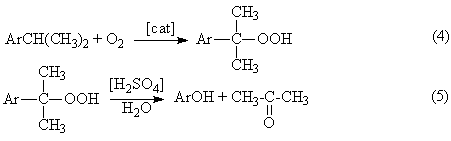 Суммирование правых и левых частей уравнений (4) и (5) приводит к уравнению брутто-реакции: 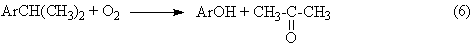 показывающему, что всё используемое сырьё при условии 100% селективности на каждой стадии всё используемое сырьё превращается в ценные товарные продукты. Пример 2. Халкон-процесс совместил получение стирола и пропиленоксида. Этот процесс был разработан как альтернатива методу получения пропиленоксида, основанному на последовательной реализации следующих стадий: СН3СН=СН2 + Cl2 +H2O → CH3CH(ОН)-CH2Cl + HCl (7) Суммируя левые и правые части уравнений (7) и (8) с учётом баланса между ними, приходим к уравнению брутто-реакции: Можно видеть, что хлорный метод получения пропиленоксида характеризуются расходом дорогостоящих хлора и щелочи, образованием солевых стоков (СaCl2), а также загрязненной органическими примесями и не находящей сбыта соляной кислоты. Уравнение (9) показывает, что даже при 100% - ной селективности продуктов на каждой стадии количество отходов составляет 3,17 кг на 1кг пропиленоксида. Халкон – процесс представляет собой сочетание трех последовательных стадий: 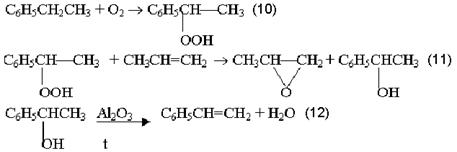 Суммирование уравнений (10) - (12) приводит к результирующему уравнению процесса  (13) (13)Согласно этому уравнению теоретическое количество побочных продуктов на 1 кг полезных (пропиленоксида и стирола) составляет 0,11кг. Таким образом, Халкон-процесс характеризуются более высоким уровнем ресурсосбережения по сравнению с хлорным методом. Следует добавить, что стадии Халкон – процесса характеризуются более высокой селективностью по сравнению со стадиями хлорного метода, и это дает дополнительный выигрыш в экономии сырья. 4. Разработка альтернативных процессов, основанных на меньшем числе химических стадий, выгодных стехиометрических соотношениях, более дешёвых и доступных видах сырья. В общем случае увеличение числа стадий означает увеличение количества единиц оборудования, дополнительных затрат сырья и материалов, а также энергии. Характерным примером в этом плане является одностадийный синтез перхлорэтилена окислительным дегидрированием симметричного тетрохлорэтилена: CHCl2CHCl2 + 1/2O2 CCl2=CCl2 +H2O (14) являющегося альтернативой способу представляющему собой последовательность стадий дегидрохлорирования, хлорирования и снова дегидрохлорирования 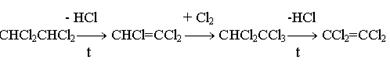 (15) (15)Суммарно уравнение этого процесса описывается уравнением CHCl2CHCl2 + Cl2 → CCl2=CCl2 + HCl (16) Очевидно, что реализация трёх стадий последовательного процесса требует больших затрат на оборудование, характеризуется повышенной энергоёмкостью, быстрым износом реакционной аппаратуры под действием агрессивных сред (Cl2 и HCl). В то же время этот способ характеризуется дополнительным расходом дорогостоящего хлора и образованием балластного продукта, хлороводорода. Анализируя уравнения (14) и (16) можно найти, что теоретическое количество побочных продуктов в одностадийном процессе составляет 0,11 кг, а в трёхстадийном – 0,43 кг на 1 кг перхлорэтилена. Важным направлением создания ресурсосберегающих технологий является выявление новых реакций, характеризующихся более выгодным стехиометрическими соотношениями по сравнению с известными способами получения товарных продуктов. Примером таких новых реакций являются реакции гидрокарбалкоксилирования метилацетилена и аллена.  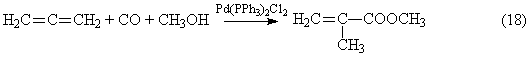 Можно видеть, что в правой части стехиометрических уравнений (17) и (18) фигурирует только целевой продукт реакции. Поэтому теоретический выход побочных продуктов на 1 кг эфира ≈0 Для сравнения приведем способ получения метилметакрилата через ацетонциангидрин: Результирующее уравнение этого процесса получается суммированием левых и правых частей уравнений (19) и (20): Анализ его стехиометрии показывает, что теоретическое количество его побочного продукта, NH4HSO4, составляет 1,12 кг на 1кг целевого продукта. Кроме того, ацетонциангидринный способ основан на более дорогостоящем сырье (ацетон, HCN, H2SO4) по сравнению с методом гидрокарбметоксилирования, причем в последнем в качестве реагента используется метилацетилен и аллен, являющиеся отходами пиролиза бензиновых фракций. Общий курс хозяйственной деятельности человека на ресурсосбережение требует разработки новых процессов на основе более доступных и дешевых видов сырья. Примером иллюстрирующем такой подход, являются разрабатываемый процесс получения этилена окислительным сочетанием метана: 2CH4 + O2 CH2=CH2 + 2H2O обещающий коренным образом изменить сырьевую базу промышленного органического синтеза. Примером ресурсосберегающего подхода является тенденция замены металлов платиновой группы как катализаторов процессов восстановления и гидрирования на оксиды и сульфиды менее дорогостоящих металлов типа меди, хрома, ванадия, вольфрама, молибдена и других. 5. Разработка производства химических продуктов, основанных на использовании вторичных материальных и энергетических ресурсов, переработка побочных продуктов процессов. Вовлечение вторичных сырьевых ресурсов в новые технологические процессы позволит существенно сократить объемы добычи первичных видов сырья и снизить уровень антропогенного воздействия на окружающую среду. Так, использование лома черных и цветных металлов предполагает сравнительно простые и экономичные технологии их переработки в новые металлические изделия по сравнению с переработкой соответствующих руд. Благодаря этому открывается возможность снизить масштабы добычи на «экологически грязных» горнодобывающих предприятиях. В промышленном органическом синтезе вторичными сырьевыми ресурсами являются углеводородные отходы нефтепереработки и других отраслей, органические составляющие бытового мусора, отходы пищевой промышленности и сельского хозяйства, лесохимической и деревообрабатывающей промышленности. Наиболее рациональный путь их переработки - парокислородная конверсия с получением синтез-газа. На многих химических предприятиях образуются химические отходы, которые можно рассматривать как вторичное сырьё данного предприятия. Вовлекая эти отходы в новые циклы превращений, можно решить трудную задачу: повысить уровень ресурсосбережения процессов, обезвредить отходы и максимально изолировать производство от окружающей среды. Наглядным примером такого подхода является переработка сероводорода, продукта гидроочистки нефтепродуктов, оказывающего токсическое действие на живые системы. В основе переработки лежит сульфокс-метод: H2S + 2NH(СН2СН2ОН)2 → S[NH2(СН2СН2ОН)2]2 (22) S[NH2(СН2СН2ОН)2]2+ ½O2 → 2NH(СН2СН2ОН)2 + S↓ + H2O (23) Суммируя уравнения стадий (22) и (23), имеем стехиометрию брутто-процесса: H2S + ½O2→ S↓ + H2O (24) Таким образом, в результате переработки сероводорода получают элементарную серу, являющуюся сырьем в экологически безопасном способе получения серной кислоты. Поскольку диэтаноламин, используемый на стадии сорбции сероводорода, регенерируется на стадии окисления, фактические его затраты связаны лишь с компенсацией его потерь в процессе. Другой пример подобного рода связан с образованием полиэтилбензоатов в процессе получения этилбензола: Выход полиэтилбензолов в этом процессе достаточно велик, поскольку введенная в бензольное кольцо алкильная группа активирует последующее алкилирование. Чтобы подавить эту реакцию необходимо ограничивать конверсию и увеличивать избыток бензола по отношению к этилену. Это приводит к возрастанию количества непрореагировавшего бензола и удорожанию его рецикла в процессе. Однако, если полученную реакционную смесь подвергнуть выдержке при более высокой температуре, то её компоненты вступают в реакцию переалкилирования, благодаря которой алкильные группы из побочных полиалкилбензолов мигрируют к бензолу: C6H4(C2H5)2 + C6H6 2C6H5C2H5 В результате этого побочные полиэтилбензолы и соответствующее количество бензола превращаются в целевой продукт. Это позволяет снизить избыток исходного бензола, достичь его более высоких конверсий и, как следствие, сделать рецикл более экономичным. 6. Принцип рекуперации энергии материальных потоков для энергетического обеспечения функционирования установок по производству химических продуктов. Общая стратегия энергосбережения на химических производствах нацелена на увеличение степени полезного использования энергии на каждой стадии и сокращение этих стадий. При этом руководящим принципом рекуперации энергии материальных потоков является принцип соответствия качества энергии поставленным задачам. Так, высокотемпературное тепло лучше использовать для генерирования водяного пара, с помощью которого вращают лопасти турбин, приводящих в движение насосы и компрессоры установок. Такое решение предполагает трансформацию части высокотемпературного тепла в высокоорганизованную энергию поступательного движения. Использование высокотемпературного тепла для целей подогрева нецелесообразно, поскольку в этом случае заложенный в нем ресурс высокоорганизованной формы энергии рассеивается в виде низкотемпературного тепла. Аналогично, энергию сжатых потоков можно с помощью газовой турбины трансформировать в поступательную или электрическую энергию или использовать ее для разделения реакционных смесей на отдельные компоненты путем сочетания процесса адиабатического расширения с фракционированием. Если температуры материальных потоков умерены, то разумным способом утилизации их тепла является подогрев реагентов. Если температуры ещё ниже, то тепло материальных потоков целесообразнее использовать для обогрева бытовых помещений. Другими важными факторами экономии тепла материальных потоков являются интенсификация гидродинамического режима в процессах теплообмена и эффективная изоляция аппаратуры и трубопроводов, работающих при высоких температурах с целью минимизации тепловых потерь в окружающую среду. Завершая рассмотрение технологических принципов ресурсосберегающих технологий, следует подчеркнуть, что их успешная реализация может быть достигнута при оптимальном сочетании рассмотренных методов. К организационно-управленческим принципам относятся: 1. Принцип кооперирования и комбинирования различных производств, обеспечивающих рациональное использование оборудования, сырья и энергии. 2. Принцип создания безотходных территориально-промышленных комплексов с целью комплексной переработки отходов промышленности, сельского и муниципальных хозяйств в ценную товарную продукцию. 3. Разработка технологий по переработке отходов отдельных отраслей промышленности. 4. Проведение гибкой налоговой политики и использование рыночных механизмов для стимулирования хозяйственной деятельности по переработке отходов. |
