лекции токсикхим. Лекция Предмет, разделы и задачи токсикологической химии. Пищеварение и метаболизм посторонних веществ ядов. Вещества, которые изолируются минерализацией биологического материала (металлические яды)
 Скачать 1.52 Mb. Скачать 1.52 Mb.
|
|
Лекция 1. Предмет, разделы и задачи токсикологической химии. Пищеварение и метаболизм посторонних веществ – ядов. Вещества, которые изолируются минерализацией биологического материала (металлические яды). Дробное обнаружение, определение и токсикологическое значение катионов элементов, проявляющих токсическое воздействие на организм человека  Чувствительность данной реакции составляет 0,05 мкг/мл. Граница обнаружения – 0,02 мг/100,0. Данная реакция может быть успешно использована для количественного определения ионов свинца фотометрическим методом. 2. Образование PbS: Рb(СН3СОО)2 + Н2S  РbS↓ + 2СН3СООН РbS↓ + 2СН3СООНчерный осадок Осадок растворим в азотной кислоте – НNО3: Свинец  2. Экстракционно-фотометрический (по образованию дитизоната свинца) Уравнение реакции указано в ы ш е ! 3. Для определения концентрации катионов свинца применяется один из титриметрических методов анализа – комплексонометрия. К раствору, содержащему катионы свинца добавляют аммиачный буферный раствор с рН = 6, затем добавляют индикатор – эриохром черный Т. Индикатор с катионами свинца образует внутрикомплексное соединение красного цвета. Титрование проводят стандартным раствором Трилона В, который вступает в реакцию с катионами свинца и в точке конца титрования Трилон В вступает в реакцию с катионами свинца, находящихся в составе внутрикомплексного соединения свинец-эриохром черный Т и в этот момент окраска раствора зависит от цвета свободного индикатора при определенном значении рН (рН = 6). Токсикологическое значение соединений свинца определяется ядовитыми свойствами металлического свинца и его соединений, а также их производных, а также широким применением в промышленности и быту. Опасность представляют добыча свинцовых руд, выплавка свинца, производство аккумуляторов, свинцовых красок. Источником бытовых отравлений является недоброкачественно луженная, эмалированная и глиняная посуда, покрытая глазурью. Свинец естественно содержится в организме человека. На 100 г массы тела в норме приходится 0,1 г свинца. Ежедневно человек потребляет около 0,29 мг свинца с пищевыми продуктами. Свинец и его соли поражают ЦНС: возникают галлюцинации, судороги, атрофия зрительного нерва, наблюдаются заболевания желудочно-кишечного тракта. Особое место среди соединений свинца занимает тетраэтилсвинец (ТЭС). Рb(С2Н5)4 – элементоорганическое соединение, которое широко применяется в качестве добавки к бензину, при этом резко уменьшается детонация двигателя. Тетраэтилсвинец очень ядовит, действует на нервную систему, способен кумулироваться (головная боль, головокружение, бессонница, психическое расстройство, алкоголь усиливает действие тетраэтилсвинца. Тетраэтилсвинец изолируется различными методами в зависимости от объекта: 1. Из биологического материала – перегонкой с водяным паром. 2. Из растительных и пищевых объектов – экстракцией хлороформом. 3. Из бензинов экстрагируют 4% спиртовым раствором йода. После изолирования и разрушения молекулы тетраэтилсвинца открывают свинец приведенными выше реакциями. Барий (s-элемент, 6s2) Качественное обнаружение: 1. Реакция перекристаллизации BaSO4 (остаток после отделения сульфата свинца – PbSO4 (из концентрированной серной кислоты – кристаллы в виде мелких кристаллов, в виде летящих птиц и прямоугольных пластинок. 2. Реакция восстановления BaSO4 в BaS (на платиновой петле): BaSO4 + 4СО (образуется при горении)  BaS↓ + 4СО2↑ BaS↓ + 4СО2↑BaS + 2HCl  BaCl2 + H2S↑ BaCl2 + H2S↑(Bа2+ окрашивает пламя газовой горелки в желто-зеленый цвет). 3. Переведение нерастворимого BaSO4 в растворимую соль бария: BaSO4 + Na2CO3  BaCO3↓ + Na2SO4 BaCO3↓ + Na2SO4избыток Образующийся в результате реакции карбонат бария, растворим даже в слабых кислотах (например СН3СООН). 4. На катион Ва2+ можно проделать следующие реакции обнаружения: а) Bа2+ + K2Cr2O7 + Н2O + 2CH3COONa  2BаCrO4↓ + 2CH3COOH + 2Na+ + 2K+ желтого цвета 2BаCrO4↓ + 2CH3COOH + 2Na+ + 2K+ желтого цветаОбразовавшийся желтый осадок растворим в хлороводородной кислоте – HCI б) Bа2+ + (NH4)2C2O4  BаC2O4↓ + 2NH4+ BаC2O4↓ + 2NH4+белый осадок в) Реакция с родизонатом натрия (лучше ее проводить капельным методом на фильтровальной бумаге) Количественное определение 1. Гравиметрический (весовой) метод по продукту реакции, который образуется – BaSO4 2. Титриметрический метод (комплексонометрия) Токсикологическое значение представляют растворимые соли бария, которые применяются в керамическом и стекольном производстве, в текстильной промышленности, при производстве резины, в сельском хозяйстве. Сульфат бария в медицинской практике применяется как рентгеноконтрастное вещество. Все растворимые в воде соединения бария очень ядовиты. Симптомами отравления являются потеря сознания, резкое повышение кровяного давления, сердечная аритмия, боли в области сердца, рвота, понос, дрожание мышц. При отравлении назначают внутрь сульфат натрия или магния (слабительные лекарственные средства). В первые часы после отравления, одновременно вводят внутримышечно 30-50 мл 10% раствора тетацина кальция на 5% растворе глюкозы. Ва – несмотря на свою высокую токсичность, в незначительных количествах характерен всем органам и тканям живых существ. Он обнаружен в гипофизе, надпочечниках, щитовидной железе. Содержится в довольно значительном количестве (1,5% на сухой остаток) в сетчатке глаза. Исследование минерализата на присутствие в нём соединений меди Медь.Распространение и применение. Элемент №29. Жизненно важный элемент. Один из самых важных, самых древних и самых популярных металлов. Популярных не только в среде инженеров, электриков и машиностроителей, но и у людей самой гуманной профессий – врачей и фармацевтов. Семь металлов принято называть доисторическими. Золото, серебро, медь, железо, олово, свинец и ртуть. Ещё Тит Лукреций Кар, древнеримский философ и поэт, в свой поэме «О природе вещей» сказал: Прежде служили оружием руки могучие, когти, Зубы, каменья, обломки ветвей от деревьев и пламя, После того была найдена медь…Роль меди в становлении человеческой культуры особенна. Каменный век сменился медным, медный – бронзовым. В живом организме медь содержится и в довольно значительных количествах. В печени – 4•10–4 мг/кг массы, в крови взрослого человека – 1•10–4 мг/л. Медь участвует в процессах кроветворения и ферментативного окисления. Она входит в состав нескольких ферментов – лактазы, оксидазы и др., а также является катализатором реакции образования гемоглобина. В с/х самой распространённой солью является сульфат меди (медный купорос) – CuSO4•5H2O. Медный купорос ядовит, особенно для низших организмов. Раствор сульфата меди уничтожает споры плесневых грибков. В медицинской практике находит применение сульфат меди (II), который применяется орально при отравлениях фосфором (дозы 0,3-0,5 г), как рвотное средство (10-30 мл 1%-го раствора 2-3 раза в день). Цитрат меди (C6H4O7Cu2)2•5H2O применяется в виде 1-5%-ых мазей при трахоме и коньюктивитах. Медь – весьма ценный металл, следы которого играют большую роль в процессах метаболизма. Этот вопрос достаточно полно изложен в научной литературе. Ежедневная норма для человека составляет 2 мг и в основном поступает с пищей, содержание меди в которой в ежедневном рационе составляет 2-5 мг. При нарушении роли меди в процессах метаболизма существует вероятность отравления данным соединением. Острое отравление медью – это обычное следствие загрязнение продовольствия медной посудой, а также при неосторожном или преднамеренном употреблении солей меди. Индустриальные отходы, содержащие медь и поступающие в организм в виде паров и пыли должны иметь пороговую концентрацию в пределах 0,2-1,0 мг/м3 объёма в производственных помещениях. Содержание в крови: общее содержания меди в сыворотке крови у мужчин составляет 1,09 мг/л, у женщин – 1,2 мг/л. Содержание меди в эритроцитах составляет в среднем 0,89 мг/л. Приблизительно 93% меди в сыворотке крови связаны с ферментом церулоплазмином, который стимулирует образование эритроцитов, а остаток свободно связан с белками сыворотками крови. Особенно важно содержание меди в сыворотке крови в третьем триместре беременности и оно должно быть в среднем в 2,39 мг/л. Метаболизм и выделение. Примерно третья часть потребляемой с пищей меди абсорбируется организмом. Из этого количества 80% выделяются с желчью, приблизительно 18% через желудочно-кишечный тракт и только от 2 до 4% выделяется с мочой. Только небольшое количество меди, выделяемое печенью, входит в состав с церулоплазмином, который синтезируется печенью и это вскоре проявляется в плазме в несвязанной форме. Выделение меди с мочой составляет в среднем только 0,052 мг ежедневно (диапазон от 0,026 до0,064) по отношению к здоровым пациентам. Концентрация меди у здоровых рабочих медеплавильной промышленности, где содержание меди в производственной зоне находится в пределах от 30 до 40 мг/м3, составляет в среднем 0,079 мг/м3, а иногда достигает 1,145 мг/л. Содержание меди в здоровых тканях (мг/л или мг/кг)
Токсичность. Хронические отравления медью обычно не встречаются у пациентов, которые поддерживают медный баланс в норме при приеме пищи и при потреблении меди из окружающей среды. У людей, страдающих болезнью Вильсона-Коновалова, прогрессирующая медная токсичность развивается из-за наследственного нарушения метаболических процессов; уровень фермента церулоплазмина в сыворотке крови заметно снижен, что приводит к появлению избытка меди в паренхимных тканях и нанесению вреда, который в конечном счете приводит к смерти. Причем эти пациенты могут иметь уровень меди в сыворотке крови в половину от нормальных концентраций, в печени в пять раз меньше от нормы, а в моче в 10 раз меньше от нормы. Интенсивное вдыхание аэрозолей, образующихся во время сварочных работ и технологических процессов при производстве меди вызывает типичную металлическую лихорадку: раздражение верхних дыхательных путей, металлический привкус во рту, тошнота, рвота, эпигастральная боль, диарея, похолодание и боли в мышцах. Большинство рабочих, у которых развивалась типичная медная лихорадка имели содержание меди в сыворотке крови на уровне 1,26 мг/л. Ингаляция метаболической медной пыли также приводит к появлению подобных признаков. Хронические отравления медью в промышленных условиях приводит к анорексии, тошноте, рвоте, проявлениям возбуждения и гепатогалии (увеличение печени); концентрация меди в сыворотке крови в таких случаях находится в пределах от 0,8 до 2,0 мг/л. Умеренные желудочно-кишечные расстройства вызываются приемом пищи, содержащей несколько сотен миллиграммов медных солей, а острые признаки отравления наблюдались у людей, которые для приготовления пищи использовали коррозирующую медную посуду. Увеличение в 15-100% концентрации меди в сыворотке крови наблюдалась у детей, принимающих 250 г меди сульфата в качестве рвотного средства. Уровень меди в сыворотке крови до 5 мг/л достигается при случайной интоксикации медью сульфатом, которая попадала на участки обожженной кожи и концентрация её в сыворотке крови была в пределах от 13 до 21 мг/л у пациентов получивших отравление при гемодиализе с использованием цельномедного нагревательного узла поддерживающего температуру перфузионной среды. В случаях осознанного отравления меди сульфатом, содержание её в крови хорошо коррелировалось с тяжестью интоксикации; при отравлении содержание меди в крови достигало 2,87 мг/л, а в серьезных случаях – 7,98 мг/л. Содержание ионов меди в сыворотке крови в последнем случае составляло 2,57 мг/л при измерении её концентрации в первые двенадцать часов и 0,23 мг/л по истечению этого времени, что связано с переходом в эритроциты. Смерть обычно наступает в 1-7 день после приема 10-20 г растворимой соли меди и часто этому предшествует рвота, гемолиз крови, печеночная и почечная недостаточность и шок. В случаях с летальным исходом содержание меди в мг/л или мг/кг в тканях человека было следующим:
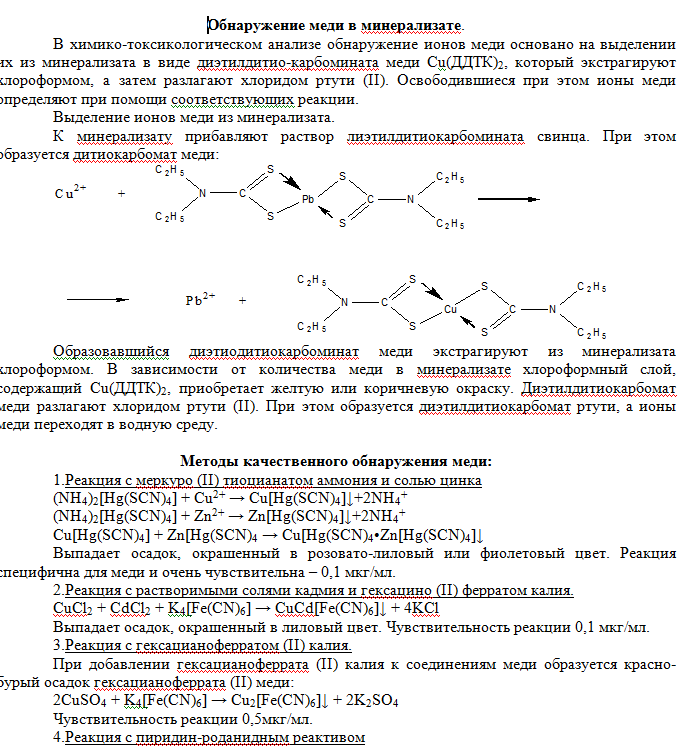 При добавлении по каплям 1-2 мл пиридино-роданидного реактива (смесь равных объемов 50%-го водного раствора пиридина с 20%-ым раствором роданида аммония) и 1 мл хлороформа к раствору содержащему ионы меди (II) – слой органического растворителя окрашивается в изумрудно-зеленый цвет.  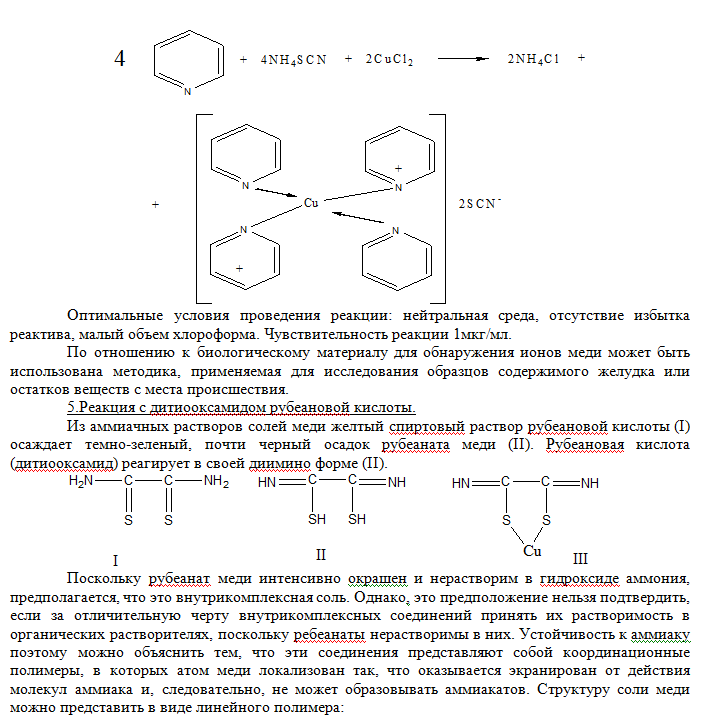 Реакция с рубеановой кислотой (дитиооксамидом) на медь чрезвычайно чувствительна. Если в качестве маскирующих агентов использовать малоновую кислоту и этилениамин, то медь можно обнаружить с рубеановой кислотой без помех со стороны всех других ионов металлов. Чувствительность реакции 0,006 мкг/мл. Выполнение реакции. На фильтровальную бумагу наносят каплю исследуемого раствора, выдерживают над аммиаком и добавляют каплю 1%-го спиртового раствора рубеановой кислоты (дитиооксамида). Появление черного или оливково-зеленого пятна или кольца указывает на присутствие меди (II). Для анализа содержимого желудка или остатков с места происшествия на ионы меди (II) применяются также реакция с меркуро (II) тиоцианатом аммония и солью цинка, описанная выше как один из вариантов обнаружения меди в минерализате. 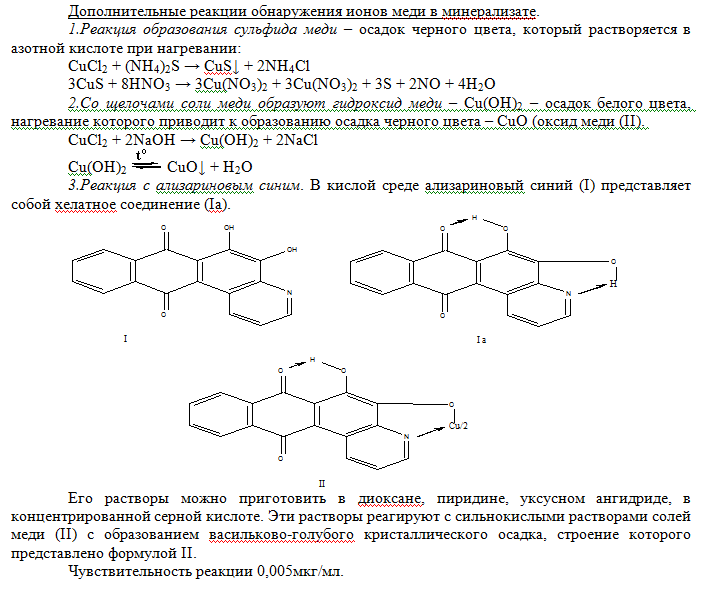 Количественное определение. Исходя из широкого варьирования количества меди в органах и тканях трупа человека ( от миллиграммовых до нескольких десятков миллиграмм) в научной литературе описано несколько методов определения меди при химико-токсикологических исследованиях. 1.Объемный метод. Комплексонометрическое титрование ионов меди (II) после выделения их экстракцией в виде (ДДТК)2Cu с последующей реэкстракцией в водный слой. В качестве индикатора при титровании трилоном Б используется мурексид; рН 7,0-8,0. Определяется при 10мг ионов меди (II) в 100г биологического объекта 98% с относительной ошибкой 2,2%, при 1мг – 96% со средней относительной ошибкой 6,5%. Граница определения 0,5мг. 2.Экстракционное тирование дитизоната меди (II) при рН 3,3. Ионы меди образуют с дитизоном внутрикомплексное соединение, которое эксрагируется хлороформом. Дитизонат меди разлагают хлоридом ртути (II). При этом образуется дитизонат ртути, а ионы меди переходят в водную фазу. Их оттитровывают раствором ЭДТА при индикаторе эрихром черный Т (переход окраски из черной в синюю). Фотоколоримтрические методы. 1.Определение с диэтилитиокарбаматом. Этот метод дает возможность определять очень малые следы меди, если образующееся соединение экстрагировать. Диэтилдитиокарбамат образует с ионами меди (II) комплексное соединение, окрашивающее раствор в желтый или коричневый цвет. Окраска получается мгновенно и сохраняется, не ослабевая, в течении 1 часа. Полученное окрашенное комплексное соединение растворимо в четыреххлористом углероде, хлороформе, амиловом спирте, амилацетате. Наиболее устойчивые растворы диэтилдитиокарбаната меди в хлороформе. Молярный коэффициент светопоглощения Е≈13000 при λ=435 нм. Определяется при 10 мг ионов меди (II) в 100 г биологического материала 98%, при 0,1 мг – 72%, со средней относительной ошибкой соответственно 41% и 15,3%. Ионы меди (II) определяются в пределах 0,1-1 мг. Граница определения 0,1 мг. 2.Дитизоновый метод. При рН 0,5 и выше фиолотово-красный дитизонат меди экстрагируется хлороформом или четырёх-хлористым углеродом. В сильно кислых средах это соединение экстрагируется очень медленно. В условиях проведения анализа дитизон находится в енольной форме: 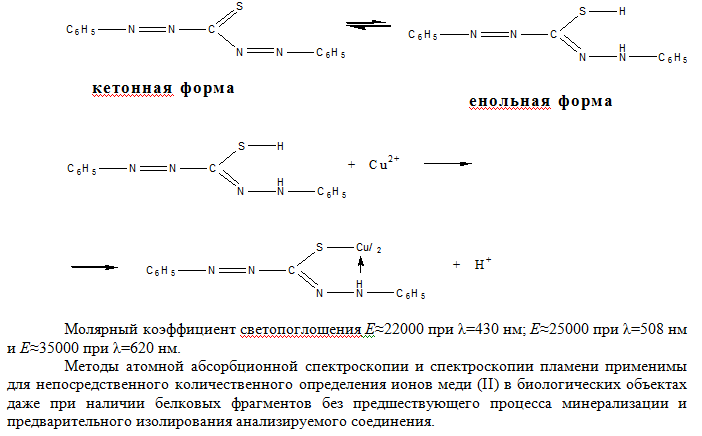 Висмут Среди элементов периодической системы висмут – последний практически не радиоактивный элемент. И он же открывает шеренгу тяжёлых металлов – естественных α-излучателей. Традиционные потребители висмута – металлургическая (лёгкоплавкие сплавы), фармацевтическая (лекарственные средства) и химическая промышленность (красители, пигменты). Последние десятилетия к ним добавилась ядерная техника и электроника. В медицинской практике применяются малорастворимые соединения висмута (алюминаты, карбонаты, галлаты, нитраты, салицилаты, цитраты в виде основных солей), как вяжущие антоцидное средство при лечении язв диареи, сифилиса, дерматитов, эрозии, экземы, бородавок. К лекарственным средствам, содержащим висмут и включённых в номенклатуру разрешённых к применению в Украине препаратов относятся: нитрат висмута основной, ксероформ (триброфенолят висмута основной),дерматол (галлат висмута основной), бисмоверол (основная соль висмута и моновисмутовинной кислоты), пентеабисмол, хинина йодвисмутат. Содержание в крови: концентрация висмута в крови пациентов, лечивших язву желудка и двенадцатипёрстной кишки, находилась в пределах от 0,001 до 0,012 мг/л. Метаболизм и выделение. Малорастворимые соединения висмута принимаемые перорально в значительной степени выводятся с калом. Препараты висмута вводимые в организм в виде инъекции (обычно субсалицилаты, тиогликоляты, тригликоляты, йодвисмутаты, тартраты, цитраты) выводятся мочой в течение нескольких недель. Человеческий мозг, лёгкие и печень содержат менее чем 0,4 мг/кг. Содержание висмута в моче в норме составляет 0,018 мг/л. В то время как при лечении язвы препаратами, содержащими висмут, содержание его в моче составляет 0,480 мг/л. При лечении сифилиса путём введения внутримышечно висмута субсалицилата (60-2100 мг в пересчёте на висмут) и умерших через 1-251 день, содержание элементов в ткани было следующим:
Токсичность. Проявление токсичности висмута подобны тем, которые наблюдаются при отравлении свинцом или ртутью. Усиленное слюноотделение, обесцвечивание языка, дёсен, кожи, боли в абдоминальной полости, тошнота. Повреждение почек является основным результатом приёма завышенной дозы висмута. Однако наблюдается явления энцефалопатии и периферической невропатии. Иногда наблюдается тошнота, рвота и нефротоксичность при внутримышечном введении висмута тиогликолята; причём функція почек возвращалась в норму через несколько недель. Подобная картина наблюдается и при пероральном прийме тригликолямата ви смута. Постоянное употребление субгаллата ви смута перорально, обачно назначаемого при желудочно-кишечных заболеваний, приводит к дрожанию мышц, нарушению координации движения, потери памати, замешательство, раздрожительность и временной потери зрения. В ряде случаев постоянное применши субсалицилата висмута приводит к энцефалопатии, концентрація ви смута в крови при этом составляла 0,072 мг/л. При отравлении висмутом, которое является результатом постоянного и длительного применения субнитрата висмута перорально концентрация его в крови была в пределах от 0,05 до 1,60 мг/л, а в моче – 0,15-10,25 мг/л. Все пациенты, которые выжили в первые 7-14 дней после появлення признакою отравления, не зависимо от пути введения ви смута в организм, поправлялись без особого ущерба для здоровья. Обнаружение висмута в минерализате. Для обнаружения висмута в минерализатах вначале выполняют предварительные реакции на ионы этого металла с тиомочевиной и 8-оксихинолином (о-оксихинолином). При положительном результате этих реакций висмут выделяют из минерализата в виде диэтилдитиокарбамата, который экстрагируют хлороформом. После прибавления кислоты к хлороформной вытяжке происходит разложение диэтидитиокарбамата висмутом. Образовавшиеся при этом ионы висмута переходят в водную фазу, которую используют для обнаружения указанных ионов. Реакция с тиомочевиной. Во время взаимодействия ионов висмута с тиомоевиной могут образовываться различного состава тиомочевинные комплексы, имеющие лимонно-желтую окраску:  Кроме ионов висмута с диэтилдитиокарбаматом натрия образует комплексные соединения и другие ионы, содержащиеся в минерализате. Для маскировки этих ионов добавляют раствор трилона Б (комплексона (III)). образовавшийся комплекс диэтилдитиокарбамата висмута экстрагируют хлороформом, затем разлагают азотной кислотой. Висмут при этом переходит в водную фазу в виде Bi(NO3)3. Хлороформный слой отбрасывают. При дальнейших исследованиях необходимо учитывать, что разбавление водой минерализата приводит к гидролизу нитрата висмута, который в виде белого аморфного соединения выпадает в осадок: 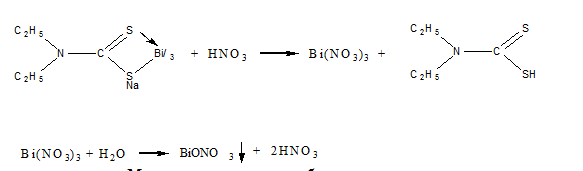 4.Тест Рейнша. Методика теста. Методика теста применяется для обнаружения висмута в моче, содержимом желудка и остатках веществ с места происшествия. При нагревании медной пластинки, предварительно очищенной азотной кислотой, с анализируемым раствором в присутствии концентрированной хлороводородной кислоты её поверхность окрашивается в блестящий черный цвет при наличии паров висмута в исследуемом объекте. Чувствительность теста – 2 мг/л. Если на поверхность, почерневшей в процессе теста медной пластинки, нанести реактив, содержащий хини и иодид калия, висмут медленно образует оранжево-коричневую суспензию. 5.Реакция с цинхонином и иодидом калия. Многие, преимущественно одноосновные органические соединения, и среди них цинхонин, образует в слабокислых растворах солей висмута и иодида калия нерастворимые двойные иодиды с общей формулой BiI3•B•HI, где В – молекула цинхонина. На фильтровальную бумагу, пропитанную раствором цинхонина (один из алкалоидов хинного дерева) помещают каплю слабокислого анализируемого раствора. Образование оранжево-красного пятна указывает на присутствие ионов висмута. Предел обнаружения 0,14 мкг. 6.Люминисценция в водородном пламени. Водородное пламя вызывает васильково-синее свечение ионов висмута. Метод позволяет обнаружить весьма небольшие количества висмута, если анализируемый образец предварительно смещать с карбонатом щелочноземельного металла и смесь внести в пламя. Предел обнаружения – 0,004 мкг. 7.Реакция с тиоциоатом хром-калия. Минеральнокислые растворы солей висмута, взаимодействуя с гексатиоцианатохромато (III) калия K3[Cr(SCN)6], дают нерастворимый кирпично-красный осадок гексатиоцианатохромато (III) висмута  Bi3++[Cr(SCN)6]3- K3[Cr(SCN)6]↓ Bi3++[Cr(SCN)6]3- K3[Cr(SCN)6]↓На фильтровальную бумагу наносят каплю анализируемого раствора, высушивают и добавляют каплю спиртового раствора реагента. Вновь высушивают и добавляют каплю разбавленной (1:2) серной кислоты. В зависимости от содержания висмута образуется кирпично-красно пятно или кольцо. Предел обнаружения 0,4 мкг. 8.Соосаждение ионов висмута с тиоционатом свинца. Ионы висмута соосаждаются с тиоционатом свинца, давая коричневый или оранжевый осадок, состоящий изсмеси кристаллических Pb(SCN)2 и Pb3[Bi(SCN)6]2. На этом основана капельная реакция на ионы висмута. Предел обнаружения 0,05 мкг. Дополнительные реакции обнаружения ионов висмута в минерализате. 1.Реакция обнаружения ионов висмута с щелочным раствором станита и добавлением солей свинца. Окислительно-восстановительная реакция протекает настолько быстро, что при смешивании на капельной пластинке анализируемого раствора с каплей щелочного раствора станита сразу же появляется осадок металлического висмута в виде чёрного пятна: 2.Реакция обнаружения ионов висмута с йодидом калия. При добавлении к анализируемому раствору йодида калия образуется чёрно-бурый осадок BiI3, который при кипячении превращается в BiOI красного цвета. 3.Реакция обнаружения ионов висмута путём экстрагирования йодида висмута. При экстрагировании йодида висмута из кислых растворов в присутствии йодида щелочного металла изобутилкетоном экстракт окрашивается в жёлтый цвет. Предел обнаружения 1 мкг. Количественное определение. Методы количественного определения основаны на выделении ионов висмута из минерализата экстракцией в виде Bi(ДДТК)3 в щелочной среде, с последующей реэкстракцией в водный слой азотной кислотыи определении: Объёмный метод. Комплесонометрическое титрование. Титрование ионов висмута раствором динатриевой соли этилен-диамино-тетрауксусной кислоты (ЭДТА) проводится с использованием в качестве индикатора йодидов, которые с ионами висмута образуют при рН 1,5-2,0 окрашенной в оранжевый цвет комплекс – [BiI4]–. В точке конца титрования оранжевый раствор обесцвечивается. При титровании ионов висмута раствором ЭДТА в качестве индикатора можно использовать пирокатехиновый фиолетовый (или тиомочевину) при рН от 2,0 до 3,0. В точке конца титрования цвет раствора меняется от синего до лимонно-жёлтого (или от жёлтого до обесцвечивания). Граница определения 1 мг. Фотометрические методы. 1. Определение ионов висмута по тиомочевинному комплексу. В разбавленном растворе сильной кислоты ионы висмута образуют с тиомечевиной комплекс жёлтого цвета. Окраска устойчива в течение 1 часа. Оптическая плотность раствора измеряется при 470 нм. Граница определения 0,1 мг. 2. Определение ионов висмута по дитизоновому комплексу. В делительную воронку вносят азотнокислый раствор ионов висмута, который доводят до рН 8,5-9,0 с помощью аммиака. К смеси лобпвляют хлороформный раствор дитизона и смесь тщательно взбалтывают. Слой органического растворителя отделяют и оптическую плотность окрашенного в оранжевый цвет дитизоната висмута определяют при 505 нм. 3. Определение ионов висмута по комплексу с диэтилдитиокарбоматом натрия. Экстракция ионов висмута четыреххлористым углеродом в аммиачной среде в виде его комплекса с диэтилдитиокарбоматом натрия – метод специфичный для висмута. Получается внутрикомплексное соединение желтого цвета. Оптическую плотность слоя органического растворителя, содержащего диэтилдитиокарбомат висмута, определяют при 400 нм. 4. Определение ионов висмута по комплексу с иодидом калия. При добавлении избытка иодида калия к кислому раствору ионов висмута образуется желтая окраска – K[BiI4]. Измерение оптической плотности проводят при 465 нм. Для анализа висмута в биологических объектах на уровне следов используются методы пламенной атомной абсорбционной спектроскопии, атомно-эмиссионной спектроскопии, эмиссионной пламенной спектроскопии. КАДМИЙ. КАДМИЙ. Распространение и применение. В 1818 году немецкий химик и фармацевт, профессор Теттингенского университета опубликовал подробные сведения о новом химическом элементе – кадмии, который занимает в периодической системе элементов Д.И. Менделеева №48. Кадмий применяется в промышленности при добыче легкоплавких сплавов, замене висмута в типографическом шрифте или замене олова при эмалировке посуды. Оксид кадмия, соли кадмия и сплавы используются в производстве сухих никелево-кадмиевых аккумуляторов и батареек, при паянии и изготовлении светящихся красок и пластиковых красителей. Металлический кадмий используется для изготовления регулировочных стержне в атомных реакторах, потому что хорошо поглощает тепловые нейтроны. Подверженность воздействию кадмия связана с его использованием в промышленности при производстве сплавов, кадмиевом покрытии металлов. При нагревании , размоле, сварке, спайке содержащих кадмий металлических изделий человек вдыхает пыль и пары, что часто является причиной отравления. В основном люди подергаются воздействию соединениями кадмия при приеме пищи, воды, вдыхании воздуха и при курении сигарет (одна пачка в среднем содержит 1,9 мкг кадмия). Ежедневное потребление кадмия организмом в количестве 2-200 мкг в пересчете на металл, считается нормальным. Аккумуляция кадмия организмом человека, начиная от рождения, предположительно способствует возникновению гипертонии. Тем более, в 1968 году в научной литературе появилась статья «Кадмий и сердце». В ней говорилось, что служба здравоохранения США обнаружила зависимость между содержанием кадмия в атмосфере и частотой смертельных случаев от сердечно-сосудистых заболеваний. Предельно допустимая концентрация для кадмия в воздухе в виде пыли или дыма не должна превышать 0,01 мг/м3, тем более, что это соединение отнесено к канцерогенным веществам. Концентрация в крови. Концентрация кадмия в сыворотке крови, у людей которые не подвергаются его воздействию, находится в пределах от 0,5 до 2,0 мкг/л. содержание кадмия в цельной крови вдвое больше. При этом не наблюдалось разницы в зависимости от пола и возраста человека. Содержание кадмия в крови у курящих людей 1,1 мкг/л, а у некурящих – 0,4 мкг/л. Концентрация кадмия у рабочих, подвергавшихся воздействию данным металлом и не имеющих признаков отравления – 9,0 мкг/л. Концентрация в крови у рабочих занятых кадмированием металлов и получением его сплавов в среднем находится в пределах от 1,0 до 113 мкг/л. Метаболизм и выделение. Кадмий, попадающий в организм человека при вдыхании пыли, паров, с продуктами, водой, при курении накапливается в легких, печени, почках и медленно выводится с мочой. Постепенное выведение ионов металла связано с наличием в указанных органах малого белка металлотионеина, который в качестве кофактора имеет ион кадмия. Уровень кадмия в почках хорошо коррелируется с возрастом людей. При исследовании трупов людей, которые обрабатывали минералы, содержащие кадмий, уровень металла в печени в среднем составлял 2,0 мг/кг, в почках – 11,7 мг/кг. Содержание кадмия в моче в норме составляет 0,1-0,2 мкг/мл, но этот показатель увеличивается у курящих людей. В случае если концентрация кадмия в рабочей зоне производственных помещений составляет 0,01 мг/м3 его содержание в моче составляет 3,7 мкг/л. Концентрация кадмия у людей в норме (мг/л или мг/кг)
Токсичность. Индустриальное загрязнение прибрежных вод кадмием приводит к накоплению металла в устрицах, крабах и других морских животных. Это приводит к отравлению кадмием и вызывает болезнь «итай-итай», получившую наиболее широкое распространение в Японии. Повреждение почек ведет к нарушениям метаболизма кальция и фосфора, что вызывает деформацию скелета, тяжелому повреждению нижних конечностей и болям в спине. Исследователи установили, что концентрация кадмия в пределах 100-140 мг/кг в мозговом веществе почек является критической для проявления токсичности кадмия. Попадание кадмия в организм человека с парами и дымом вызывает признаки усталости, кашель, боль в груди, ощущение жжения в горле. Уровень кадмия в моче в этих случаях составляет 10-50 мкг/л. Такая небольшая доза как 4 мг кадмия при попадании в организм человека через дыхательные пути является фатальной. Смертельная доза при пер оральном введении составляет несколько сотен миллиграмм в виде растворимой соли. При этом концентрация металла в печени составляла 128 мг/кг, в печени – 180 мг/кг. КОНЦЕНРТРАЦИЯ КАДМИЯ В ТРУПНОМ МАТЕРИАЛЕ. (мг/л или мг/кг)
Обнаружение кадмия в минерализате Исследование минерализата на наличие ионов кадмия основано на экстракции его хлороформом в виде диэтилдитиокарбамината (ДДТК)2Сd при рН 12. полученное внутрикомплексное соединение разлагают хлороводородной кислотой и наличие ионов кадмия в водном растворе подтверждается химическими реакциями. Выделение ионов кадмия из минерализата. Вначале из минерализата выделяют ионы кадмия, т.к. там помимо исследуемого соединения содержится ряд ионов, которые могут мешать ходу анализа. С этой целью к минерализату прибавляют диэтилдитиокарбамат натрия ДДТК-Na, который с ионами кадмия образует устойчивые внутрикомплексные соединения (ДДТК)2Сd:  С ДДТК-Na образуют комплексные соединения и другие, находящиеся в минерализате ионы(Fe3+, Cu2+, Zn2+). Их влияние устраняют введением сегнетовой соли (тартрат калия-натрия). Введение глицерина в реакционную смесь обеспечивает более полное выделение Сd2+, а прибавление гидроксида натрия – отделение Cd2+ от Zn2+ (образование сравнительно прочного цинката натрия. Образовавшийся (ДДТК)2Сd экстрагируют хлороформом, а затем разлагают хлороводородной кислотой. В солянокислом растворе определяют наличие ионов кадмия следующими реакциями Методы качественного обнаружения ионов кадмия: 1. Реакция с сульфидом натрия. К исследуемому солянокислому раствору добавляют по каплям 2.5н раствор гидроксида натрия до рН=5 (по универсальному индикатору) и свежеприготовленный 5% раствор сульфида натрия. При наличии ионов кадмия в растворе выпадает желтый осадок CdS. Cd2++S2-→CdS↓ Предел обнаружения: 50 мкг ионов кадмия в пробе. Граница обнаружения: 2 мг ионов кадмия в 100 г биологического материала. При отрицательном результате этой реакции дальнейшие исследования водной фазы на наличие ионов кадмия не производят. При положительной реакции дополнительно проверяют наличие ионов кадмия в водной фазе. 2. Реакция с гексацианоферратом (II) калия. Исследуемый раствор с помощью 2.5н раствора гидроксида натрия доводят до рН=5 (по универсальному индикатору) и к смеси добавляют 5% раствор гексацианоферрата (II) калия. При наличии ионов кадмия в растворе выпадает белый осадок. 3Cd2++2[Fe(CN)6]4-+2K+→K2Cd3[Fe(CN)6]2↓ Дополнительные реакции основаны на обнаружении ионов кадмия микрокристаллоскопическими реакциями: 1. Каплю исследуемого раствора наносят на предметное стекло и упаривают досуха, добавляют каплю насыщенного раствора бруцина в разбавленной серной кислоте, каплю 5% раствора бромида калия – в присутствии ионов кадмия образуется бесцветные призматические кристаллы в виде сфероидов. 2. На предметное стекло наносят каплю исследуемого раствора, упаривают досуха и на остаток наносят каплю 5% раствора бромида калия и каплю пиридина – выделяются бесцветные призматические кристаллы в виде сфероидов. Микрокристаллоскопическими реакциями можно обнаружить 0,2 мг кадмия в 100 г биологического материала Количественное определение. 1. Объемный метод. Комплексометрическое титрование ионов кадмия основано на выделении его из минерализата в виде (ДДТК)2Сd, реэкстракции с помощью раствора хлороводородной кислоты в водную фазу и комплексометрическом определении ионов кадмия при индикаторе эрихроме черном Т. Граница определения 1 мг. Фотоколориметрический метод. Дитизоновый метод является наиболее подходящим для определения кадмия в биологическом материале. Дитизонат кадмия, красного цвета, количественно экстрагируется четыреххлористым углеродом при рН 12. точность определения невелика, т.к. дитизонат кадмия не очень устойчив и поэтому превращает комплекс в свободный дитизон, взбалтывая раствор с хлороводордной кислотой. Оптическую плотность дитизона определяют при 620 нм. При количественном определении ионов кадмия в присутствии обычно всех встречающихся вместе с ним элементов (цинк, кобальт, никель, свинец, висмут, серебро и медь) применяется следующий вариант дитизонового метода. Сначала проводят экстракцию дитизоната кадмия из щелочного раствора, затем разрушают дитизонат кадмия, и переводят ионы кадмия в водный раствор обработкой хлороводородной кислотой и затем снова экстрагируют дитизонат кадмия из щелочной среды хлороформом. Оптическую плотность раствора определяют при 520 нм. Следы ионов кадмия определяют методом атомной абсорбционной спектроскопии. Следует обратить внимание на то, что при обнаружении и количественном определении ионов кадмия в объектах исследования обязательным является необходимость наличие и содержание данного металла в лабораторном стекле, реактивах и растворителях. ЦИНК. ЦИНК. Распространение и применение. История цинка не отличается точностью дат. Известно, что в Индии его получали ещё в V веке до нашей эры. Получение металлического цинка описано у римского историка Страбона (60-20 годы до нашей эры). Позже, однако, искусство выплавки цинка в Европе было утрачено. Лишь в 1743 году в Бристоле заработал первый в Европе цинковый завод. Цинк интенсивно используется, как составная часть латуни (сплав цинка с медью), типографского шрифта (сплав цинка, магния и алюминия), при гальванизации металлов. В пиротехнике цинковую пыль применяют, чтобы получить голубое пламя. Цинковая пыль используется в производстве редких и благородных металлов. Главная составная часть краски, используемой для окрашивания крупногабаритных изделий из металла – всё та же цинковая пыль. Оксид цинка нужен не только для получения краски, им широко пользуется стекольная промышленность для увеличения термостойкости стекол. Препараты на основе цинка эффективны при кожных заболеваниях. Селениды, теллуриды, антимониды и арсениды цинка широко применяются в качестве полупроводниковых материалов. Сульфид цинка применяется доя покрытия светящихся экранов телевизоров, осциллографов, рентгеновских аппаратов. Хлорид цинка используется химическими генератами дыма в военных и других целях. Цинк – один из важных биологически активных микроэлементов. Его ежедневная доза для человека составляет 10-15 мг. Он присутствует во многих пищевых продуктах в виде глюконатов. Цинк – обязательная составная часть фермента крови карбоангидразы. Этот фермент ускоряет выделение углекислого газа из легких. Цинк участвует в обмене нуклеиновых кислот и синтезе белков. Со времен Парацельса до наших дней в глазной практике находит применение 0,95% раствор сульфата цинка. Как присыпка издавна применяется стеарат цинка. Фенолсульфонат цинка – хороший антисептик. Суспензия, в которую входит инсулин, протамин и хлорид цинка – эффективное средство против диабета. И вместе с тем многие соединения цинка, прежде всего сульфат и хлорид, токсичны. Предельно допустимая концентрация цинка в промышленной зоне производственных помещений 5 мг/м3. Содержание в крови. Концентрация цинка в сыворотке крови у здоровых людей составляет в среднем 0,83 мг/л. в эритроцитах концентрация цинка составляет 12,25 мг/л. содержание цинка в цельной крови и в её плазме у рабочих занятых на литейном производстве на 46% больше чем у людей контрольной группы, не связанной с производством цинка. Метаболизм и выделение. Приблизительно 20-30% потребляемого цинка всасывается желудочно-кишечным трактом. Из этого количества около 20% выводится из организма человека с мочой и до 60% с фекалиями. Цинк распределяется по всем тканям организма, но больше всего в печени, мышечной ткани и костях. В норме содержание цинка в моче составляет 0,3-0,4 мг/за 24 часа, но у пациентов страдающих протеинурией (выделение белка с мочой) этот показатель более чем 2,1 мг/за 24 часа. При содержании оксида цинка в рабочей зоне производственных помещений на уровне 3-5 мг/м3 его концентрация в моче 0,6-0,7 мг/л. Токсичность. Отравление соединениями цинка – это прежде всего результат острой непреднамеренной интоксикации в силу того, что растворимые соединения цинка вызывают сильную рвоту. При вдыхании пыли или дыма, содержащих мелкодисперсные соединения цинка возникают типичные признаки металлической лихорадки: раздражение дыхательных путей, боль в груди, кашель, похолодание конечностей, слабость, головная боль, тошнота, затрудненное дыхание, мышечные боли. Эти симптомы редко продолжаются более 24 часов и не вызывают фатального исхода. При отравлении оксидом цинка наблюдается умеренное воспаление желудочно-кишечного тракта. Острое отравление оксидами цинка вызывает лихорадку, тошноту, рвоту, диарею, сонливость, мышечные боли, слабость, цианоз, отек легких, острый панкреатит и острую почечную недостаточность, повышение температуры, слизистые оболочки полости рта белого цвета и сморщены. Смерть при этом является результатом острого отека легких, бронхопневмонии и фиброза легочной ткани. Длительный прием пищи, содержащей чрезмерное количество соединений цинка, приводит к сидеробластической анемии, т. е. к чрезмерному увеличению незрелых ядерных клеток красного костного мозга. Описаны случаи хронического отравления при дермальном контакте с хлоридом цинка и возникающих болях в ногах, общей слабости, потери аппетита и потере веса. В ряде случаев Наблюдается явления летаргии, тошнота, рвота и эрозия желудочно-кишечного тракта. Применение ЭДТА кальция в качестве антидота было успешным. Лечение симптоматическое и поддерживающее. Карпозийный гастрит и некроз почек, которые являются следствием попадания хлорида цинка в организм приводит к летальному исходу. Имеются сообщения о случаях смерти после внутривенного введения 7,4 г цинка сульфата в результате возникающей гипотензии, отёка лёгких, рвоте, диареи, желтухи и почечной недостатточности. Обнаружения цинка в минерализате. Обнаружение ионов цинка в минерализате основано на его реакции с дитизоном. При наличии цинка наблюдается изменение зелёной окраски хлороформного слоя в красно-фиолетовый. Чувствительность реакции 2,5•10–5 мг/мл. Реакция позволяет определить цинк в количестве в 5 мг в 100 г биологического материала. 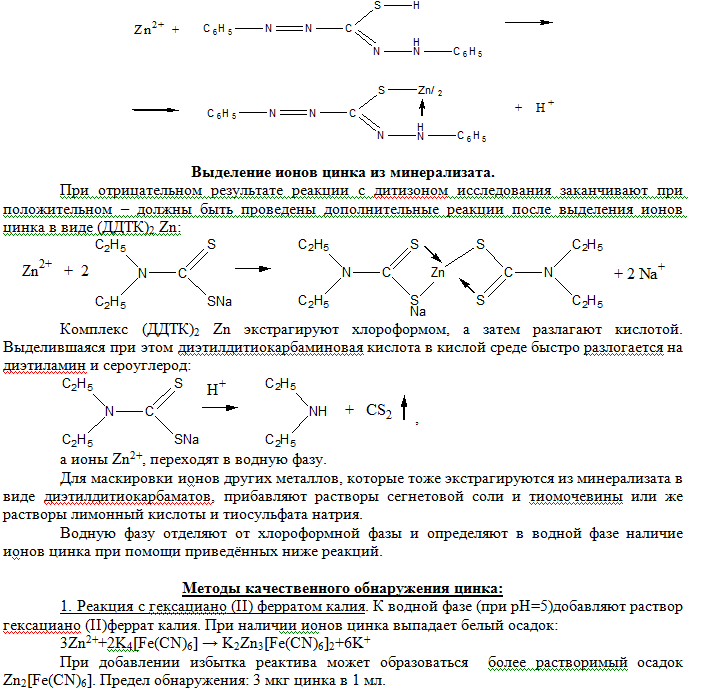 2. Реакция с сульфидом цинка. К водной фазе (рН≈5) добавляют раствор свежеприготовленного сульфида натрия. Образование белого осадка ZnS указывает на наличие ионов цинка в водной фазе. Предел обнаружения: 1,5 мкг цинка в 1 мл. Zn2++S2- → ZnS↓ 3. Реакция с тетрароданомеркуратом аммония. На придметное стекло наносят несколько капель водной фазы, которую выпаривают досуха. К сухому остатку добавляют каплю 10% раствора уксусной кислоты и каплю раствора родано (II) меркурата аммония (NH4)2[Hg(SCN)4]. В присутствии ионов цинка образуются бесцветные одиночные клиновидные кристаллы или дендриты Zn[Hg(SCN)4]: Zn(CH3COO)2+(NH4)2[Hg(SCN)4] → Zn[Hg(SCN)4]↓+2CH3COONH4 Предел обнаружения: 0,2 мг цинка в 1 мл. Дополнительные реакции обнаружения ионов цинка в минерализате. 1. Реакция с раствором резорцина в аммиачной среде. На капельной пластинке смешивают каплю спиртового раствора резорцина с каплей 6н. аммиака и с каплей анализируемого раствора. При наличии ионов цинка в минерализате раствор окрашивается в голубой цвет. Предел обнаружения: 2 мкг в 1 мл. 2. Реакция образования зелени Ринмана. После сжигания кусочка фильтровальной бумаги, смоченной раствором соли цинка и нитрата кобальта получается зола, окрашенная в зеленый цвет: Zn(NO3)2+Co(NO3)2 → CoZnO2+4NO +O2. Предел обнаружения: 0,6 мг в 1 мл. 3. Реакция с роданомеркурат аммонием. Роданомеркурат аммония осаждает из нейтральных или слабокислых растворов солей цинка белый осадок тетрароданомеркуриат цинка: (NH4)2[Hg(SCN)4]+ZN2+→ Zn[Hg(SCN)4]↓+2NH4+ Предел обнаружения: 2 мкг в 1 мл. 4. реакция с двузамещенным фосфатом натрия. Двузамещенный фосфат натрия осаждают из растворов солей цинка в присутствиии гидроксида аммония белый кристаллический осадок: Zn2++NH4OH+Na2HPO4 →ZnNH4PO4↓+NH4++H2O Предел обнаружения: 6 мкг в 1 мл Микрокристаллоскопическое определение ионов цинка. 1. На предметное стекло наносят несколько капель водной фазы, которую выпаривают досуха. На сухой остаток наносят каплю хлорида цезия, каплю хлорида в хлороводородной кислоте. При наличии ионов цинка образуется красная призма – CsZn(AuCI6). 2. Реакция с пикриновой кислотой. На предметное стекло наносят несколько капель водной фазы, которую выпаривают досуха. На сухой остаток наносят несколько капель пикриновой кислоты. При наличии ионов цинка образуются желтые тонкие иглы – (C6H2N3O7)2Zn. Открываемый минимум: 0,2 мкг. 3. Реакция с карбонатом натрия. На предметное стекло наносят несколько капель водной фазы, которую выпаривают досуха. На сухой остаток наносят каплю раствора карбоната натрия. При наличии ионов цинка образуются бесцветные тетраэдры, треугольные призмы – 3Na2CO3 • 8ZnCO3 • H2O. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ. 1. Титрование раствором ЭДТА. Растворы солей цинка можно титровать раствором ЭДТА при рН 4,5, применяя в качестве индикатора дитизон и прибавляя спирт или ацетон для повышения растворимости дитизона и дитизоната цинка. Титруют раствором ЭДТА до перехода окраски из красной в серую. Граница определения 1 мкг. 2. Экстракционное титрование дитизоном. К анализируемому раствору соли цинка прибавляют маленькими порциями титрованный раствор дитизона и сильно взбалтывают. Конец титрования наступает тогда, когда прекращается экстракция красного дитизоната цинка. Это очень чувствительный метод. Точность определения ±1% | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
