Рабочая программа. Рабоча программа по химии 8-9 классы. Министерство образования и науки республики дагестан государственное бюджетное учреждение республики дагестан
 Скачать 186.75 Kb. Скачать 186.75 Kb.
|
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ ДАГЕСТАН ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ УЧРЕЖДЕНИЕ РЕСПУБЛИКИ ДАГЕСТАН «ЦЕНТР НЕПРЕРЫВНОГО ПОВЫШЕНИЯ ПРОФЕССИОНАЛЬНОГО МАСТЕРСТВА ПЕДАГОГИЧЕСКИХ РАБОТНИКОВ»  РАБОЧАЯ ПРОГРАММАПО ХИМИИ (8-9кл) «Реализация образовательных программ естественнонаучной и технологической направленностей по химии с использованием оборудования центра «Точка роста» МАХАЧКАЛА 2021 Для изучения предмета «Химия» на этапе основного общего образования отводится 140 часов: 8 класс ―70 часов; 9 класс ―70 часов. Данная образовательная программа обеспечивает усвоение учащимися важнейших химических законов, теорий и понятий; формирует представление о роли химии в окружающем мире и жизни человека. При этом основное внимание уделяется сущности химических реакций и методам их осуществления. Одним из основных принципов построения программы является принцип доступности. Экспериментальные данные, полученные учащимися при выполнении количественных опытов, позволяют учащимся самостоятельно делать выводы, выявлять закономерности. Подходы, заложенные в содержание программы курса, создают необходимые условия для системного усвоения учащимися основ науки, для обеспечения развивающего и воспитывающего воздействия обучения на личность учащегося. Формируемые знания должны стать основой системы убеждений школьника, центральным ядром его научного мировоззрения. На базе центра «Точка роста» обеспечивается реализация образовательных программ естественно-научной и технологической направленностей, разработанных в соответствии с требованиями законодательства в сфере образования и с учётом рекомендаций Федерального оператора учебного предмета «Химия». Образовательная программа позволяет интегрировать реализуемые подходы, структуру и содержание при организации обучения химии в 8―9 классах, выстроенном на базе любого из доступных учебно-методических комплексов (УМК). Использование оборудования «Точка роста» при реализации данной ОП позволяет создать условия: для расширения содержания школьного химического образования; для повышения познавательной активности обучающихся в естественно-научной области; для развития личности ребёнка в процессе обучения химии, его способностей, формирования и удовлетворения социально значимых интересов и потребностей; для работы с одарёнными школьниками, организации их развития в различных областях образовательной, творческой деятельности. Введение В обучении химии большое значение имеет эксперимент. Анализируя результаты проведённых опытов, учащиеся убеждаются в том, что те или иные теоретические представления соответствуют или противоречат реальности. Только осуществляя химический эксперимент можно проверить достоверность прогнозов, сделанных на основании теории. В процессе экспериментальной работы учащиеся приобретают опыт познания реальности, являющийся важным этапом формирования у них убеждений, которые, в свою очередь, составляют основу научного мировоззрения. Реализация указанных целей возможна при оснащении школьного кабинета химии современными приборами и оборудованием. В рамках национального проекта «Образование» это стало возможным благодаря созданию в общеобразовательных организациях, расположенных в сельской местности и малых городах, центров образования естественно-научной и технологической направленностей «Точки роста». Внедрение этого оборудования позволит качественно изменить процесс обучения химии. Количественные эксперименты позволят получать достоверную информацию о протекании тех или иных химических процессах, о свойствах веществ. На основе полученных экспериментальных данных обучаемые смогут самостоятельно делать выводы, обобщать результаты, выявлять закономерности, что однозначно будет способствовать повышению мотивации обучения школьников. Центры образования естественно-научной направленности «Точка роста» созданы с целью развития у обучающихся естественно-научной, математической, информационной грамотности, формирования критического и креативного мышления, совершенствования навыков естественно-научной направленности, а также для практической отработки учебного материала по учебным предметам «Физика», «Химия», «Биология» . Цель и задачи Реализация основных общеобразовательных программ по учебным предметам естественно-научной направленности, в том числе в рамках внеурочной деятельно сти обучающихся; разработка и реализация разноуровневых дополнительных общеобразовательных программ естественно-научной направленности, а также иных программ, в том числе в каникулярный период; вовлечение учащихся и педагогических работников в проектную деятельность; организация внеучебной деятельности в каникулярный период, разработка и реализация соответствующих образовательных программ, в том числе для лагерей, организованных образовательными организациями в каникулярный период; повышение профессионального мастерства педагогических работников центра, реализующих основные и дополнительные общеобразовательные программы; Создание центра «Точка роста» предполагает развитие образовательной инфраструктуры общеобразовательной организации, в том числе оснащение общеобразовательной организации: оборудованием, средствами обучения и воспитания для изучения (в том числе экспериментального) предметов, курсов, дисциплин (модулей) естественно-научной направленности при реализации основных общеобразовательных программ и дополнительных общеобразовательных программ, в том числе для расширения содержания учебных предметов «Физика», «Химия», «Биология»; оборудованием, средствами обучения и воспитания для реализации программ дополнительного образования естественно-научной направленности; компьютерным и иным оборудованием. Профильный комплект оборудования может быть выбран для общеобразовательных организаций, имеющих на момент создания центра «Точка роста» набор средств обучения и воспитания, покрывающий своими функциональными возможностями базовые потребности при изучении учебных предметов «Физика», «Химия» и «Биология» . Перечень, минимально необходимые функциональные и технические требования и минимальное количество оборудования, расходных материалов, средств обучения и воспитания для оснащения центров «Точка роста», определяются Региональным координатором с учётом Примерного перечня оборудования, расходных материалов, средств обучения и воспитания для создания и обеспечения функционирования центров образования естественно-научной направленности «Точка роста» в общеобразовательных организациях, расположенных в сельской местности и малых городах. Профильный комплект оборудования обеспечивает эффективное достижение образовательных результатов обучающимися по программам естественно-научной направленности, возможность углублённого изучения отдельных предметов, в том числе для формирования изобретательского, креативного, критического мышления, развития функциональной грамотности у обучающихся, в том числе естественно-научной и математической. Эксперимент является источником знаний и критерием их истинности в науке. Концепция современного образования подразумевает, что в учебном эксперименте ведущую роль должен занять самостоятельный исследовательский ученический эксперимент. Современные экспериментальные исследования по химии уже трудно представить без использования не только аналоговых, но и цифровых измерительных приборов. В Федеральном Государственном Образовательном Стандарте (ФГОС) прописано, что одним из универсальных учебных действий, приобретаемых учащимися, должно стать умение «проведения опытов, простых экспериментальных исследований, прямых и косвенных измерений с использованием аналоговых и цифровых измерительных приборов». Учебный эксперимент по химии, проводимый на традиционном оборудовании, без применения цифровых лабораторий, не может позволить в полной мере решить все задачи в современной школе. Это связано с рядом причин: традиционное школьное оборудование из-за ограничения технических возможностей не позволяет проводить многие количественные исследования; длительность проведения химических исследований не всегда согласуется с длительностью учебных занятий; возможность проведения многих исследований ограничивается требованиями техники безопасности и др. Цифровая лаборатория полностью меняет методику и содержание экспериментальной деятельности и решает вышеперечисленные проблемы. Широкий спектр датчиков позволяет учащимся знакомиться с параметрами химического эксперимента не только на качественном, но и на количественном уровне. Цифровая лаборатория позволяет вести длительный эксперимент даже в отсутствие экспериментатора, а частота их измерений неподвластна человеческому восприятию. В процессе формирования экспериментальных умений ученик обучается представлять информацию об исследовании в четырёх видах: в вербальном: описывать эксперимент, создавать словесную модель эксперимента, фиксировать внимание на измеряемых величинах, терминологии; в табличном: заполнять таблицы данных, лежащих в основе построения графиков (при этом у учащихся возникает первичное представление о масштабах величин); в графическом: строить графики по табличным данным, что даёт возможность перехода к выдвижению гипотез о характере зависимости между величинами (при этом учитель показывает преимущество в визуализации зависимостей между величинами, наглядность и многомерность); в виде математических уравнений: давать математическое описание взаимосвязи величин, математическое обобщение. Переход от каждого этапа представления информации занимает довольно большой промежуток времени. В 7―8 классах этот процесс необходим, но в старших классах можно было бы это время потратить на решение более важных задач. В этом плане цифровые лаборатории существенно экономят время. Это время можно потратить согласно ФГОС на формирование исследовательских умений учащихся, которые выражаются в следующих действиях: определение проблемы; постановка исследовательской задачи; планирование решения задачи; построение моделей; выдвижение гипотез; экспериментальная проверка гипотез; анализ данных экспериментов или наблюдений; формулирование выводов. Последние годы у учащихся наблюдается низкая мотивация изучения естественно-научных дисциплин и как следствие падение качества образования. Поставляемые в школы современные средства обучения, в рамках проекта «Точка роста» содержат как уже хорошо известное оборудование, так и принципиально новое. Это цифровые лаборатории и датчиковые системы. В основу образовательной программы заложено применение цифровых лабораторий. Тематика предложенных экспериментов, количественных опытов соответствует структуре примерной образовательной программы по химии, содержанию Федерального государственного образовательного стандарта (ФГОС) среднего (полного) общего образования. Рассмотренные в пособии опыты прошли широкую апробацию. Многолетняя практика использования химических приборов, ЦЛ в школе показала, что современные технические средства обучения нового поколения позволяют добиться высокого уровня усвоения учебного материала, устойчивого роста познавательного интереса школьников, т.е. преодолеть те проблемы, о которых так много говорят, когда речь заходит о современном школьном химическом образовании. Данное методическое пособие адресовано учителям химии, которые реализуют образовательные программы с использованием оборудования «Точка роста». Нормативная база Федеральный закон от 29.12.2012 № 273-ФЗ (ред. от 31.07.2020) «Об образовании в Российской Федерации» (с изм. и доп., вступ. в силу с 01.09.2020). — URL: http://www.consultant.ru/document/cons_doc_LAW_140174 (дата обращения: 28.09.2020) Паспорт национального проекта «Образование» (утв. президиумом Совета при Президенте РФ по стратегическому развитию и национальным проектам, протокол от 24.12.2018 № 16). — URL: https://login.consultant.ru link ?req=doc&base=LAW&n=319308&demo=1 (дата обращения: 10.03.2021) Государственная программа Российской Федерации «Развитие образования» (утверждена постановлением Правительства РФ от 26.12.2017 № 1642 (ред. от 22.02.2021) «Об утверждении государственной программы Российской Федерации «Развитие образования». — URL: http://www.consultant.ru/document/cons_doc_LAW_286474/cf742885e783e08d938 7d7364e34f26f87ec138f (дата обращения: 10.03.2021) Профессиональный стандарт «Педагог (педагогическая деятельность в дошкольном, начальном общем, основном общем, среднем общем образовании), (воспитатель, учитель)» (ред. от 16.06.2019 г.) (Приказ Министерства труда и социальной защиты РФ от 18 октября 2013г. № 544н, с изменениями, внесёнными приказом Министерства труда и соцзащиты РФ от 25 декабря 2014 г. № 1115н и от 5 августа 2016 г. № 422н). — URL: // http://профстандартпедагога.рф (дата обращения: 10.03.2021) Профессиональный стандарт «Педагог дополнительного образования детей и взрослых» (Приказ Министерства труда и социальной защиты РФ от 5 мая 2018 г. № 298н «Об утверждении профессионального стандарта «Педагог дополнительного образования детей и взрослых»). — URL: //https://profstandart.rosmintrud.ru/obshchiy-infor- matsionnyy-blok/natsionalnyy-reestr-professionalnykh-standartov/reestr-professionalnykh- standartov/index.php? ELEMENT_ID=48583 (дата обращения: 10.03.2021) Федеральный государственный образовательный стандарт основного общего образования (утверждён приказом Министерства образования и науки Российской Федерации от 17 декабря 2010 г. № 1897) (ред.21.12.2020). — URL: https://fgos.ru (дата обращения: 10.03.2021) Федеральный государственный образовательный стандарт среднего общего обраования (утверждён приказом Министерства образования и науки Российской Федерации от 17 мая 2012 г. № 413) (ред.11.12.2020). — URL: https://fgos.ru (дата обращения: 10.03.2021) Методические рекомендации по созданию и функционированию детских технопарков «Кванториум» на базе общеобразовательных организаций (утверждены распоряжением Министерства просвещения Российской Федерации от 12 января 2021 г. № Р-4). — URL: http://www.consultant.ru/document/cons_doc_LAW_374695 (дата обращения: 10.03.2021) Методические рекомендации по созданию и функционированию центров цифрового образования «IT-куб» (утверждены распоряжением Министерства просвещения Российской Федерации от 12 января 2021 г. № Р-5). — URL: http://www.consultant.ru/ document/cons_doc_LAW_374572 (дата обращения: 10.03.2021) Методические рекомендации по созданию и функционированию в общеобразовательных организациях, расположенных в сельской местности и малых городах, центров образования естественно-научной и технологической направленностей («Точка роста») (утверждены распоряжением Министерства просвещения Российской Федерации от 12 января 2021 г. № Р-6). — URL: http://www.consultant.ru/document/cons_doc_ LAW_374694/ (дата обращения: 10.03.2021 Планируемые результаты освоения учебного предмета «Химия» с описанием универсальных учебных действий, достигаемых обучающимися Личностные результаты Обучающийся получит возможность для формирования следующих личностных УУД: определение мотивации изучения учебного материала; оценивание усваиваемого учебного материала, исходя из социальных и личностных ценностей; повышение своего образовательного уровня и уровня готовности к изучению основных исторических событий, связанных с развитием химии и общества; знание правил поведения в чрезвычайных ситуациях; оценивание социальной значимости профессий, связанных с химией; владение правилами безопасного обращения с химическими веществами и оборудованием, проявление экологической культуры. Метапредметные результаты Регулятивные Обучающийся получит возможность для формирования следующих регулятивных УУД: целеполагание, включая постановку новых целей, преобразование практической задачи в познавательную, самостоятельный анализ условий достижения цели на основе учёта выделенных учителем ориентиров действия в новом учебном материале; планирование пути достижения целей; установление целевых приоритетов, выделение альтернативных способов достижения цели и выбор наиболее эффективного способа; умение самостоятельно контролировать своё время и управлять им; умение принимать решения в проблемной ситуации; постановка учебных задач, составление плана и последовательности действий; организация рабочего места при выполнении химического эксперимента; прогнозирование результатов обучения, оценивание усвоенного материала, оценка качества и уровня полученных знаний, коррекция плана и способа действия при необходимости. Познавательные Обучающийся получит возможность для формирования следующих познавательных УУД: поиск и выделение информации; анализ условий и требований задачи, выбор, сопоставление и обоснование способа решения задачи; выбор наиболее эффективных способов решения задачи в зависимости от конкретных условий; выдвижение и обоснование гипотезы, выбор способа её проверки; самостоятельное создание алгоритма деятельности при решении проблем творческого и поискового характера; умения характеризовать вещества по составу, строению и свойствам; описывание свойств: твёрдых, жидких, газообразных веществ, выделение их существенных признаков; изображение состава простейших веществ с помощью химических формул и сущности химических реакций с помощью химических уравнений; проведение наблюдений, описание признаков и условий течения химических реакций, выполнение химического эксперимента, выводы на основе анализа наблюдений за экспериментом, решение задач, получение химической информации из различных источников; умение организовывать исследование с целью проверки гипотез; умение делать умозаключения (индуктивное и по аналогии) и выводы; умение объективно оценивать информацию о веществах и химических процессах, критически относиться к псевдонаучной информации. Коммуникативные Обучающийся получит возможность для формирования следующих коммуникативных УУД: полное и точное выражение своих мыслей в соответствии с задачами и условиями коммуникации; адекватное использование речевых средств для участия в дискуссии и аргументации своей позиции, умение представлять конкретное содержание с сообщением его в письменной и устной форме, определение способов взаимодействия, сотрудничество в поиске и сборе информации; определение способов взаимодействия, сотрудничество в поиске и сборе информации, участие в диалоге, планирование общих способов работы, проявление уважительного отношения к другим учащимся; описание содержания выполняемых действий с целью ориентировки в предметно- практической деятельности; умения учитывать разные мнения и стремиться к координации различных позиций в сотрудничестве; формулировать собственное мнение и позицию, аргументировать и координировать её с позициями партнёров в сотрудничестве при выработке общего решения в совместной деятельности; осуществлять взаимный контроль и оказывать в сотрудничестве необходимую взаимопомощь; планировать общие способы работы; осуществлять контроль, коррекцию, оценку действий партнёра, уметь убеждать; использовать адекватные языковые средства для отображения своих чувств, мыслей, мотивов и потребностей; отображать в речи (описание, объяснение) содержание совершаемых действий, как в форме громкой социализированной речи, так и в форме внутренней речи; развивать коммуникативную компетенцию, используя средства устной и письменной коммуникации при работе с текстами учебника и дополнительной литературой, справочными таблицами, проявлять готовность к уважению иной точки зрения при обсуждении результатов выполненной работы. Предметные результаты Обучающийся научится: применять основные методы познания: наблюдение, измерение, эксперимент; описывать свойства твёрдых, жидких, газообразных веществ, выделяя их существенные признаки; раскрывать смысл закона сохранения массы веществ, атомно-молекулярной теории; различать химические и физические явления, называть признаки и условия протекания химических реакций; соблюдать правила безопасной работы при проведении опытов; пользоваться лабораторным оборудованием и посудой; получать, собирать газообразные вещества и распознавать их; характеризовать физические и химические свойства основных классов неорганических соединений, проводить опыты, подтверждающие химические свойства изученных классов неорганических веществ; раскрывать смысл понятия «раствор», вычислять массовую долю растворённого вещества в растворе, готовить растворы с определённой массовой долей растворённого вещества; характеризовать зависимость физических свойств веществ от типа кристаллической решётки, определять вид химической связи в неорганических соединениях; раскрывать основные положения теории электролитической диссоциации, составлять уравнения электролитической диссоциации кислот, щелочей, солей и реакций ионного обмена; раскрывать сущность окислительно-восстановительных реакций, определять окислитель и восстановитель, составлять уравнения окислительно-восстановительных реакций; называть факторы, влияющие на скорость химической реакции; характеризовать взаимосвязь между составом, строением и свойствами неметаллов и металлов; проводить опыты по получению и изучению химических свойств различных веществ; грамотно обращаться с веществами в повседневной жизни. Обучающийся получит возможность научиться: выдвигать и проверять экспериментально гипотезы о химических свойствах веществ на основе их состава и строения, их способности вступать в химические реакции, о характере и продуктах различных химических реакций; характеризовать вещества по составу, строению и свойствам, устанавливать причинно-следственные связи между данными характеристиками вещества; составлять молекулярные и полные ионные уравнения по сокращённым ионным уравнениям; прогнозировать способность вещества проявлять окислительные или восстановительные свойства с учётом степеней окисления элементов, входящих в его состав; выдвигать и проверять экспериментально гипотезы о результатах воздействия различных факторов на изменение скорости химической реакции; использовать приобретённые знания для экологически грамотного поведения в окружающей среде; использовать приобретённые ключевые компетенции при выполнении проектов и решении учебно-исследовательских задач по изучению свойств, способов получения и распознавания веществ; объективно оценивать информацию о веществах и химических процессах; осознавать значение теоретических знаний по химии для практической деятельности человека; создавать модели и схемы для решения учебных и познавательных задач; понимать необходимость соблюдения предписаний, предлагаемых в инструкциях по использованию лекарств, средств бытовой химии и др. Формы контроля Контроль результатов обучения в соответствии с данной ОП проводится в форме письменных и экспериментальных работ, предполагается проведение промежуточной и итоговой аттестации. Промежуточная аттестация Для осуществления промежуточной аттестации используются контрольно-оценочные материалы, отбор содержания которых ориентирован на проверку уровня усвоения системы знаний и умений — инвариантного ядра содержания действующих образовательной программы по химии для общеобразовательных организаций. Задания промежуточной аттестации включают материал основных разделов курса химии. Вариант работы по теме «Теория электролитической диссоциации» К хорошо растворимым электролитам относятся: гидроксид цинка 3) сульфид бария фосфат цинка 4) карбонат бария  Ответ: Ответ:Наибольшее число ионов образуется при растворении 1 моль вещества: хлорида калия 3) хлорида железа (III) хлорида бария 4) сульфата железа (III) Ответ: Вставьте пропущенное слово. Концентрированный раствор некоторого вещества не проводит электрический ток. При добавлении к концентрированному раствору двукратного объёма воды электропроводность раствора немного увеличилась. При дальнейшем добавлении воды электропроводность сначала увеличилась, а затем перестала изменяться. Вещество относится кэлектролитам. В 1 л воды растворены 1 моль хлорида калия и 1 моль иодида натрия. Из каких двух других солей можно приготовить раствор такого же состава? Выберите из перечня: хлорид натрия; нитрат калия; иодид калия; нитрат натрия; сульфат натрия. Запишите номера выбранных ответов. Ответ: Установите соответствие между признаками реакций и исходными веществами: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами. Ответ: Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции: Fe2+ + 2OH– = Fe(OH)2 FeO 3) FeCl2 5) Н2O Fe 4) KOH 6) FeCl3 Запишите номера выбранных ответов. Ответ: При применении цинка в качестве микроудобрения его вносят из расчёта 4 кг кристаллогидрата сульфата цинка ZnSO4 ∙ 7H2O на гектар. Сколько это составляет в пересчёте на ионы Zn2+? Запишите число с точностью до целых. Ответ:г. Что общего в растворах, имеющих кислотную среду? (Краткий ответ.) Критерии оценивания работы по химии Верное выполнение каждого из заданий 1―3, 8 оценивается 1 баллом. За полный правильный ответ на каждое из заданий 4 ―7 ставится 2 балла; если допущена одна ошибка, то ответ оценивается в 1 балл. Если допущены две и более ошибки или ответа нет, то выставляется 0 баллов.
*Порядок следования цифр в ответе не имеет значения. Итоговая аттестация Для осуществления итоговой аттестации используются КИМы, содержание которых ориентировано на проверку уровня усвоения знаний и определяется системой требований к подготовке выпускников основной школы. Эта система инвариантна по отношению ко всем действующим ОП по химии для общеобразовательных организаций. Задания итоговой аттестации включают материал основных разделов курса химии. Работа состоит из двух частей. Часть 1 содержит 19 заданий с кратким ответом, подразумевающих самостоятельное формулирование и запись ответа в виде числа или последовательности цифр. Часть 2 содержит 5 заданий: 3 задания этой части подразумевают запись развёрнутого ответа, 2 задания этой части предполагают выполнение реального химического эксперимента и оформление его результатов. Контрольно-оценочные материалы Вариант письменной работы для итоговой аттестации Часть 1
Выберите два высказывания, в которых говорится о меди как химическом элементе. Медь реагирует с хлором. Медь при нагревании на воздухе окисляется. Сплавы меди и золота используются для изготовления ювелирных украшений. В состав бордосской жидкости входит медь. В состав медной патины входит медь. Запишите номера выбранных ответов.  Ответ: Ответ: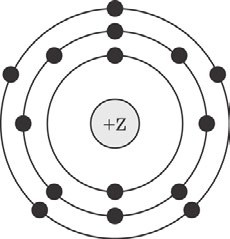 На приведённом рисунке изображена модель атома химического элемента. На приведённом рисунке изображена модель атома химического элемента.Запишите в таблицу величину заряда ядра (Х) атома химического элемента, модель которого изображена на рисунке, и номер группы (Y), в которой этот элемент расположен в Периодической системе. (Для записи ответа используйте арабские цифры.) Ответ: Расположите в порядке увеличения электроотрицательности химические элементы: 1) кислород; 2) кремний; 3) фосфор. Запишите номера элементов в соответствующем порядке.  Ответ: Ответ:Установите соответствие между формулой соединения и степенью окисления серы в этом соединении: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Ответ: Из предложенного перечня выберите два вещества с ионной связью: LiCl; OF2; SO2; CaF2; H2O. Запишите номера выбранных ответов. Ответ: Какие два утверждения верны для характеристики кремния и фосфора? Электроны в атоме расположены на трёх электронных слоях. Соответствующее простое вещество существует в виде четырёхатомных молекул. Химический элемент относится к металлам. Значение электроотрицательности меньше, чем у фосфора. Химический элемент образует высшие оксиды с общей формулой ЭО2. Запишите номера выбранных ответов. Ответ: Из предложенного перечня веществ выберите основный оксид и кислоту: CаO; Mg(OH)2; SO2; NaClO4; HСlO4. Запишите в поле ответа сначала номер кислотного оксида, а затем номер основания. Ответ: Какие два из перечисленных веществ будут вступать в реакцию с оксидом цинка? Fe(OH)2; HNO3; 3) O2; KOH; S. Запишите номера выбранных ответов. Ответ: Установите соответствие между реагирующими веществами и продуктами(ом) их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами. Ответ: Установите соответствие между формулой вещества и реагентами, с которыми это вещество может вступать в реакцию: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами. Ответ: Из предложенного перечня выберите две пары веществ, между которыми протекает реакция замещения: цинк и соляная кислота; оксид углерода (VI) и оксид натрия; оксид цинка и соляная кислота; железо и хлорид меди (II); натрий и водород. Запишите номера выбранных ответов.  Ответ: Ответ:Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами. Ответ: Выберите два вещества, при полной диссоциации 1 моль которых образуется 3 моль анионов: нитрат калия; гидроксид бария; хлорид железа (III); фосфат калия; сульфат алюминия. Запишите номера выбранных ответов.  Ответ: Ответ:Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции: Cu2+ + 2OH– = Cu(OH)2 СuО 4) KOH Cu 5) Н2O CuCl2 6) Fe(OH)3 Запишите номера выбранных ответов.  Ответ: Ответ:Установите соответствие между схемой процесса, происходящего в окислительно- восстановительной реакции, и названием этого процесса: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами. Ответ: Из перечисленных суждений о правилах работы с веществами в лаборатории и быту выберите верное(ые) суждение(я). Зажжённую спиртовку нельзя переносить с одной парты на другую. При попадании на кожу капель кислоты нужно забинтовать этот участок кожи. При нагревании раствора пробирку с жидкостью держат под углом в 45° и направляют горлышко в сторону от людей. Работу с концентрированными растворами щелочи следует проводить в резиновых перчатках. Запишите в поле ответа номер(а) верного(ых) суждения(й). Ответ:. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами. Ответ:
Вычислите в процентах массовую долю азота в мочевине СО(NH2)2. Запишите число с точностью до целых. Ответ:%. Раствор мочевины с массовой долей 0,1% используется в качестве внекорневой подкормки томатов. При подкормках на растения наносится 20 г азота на 100 м2. Сколько граммов мочевины нужно затратить на земельный участок такой площадью? Запишите число с точностью до целых. Ответ:г. Часть 2 Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой: SO2 + I2 + H2O → HI + H2SO4 Определите окислитель и восстановитель. Дана схема превращений: СaCl2 → CaCO3 → Х→ Сa(OH)2 Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции. При добавлении к раствору гидроксида калия с массовой долей щелочи 10% избытка раствора нитрата меди (II) образовался осадок массой 9,8 г. Определите массу исходного раствора щелочи. Практическая часть Дан раствор сульфата магния, а также набор следующих реактивов: цинк; соляная кислота; растворы гидроксида натрия, хлорида бария и нитрата калия. Используя только реактивы из приведённого перечня, запишите молекулярные уравнения двух реакций, которые характеризуют химические свойства сульфата магния, и укажите признаки их протекания (запах газа, цвет осадка или раствора). Проведите химические реакции между сульфатом магния и выбранными веществами в соответствии с составленными уравнениями реакции, соблюдая правила техники безопасности, приведённые в инструкции к заданию. Проверьте, правильно ли указаны в ответе на задание 23 признаки протекания реакций. При необходимости дополните ответ или скорректируйте его. Критерии оценки Система оценивания работы по химии Часть 1 Верное выполнение каждого из заданий 1―3, 5―8, 11, 13―16, 18, 19 оценивается 1 баллом. За полный правильный ответ на каждое из заданий 4, 9, 10, 12 и 17 ставится 2 балла; если допущена одна ошибка, то ответ оценивается в 1 балл. Если допущены две и более ошибки или ответа нет, то выставляется 0 баллов.
*Порядок следования цифр в ответе не имеет значения. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||



