Химия задача. Решение в данном соединении комплексообразователь Fe
 Скачать 183.02 Kb. Скачать 183.02 Kb.
|
|
Для образования трех одинаковых связей В-Н необходима гибридизация одного 2s и двух 2р-орбиталей - sp2-гибридизация с образованием трех гибридных орбиталей, расположенных в одной плоскости под углом 1200 относительно друг друга: Образованные гибридные орбитали перекрываются с s-орбиталями атома водорода с образованием трех -связей: Молекула ВН3 имеет плоское треугольное строение. Для определения полярности связей В–Н сравним значения ОЭО атомов В и Н; ОЭО(В) = 2,0; ОЭО(Н) = 2,1. Поскольку электроотрицательность водорода больше, то связь В–Н будет полярной. Однако в целом молекула ВН3 не обладает полярностью, так как полярность связей В–Н, направленных к вершинам правильного треугольника, взаимно компенсируется. Таким образом, в образовании молекулы ВН3 принимают участие s-орбитали атома Н и sp2-гибридные орбитали бора. Молекула ВН3 не полярна, хотя содержит три полярные -связи, имеет плоскую треугольную структуру. Атом В находится в состоянии sp2-гибридизации. Пример 2.4. В комплексном соединении K3[Fe(CN)6] отметьте: комплексообразователь, лиганды, внутреннюю и внешнюю сферы. Определите степень окисления комплексообразователя и координационное число. Напишите уравнение диссоциации комплекса. Назовите соединение. 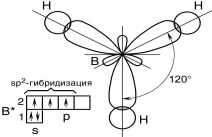 Р е ш е н и е В данном соединении комплексообразователь Fe3+. Степень окисления иона железа определяется исходя из нейтральности соединения в целом и зарядов входящих в него других частиц: К+ и CN ; лиганды - ионы CN; координационное число - 6; внутренняя сфера [Fe(CN)6]3-; внешняя сфера К+. Комплекс диссоциирует в растворе по уравнению: [Fe(CN)6]3- Fe3+ + 6CN В соответствии с правилами ИЮПАК это соединение называется гексацианоферрат (III) калия. Пример 3.1. Реакция горения протекает по уравнению: СН4(г)+2О2(г) = СО2(г)+2Н2О(ж), Qp=ΔrH0298= –890,31 кДж Вычислите, сколько теплоты выделится при сгорании 100 л (н.у.) метана? Р е ш е н и еОбъем одного моля газа VM(г) = 22,4 л/моль. Найдем количество вещества газообразного метана (СН4): n Следовательно, количество теплоты, выделяющееся при сгорании 100 л метана, будет равно Qp=Δ𝑟𝐻2980 · n(СН4) = –890,31 · 4,46 = –3970,78 кДж. Пример 3.2. При соединении 27 г алюминия с кислородом выделилось 836,8 кДж теплоты. Определите энтальпию образования оксида алюминия (Al2O3). Р е ш е н и еДанную задачу можно решить двумя способами: 1) составлением пропорций; 2) используя формулы. Составим уравнение реакции взаимодействия алюминия с кислородом: 2Al(т) + 3/2O2(г) = Al2O3(г) 1). По уравнению реакции видно, что для получения 1 моля Al2O3 необходимо 2 моля атомов Al, что составляет 54 г. Составим пропорцию: при взаимодействии 27 г алюминия – выделится 836,8 кДж 54 г алюминия – выделится Q кДж , следовательно Q = (54·836,8) : 27 = 1673,6 кДж, Δ𝑟𝐻2980 (Al2O3) = – 1673,6 кДж., так как энтальпия обратна по знаку теплоте. 2). Решение задачи, используя формулы. Находим количество вещества Al в 27г: n По уравнению реакции видно, что для получения 1 моля Al2O3 необходимо 2 моля атомов Al, следовательно, количество теплоты, выделяющееся при взаимодействии алюминия с кислородом, будет равно Qp=Δ𝑟𝐻2980 · n(Al) = 836,8 · 2 = 1673,6 кДж, Пример 3.3. Рассчитаете стандартную энтальпию (стандартный тепловой эффект при постоянном давлении) химической реакции: С2Н2 (г) + 3О2(г) = 2СО2(г) + Н2О(ж). Для расчета используем значения стандартной энтальпии для данных веществ из табл. П.1. |
