онкобил. 1. Эпидемиология рака
 Скачать 1.79 Mb. Скачать 1.79 Mb.
|
|
Генетические нарушения в опухолях Опухоли характеризуются широким спектром различных генетических нарушений. Многие онкогены и антионкогены поражаются посредством микромутаций - небольших изменений в последовательности ДНК, проявляющихся микроделециями, микроинсерциями или нуклеотидными заменами (рис. 5.9). Подобный тип нарушений лежит в основе активации онкогенов RAS, BRAF, EGFR, инактивации супрессорного гена р53 и т.д. Большинство опухолей также характеризуется нестабильностью на уровне протяженных участков хромосом, поэтому для новооб-
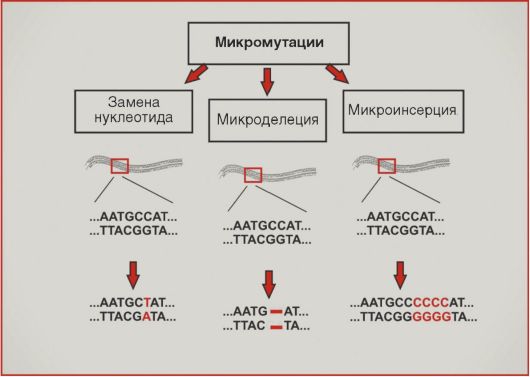 Рис. 5.9. Микромутации Рис. 5.9. Микромутацииразований исключительно типичны нарушения копийности генетического материала (рис. 5.10). Увеличение копийности онкогенов обозначается термином «амплификация»; последняя приводит к возрастанию количества соответствующих белковых продуктов. Подобный механизм активации характерен для онкогеновHER2, NMYC, cyclin D1. Значительно чаще амплификаций встречаются делеции участков хромосом; подобный механизм повреждений типичен для супрессорных генов RB1, APC, p16. Транслокации - перестройки хромосом, приводящие к изменению уровня экспрессии генов или образованию химерных белков, - в большей степени характерны для онкогематологической патологии. Наиболее известна транслокация BCR-ABL, приводящая к образованию так называемой филадельфийской хромосомы и наблюдаемая при хроническом миелолейкозе. В последние годы внимание исследователей все больше привлекают нарушения экспрессии генов в трансформированных клетках (рис. 5.11). По крайней мере отчасти изменения активности транскрипции онкогенов и генов-супрессоров обусловлены метилированием цитозинов в промоторных последовательностях. Статус 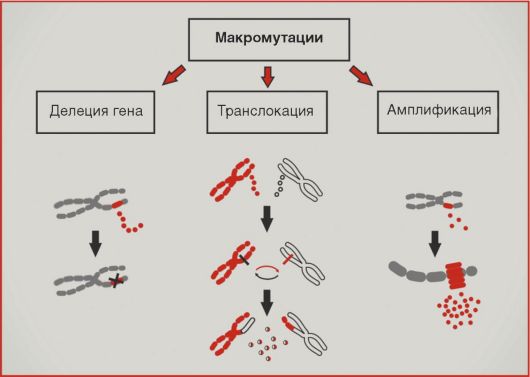 Рис. 5.10. Макромутации Рис. 5.10. Макромутации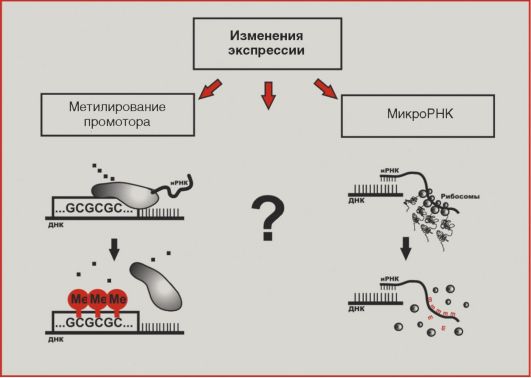 Рис. 5.11. Изменения экспрессии Рис. 5.11. Изменения экспрессииметилирования по цитозину наследуется при делении клетки, поэтому метилированный цитозин иногда называют 5-м основанием ДНК. Наконец, как упоминалось выше, недавние открытия молекулярных биологов демонстрируют существенную роль изменений экспрессии микроРНК в формировании молекулярного портрета опухолевой клетки. Следует заметить, что многие аспекты механизмов регуляции экспрессии в норме и при патологии остаются неизученными. Методы анализа молекулярных нарушений в опухолях Методическая база молекулярной биологии характеризуется исключительной сложностью и разнообразием. Мы кратко остановимся лишь на тех лабораторных подходах, которые имеют прямое или косвенное отношение к клиническим аспектам онкологической диагностики.
Основным методом молекулярной биологии по праву считается полимеразная цепная реакция (ПЦР; polymerase chain reaction - PCR), изобретенная K. Mullis в 1983 г. Принцип ПЦР основан на праймерзависимой энзиматической амплификации фрагментов ДНК, позволяющей накапливать любую генетическую последовательность в неограниченных количествах. ПЦР не имеет предела чувствительности и специфичности, при этом данный метод является относительно доступным для рутинного применения. ПЦР используется для стандартного анализа генетических фрагментов с целью обнаружения изменений нуклеотидной последовательности. Одна из разновидностей ПЦР - RT-PCR (reverse-transcriptase PCR) - применяется для анализа экспрессии генов; в данном случае на матрице клеточной РНК с помощью фермента обратной транскриптазы синтезируется копия комплементарной ДНК (кДНК), которая, в свою очередь, служит непосредственным материалом для ПЦР-анализа. Помимо молекулярно-биологических методик в лабораторной онкологии используются различные усовершенствования морфологических и цитогенетических методов. Наибольшую популярность получил метод иммуногистохимии (ИГХ), позволяющий визуализировать белки с помощью специфичных меченых антител. К его преимуществам следует отнести относительною простоту и возможность анализировать локализацию белков-мишеней, к недостаткам - полуколичественный характер получаемых результатов. Активно внедряется в практику метод флюоресцентной гибридизации in situ (fluorescent in situ hybridization - FISH), основанный на комплементарном взаимодействии меченых генов-зондов с соответствующими участками хромосом. Этот подход применяется для выявления транслокаций и амплификаций генетического материала. Большой резонанс получили разработки, направленные на системный анализ геномных изменений. Наибольшего прогресса достигла так называемая транскриптомика, т.е. исследования изменений экспрессии в опухолях. Принцип соответствующих методик подразумевает гибридизацию тотальной клеточной РНК (кДНК) с полным набором генов человека, зафиксированным на крошечной пластинке - микрочипе. Интенсивность комплементарного связывания генов-зондов с генами-мишенями оценивается с помощью ультратонких сканеров; затем полученные результаты подвергаются сложнейшей компьютерной обработке, позволяющей выявить гипер- и гипоэкспрессируемые гены. Подобный подход позволяет провести идентификацию принципиально важных компонентов опухолевой прогрессии, однако его внедрение в клиническую практику на сегодняшний день остается затруднительным.
Достижения экспериментальной онкологии Каждый год в онкологии происходят сенсационные события, в корне меняющие представления о некоторых фундаментальных аспектах злокачественного роста. Огромный интерес научной общественности привлекли сообщения о существовании стволовых клеток опухолей. Ранее новообразования расценивались как относительно гомогенные структуры, состоящие из равноправных клеток. Даже если в некоторых неоплазмах и наблюдалась определенная гетерогенность, ее считали пассивным следствием нестабильности ракового генома. Недавно в серии экспериментов были представлены доказательства существования иерархии опухолевых клеток, что позволяет рассматривать новообразование как своеобразный «орган». Весьма вероятно, что многим типам малигнизаций присуще наличие так называемых стволовых клеток. Последние в отличие от «дифференцированных» клеток опухоли представляют собой лишь небольшую часть опухолевой массы (< 1 %), при этом они не только способны к неограниченному самовоспроизведению, но и отличаются по некоторым фенотипическим характеристикам от основной клеточной популяции новообразования. К сожалению, подобные наблюдения ставят под сомнение существующие стратегии поиска противоопухолевых препаратов, так как основным источником мишеней для последних являются преобладающие, «дифференцированные» клетки трансформированной ткани. Многие поколения онкологов были воспитаны на принципах абластики и антибластики. Одной из производных этих принципов следует считать абсолютную, фатальную опасность для организма единичных опухолевых клеток, оставшихся после оперативного вмешательства и цитостатической терапии. Результаты некоторых исследований последних лет заставляют предположить, что единичные опухолевые клетки могут существовать в организме на протяжении многих лет после проведенного лечения. Факторы, ассоциированные с прогрессией этих «дремлющих» клонов в клинически распознаваемые рецидивы заболевания, остаются неизвестными. Представления о возможности длительного бессимптомного существования злокачественных клеточных пулов в организме объясняют многие временные закономерности, наблюдаемые в практической онкологии, и заставляют рассматривать опухоль не как изолированный, абсолютно автономный патологический процесс, а лишь как компонент
сложной и взаимосвязанной системы биологических взаимодействий с организмом хозяина. Метастазирование объясняет 90 % случаев летальных исходов онкологических заболеваний. Процесс метастазирования всегда рассматривался как изолированное взаимодействие отщепившихся опухолевых клеток с органом-мишенью. К настоящему моменту стали накапливаться данные о том, что управление процессом метастазирования по крайней мере отчасти может модулироваться первичной опухолью. Доказано, что некоторые неоплазмы секретируют биологически активные вещества, которые доставляются с кровотоком к сайтам метастазирования и способствуют пролиферации трансформированных клеток. Подобные наблюдения имеют непосредственную клиническую перспективу: не исключено, что лекарственное противодействие взаимоотношениям между первичной опухолью и отдаленными метастазами может замедлить прогрессию онкологического заболевания. КЛИНИЧЕСКИЕ АСПЕКТЫ МОЛЕКУЛЯРНОЙ ОНКОЛОГИИ Главным практическим достижением молекулярной онкологии следует считать почти исчерпывающее раскрытие проблемы наследственного рака. Для преобладаюшего числа известных семейных опухолевых синдромов уже разработаны лабораторно-диагностические алгоритмы, предусматривающие ДНК-анализ соответствующих генов. С каждым годом увеличивается количество молекулярно-диагностических тестов, направленных на оптимизацию выбора терапии онкологических заболеваний. К наиболее информативным тестам следует отнести анализ мутации гена EGFR, обладающий уникально высокой предиктивной значимостью в отношении ответа опухолей легкого на терапию гефитинибом или эрлотинибом. Развиваются подходы, направленные на прогнозирование эффективности и безопасности применения фторпиримидинов, производных платины, иринотекана и т.д.
Популярной областью прикладных исследований является разработка методов молекулярной детекции единичных опухолевых клеток. Ожидается, что подобные подходы позволят улучшить прогнозирование региональных и отдаленных рецидивов злокачественного процесса, осуществлять мониторинг трансформированного клона, а в далекой перспективе - способствовать ранней диагностике новообразований. Следует подчеркнуть, что сегодня работы, направленные на выявление диссеминированных опухолевых клеток, носят преимущественно экспериментальный характер и пока не внедрены в рутинную клиническую практику. Помимо молекулярной диагностики, молекулярная онкология формирует направления поиска новых противоопухолевых препаратов. К настоящему времени в практической медицине уже используется более десятка так называемых таргетных лекарств, разработка которых основывалась не на эмпирическом подборе неспецифических цитостатических веществ, а на целенаправленном синтезе антагонистов онкоассоциированных молекул. Наибольшую популярность в клинике получили антитела и низкомолекулярные ингибиторы, направленные на подавление активности белков EGFR, HER2, модуляторов ангиогенеза и т.д. Лекция №1 Опухоль (тумор, бластома, неоплазма, онкос) - это патологическое неограниченное разрастание тканей, в основе которого лежит размножение относительно автономных клеток. Проблема опухолевого роста чрезвычайно важна для человечества и его медицины, т.к. 20% всех людей погибает от опухолей, это 2-е место после сердечно-сосудистых заболеваний. Опухоли возникают у людей любого возраста, но чаще после 40 лет, причём 80% после 50 лет. Опухоли поражают представителей всех классов животного мира, нередко н растения. Таким образом, возникновение опухолевого роста - не случайность, а биологическая закономерность. И чем сложнее устроен организм, тем больше он страдает от опухолей. Проблемы опухолевого роста изучает наука онкология. Она имеет ряд подразделов. Одним из её важнейших разделов является экспериментальная онкология. И основной прогресс в изучении проблем закономерностей, механизмов опухолевого роста как раз и зависит от успехов экспериментальной онкологии. Родоначальником её является Мстислав Александрович Новинский, наш соотечественник, магистр ветеринарных наук, который в 1876 г. впервые в мире начал успешно пересаживать опухоли от больных собак: здоровым. Он дал начало методу трансплантации опухолей, с помощью которого удалось воспроизводить опухоли, чтобы их изучать. И сегодня метод трансплантации применяется очень широко в изучение закономерностей опухолевого роста. Но, кроме трансплантации, пользуются еще и методом индукции опухолевого роста, т.е. вызывания его с помощью химических, физических, вирусных, гормональных воздействий. Кроме того, широко используют 3-й методический прием: клеточные и тканевые культуры, где ин витро, т.е. "в пробирке", растут и человеческие опухолевые клетки. Основная проблема - злокачественные опухоли, причем у человека известно 100 видов самостоятельных злокачественных опухолевых заболеваний. Основные свойства злокачественных опухолей (многие из них характерны и для доброкачественных опухолей). I. Относительная автономность - самая характерная особенность. Это резкое уменьшение чувствительности к регулирующих воздействиям со стороны организма н соседних клеток. Автономный рост это нерегулируемый рост. Клетка становится как бы глухой, слабо реактивной как к стимулирующим, так и угнетающим различным функциональным влияниям организма и соседних клеток. Эти влияния могут быть нейрогуморальными, эндокринными, местными. Примером автономности по отношению к общим регуляторным влияниям организма может служить прогрессирующая утрата гормональной зависимости. Опухоль, растущая из гормонально зависимых тканей, все меньше и меньше подчиняется этим гормональным воздействиям. Другим примером может служить снижение потребностей в сывороточных факторах, стимулирующих размножение клеток, и уменьшение чувствительности к гуморальным ингибиторам пролиферации. Опухолевые клетки размножаются, растут и без соответствующих сывороточных факторов. Примером неподчинения местным регулирующим влияниям может служить резкое снижение или утрата способности к контактному торможению. Дело в том, что нормальные клетки, встречая себе подобных, благодаря действию специфических гуморальных ингибиторов, прекращают движение и размножение, образуя упорядоченные клеточные структуры. А опухолевые клетки в подобных случаях наползают на соседок, продолжая делиться. Опухолевая клетка хуже реагирует и на внутриклеточные изменения. Например, у нее недостаточно эффективно работают ферментные системы, ремонтирующие поломы ДНК. Автономность зависит в большой степени от изменения свойств поверхностных мембран, на которых находятся белковые рецепторы, воспринимающие регуляционные влияния. Их опухолевая клетка меньше синтезирует, а также разрушает протеазами. Кроме того, автономность зависит и от низкого содержания в опухолевых клетках Са и циклического аденозин монофосфата, посредством которых осуществляется в регулирующие влияния. Сниженная реактивность опухолевых клеток уменьшает их компенсаторно-восстановительные возможности. Отчасти с этим связана большая повреждаемость опухолевых клеток под влиянием лучевых, химиотерапевтических воздействий, гипертермии. Поставить опухолевую клетку под контроль - значит победить опухоль. Мы говорим об относительной автономности опухоли, потому что она живёт за счёт организма, имеет общий с ним обмен веществ и не всегда полностью выходит из-под гормональной регуляторной зависимости. Между опухолями и организмом имеется сложные иммунологические отношения. II - "Рост "из себя" и некоторые другие особенности опухолевого роста. Когда говорят, что опухоль "растет из себя", имеют в виду, что она растет за счёт размножения своих клеток со стойко измененными свойствами, передаваемыми по наследству. При этом соседние клетки не становятся опухолевыми. То же относится к метастазирование. Очень важно, что опухоли свойственна безграничная пролиферация клеток. Культура опухолевых клеток бессмертна, иммортальна, в то время, как нормальные клетки гибнут, дав определенное число поколений, разное для различных видов животных, у млекопитающих 30-50 делений (лимит Хайфлика). Как правило, опухоли имеет клоновое происхождение, т.е. происходят из одной трансформированной клетки, но, благодаря генетической нестабильности, в клетках растущей опухоли происходит большое количество мутаций. Иногда возникает несколько точек роста однотипных опухолей. Например, на коже, в желудке, в грудной железе. В 6% случаев констатируют двухсторонний рак грудной железы. Из-за этого явления возможен послеоперационный рецидив рака. Опухолевые клетки обычно размножаются не быстрее, чем могут размножаться нормальные клетки исходной ткани, часто - гораздо медленнее, при этом размножается лишь небольшая часть их, а другая часть находится в покое, не размножаются, а часто, обычно в центре опухолевого узла, отмирает, главным образом из-за недостатка кровообращения. Но темп размножения клеток растущей опухоли превышает темп гибели. Однако, возникшие опухолевые зачатки часто не прогрессируют, а погибают под влиянием защитных сил организма или находятся в покое. Об этом говорит такой факт: при— тщательном морфологическом исследовании опухолевые зачатки обнаруживаются более чем у половины лиц старше 65 лет, умерших от других заболеваний. Вместе с тем, смертность от рака в этом возрасте лишь 18% а не 50. Значит, большинство опухолевых зачатков не развивается, а остаются в покое или погибают. Причем начало роста опухоли, как видно, под влиянием созревающих механизмов противоопухолевой резистентности. из опухолевого зачатка совпадает с прорастанием в неё стромы и сосудов, что стимулируется особыми БАВ самой опухоли. Другой пример: почти у всех плодов человека, а у детей моложе 3 мес. в 1% случаев, в мозговой зоне надпочечников находят нейробластомные злокачественные клетки. А заболевает нейробластомой не 1:100, а 1:300000 детей. Т.о. возникновение опухолевого зачатка еще не значит, что у человека появится клинически выраженная опухоль. III - Анаплазия (катаплазия, дисдифференцировка). Это сниженная, но не утраченная, способность дифференцировке, созревать: исчезновение ряда свойств, характерных для дифференцированной, зрелой клетки, и приобретение ряда свойств незрелой, эмбриональной клетки. Эти свойства изменяются независимо друг от друга, в большей или меньшей степени, т.е. каждая опухоль имеет свою мозаику свойств. Анаплазия злокачественных опухолей достигает такой степени, что некоторые авторы отождествляют злокачественную опухолевую клетку с эмбриональной. Рассматривают разные проявления анаплазии. 1) Так, говорят о морфологической анаплазии. Это сходства морфологические между опухолевой и эмбриональной клеткой. 2) Говорят о функциональной анаплазии. Под ней понимают неспособность, или сниженную способность многих злокачественных опухолей вырабатывать соответствующие гормоны, секреты, неспособность адекватно возбуждаться, сокращаться и т.д., т.е. выполнять физиологические функции нормальной ткани. Есть понятие о 3) биохимической или обменной анаплазии. Это сближение биохимических свойств опухолевой и эмбриональной клеток по антигенному составу. Опухолевые клетки возобновляют синтез белков, характерных для эмбрионального периода данного органа. Обмен углеводов или энергетический обмен. Опухолевая клетка располагает обоими источниками энергии: дыханием и гликолизом. Но нормальная ткань в аэробных условиях обычно полностью обеспечивает себя энергией за счет дыхания, а гликолиз подавляется механизмом эффекта Пастера. И лишь при гипоксии пускается в ход анаэробный гликолиз. А опухоль постоянно живет в условиях гипоксии из-за крайне замедленного кровотока и из-за бедности капиллярной сети. Кровоток в крупной опухоли составляет всего лишь от 2 до 15% по сравнению с нормальным кровотоком. Опухоль получает только половину энергии за счет дыхания, а остальное за счет расточительного гликолиза, который в 19 раз менее эффективен по выходу энергии, по сравнению с дыханием. Но и в аэробных условиях гликолиз в опухолевой ткани осуществляется достаточно интенсивно. Это объясняется тем, что в опухолевой клетке много гексокиназы с повышенным сродством к глюкозе. Она фосфорилирует глюкозу до глюкозо-6-фосфата и вовлекает её в гликолитический цикл обмена веществ. Эта гексокиназа выходит из-под тормозных влияний организма (автономность) и даже появляется в сыворотке большинства больных со злокачественными опухолями. Это один из диагностических признаков (не очень надёжных) наличия злокачественной опухоли в организме. Опухолевая клетка жадно связывает глюкозу своей поверхностной мембраной и вовлекает в обмен. 0на"насасывает"глюкозу даже в том случае, если ее концентрация в 10 000 раз меньше нормы. За это опухоль называют ловушкой глюкозы. 0на потребляет так много глюкозы, что у больных диабетом исчезает даже гипергликемия и глюкозурия, ко вновь появляются после удаления опухоли. При очень больших злокачественных опухолях, которые встречаются редко, гипогликемия может достигать такой степени, что развивается гипогликемическая кома, от которой человек погибает. И при злокачественной опухоли весом от 1 до 18 кг для компенсации, недопущения опасной гипогликемии больным приходилось вводить за сутки от 825 до 2250 г чистой глюкозы в растворе. Недоокисленные продукты гликолиза выделяются с мочой, что увеличивает отношение углерода к азоту в моче к этот симптом называется дизоксидативной карбонурией (один из не абсолютно достоверных симптомов, указывающих на наличие в организме злокачественной опухоли). Вследствие постоянного гипогликемического давления - гипогликемии или тенденции к ней, стимулируется глюконеогенез, главный поставщик глюкозы. Это превращение в глюкозу углеводных остовов аминокислот и липидов за счёт распада белков мышц, кожи и за счёт распада липидов жировой ткани. Это может иногда привести к истощению, кахексии. Раньше считали целесообразным ограничивать опухолевых больных в углеводах, чтобы "не кормить" опухоль. Это оказалось ошибкой. Наоборот, при введении больным глюкозы до 4-х крат ной гипергликемии наблюдается торможение опухолевого роста и уменьшается метастазирование, т.к. интенсивный гликолиз приводит к накоплению огромно го количества молочной кислоты, концентрация которой в опухолевых клетках увеличивается в 10-30 раз, а рН опухолевой ткани может снижаться даже до 5и ниже. В этих условиях повышается проницаемость мембран лизосом, активируются их кислые гидролазы. Опухоль становится более уязвимой для лучевой, химиотерапии, гипертермии. В клинике получен хороший результат от комплексного лечения больных со злокачественной опухолью Применяют введение глюкозы, лучевая или химиотерапия, нагревание опухоли локальное, если нет метастазирования, если есть - общее, локальное - напр. с помощью УВЧ, СВЧ. Опухоль нагревается на несколько градусов выше, чем окружающая ткань т.к. в опухоли плохое кровообращение, а при гипертермии оно снижается ещё больше, вплоть до стазов. Особо высокая лечебный эффект даёт ферромагнитная гипертермическая терапия, при которой мельчайшие частички сверхчистого железа вводят в кровь, с помощью магнитов их фиксируют в области опухоли, после чего локально нагревают излучателями. Обмен нуклеиновых кислот и белков. Синтез белков запрограммирован в ДНК и идет с непосредственным участием РНК. В норме в клетке жестко контролируется синтез ДНК. Он осуществляется благодаря генетической репрессии основных ферментов синтеза ДНК, таких как тимидинкиназа и ДНК-полимеразы. Кроме того, имеются и белковые ингибиторы этих ферментов, т.е. если они появятся в клетке, то все равно не смогут работать. Таким образом, клетка может в норме размножаться только тогда, когда появится определенный стимул. А в опухоли ферментные системы синтеза ДНК работают на полную мощность (автономность) - клетки постоянно делятся. Наряду с этим непрерывно образуются большие количества РНК. Это происходит, во-первых, из-за высокой активности ферментов синтеза; во-вторых, из-за того, что происходит рециклизация. Рекциклизация - это вовлечение в цикл синтеза продуктов распада, которые обычно теряются клеткой, а синтез идет за счет новых нуклеотидов. Опухолевая клетка утилизирует продукты распада для синтеза новых молекул ДНК. И третье, в опух. клетке сняты механизмы обратной связи, регулирующие синтез РНК в нормальной клетке, - торможение синтеза продуктами синтеза. Опух. клетка постоянно синтез, большое количество РНК и в опухоли накапливается белок, а распад его снижен, потому что ферментов катаболических не хватает, и это накопление белка обеспечивает постоянное деление клетки. При этом опух. клетка успешно конкурирует с др. клетками организма за азотсодержащие вещества (аминокислоты и др.). А при голодании организма она продолжает размножаться за счет азота других тканей, потому опухоль называют также ловушкой азота. В опухоли образуются и белки, которые могут быть носителями антигенных свойств, отличных от таковых норм, зрелой ткани, Это 1) эм6риональные специфические антигены, т.е. восстановление синтеза белков, которые когда-то синтезировались в клетке в эмбриональном периоде, в том числе онкобелки, возникающие вследствие функционирования особых генов рака - онкогенов. 2) В клетке могут появляться случайные опухолевые антигены вследствие мутации, количество которых, как указывалось, в опухолевых клетках увеличено. 3) В опухоли может синтезироваться антигены специфичные для вирусов, который вызвал трансформацию клетки, если опухоль вирусной этиологии. Вообще, опухолям свойственно упрощение белкового состава, по сравнению со зрелой клеткой. В том числе и утрата гормональной зависимости из-за уменьшения и прекращения синтеза белковых рецепторов гормонов и их разрушения под влиянием протеолитических ферментов самой опухоли. Обмен белков нарушен не только в самой опухоли, но и во всем организме опухолевого больного, в частности это выражается в том, что уменьшено количество альбуминов, но увеличено кол-во фибриногена в плазме крови. Липидный обмен. Здесь главное состоит в том, что опухоль во много раз больше содержит холестерина, чем нормальная ткань. Это связано тоже с автономностью: не происходит угнетения синтеза холестерина его избытком. В опухоли увеличено количество фосфолипидов, а в крови и других тканях фосфолипиды и нейтральные жиры уменьшены. В связи с обменной стоит физико-химическая анаплазия. Она проявляется в увеличении водородных ионов, калия, натрия, осмотического и онкотического давления, воды, отрицательного заряда клетки, проницаемости клеточных мембран. Содержание двухвалентных ионов кальция и магния уменьшено. С биохимической анаплазией тесно связано и другое свойство, типичное для злокачественных опухолей – 4-е свойство или системное действие на организм опухоли или влияние опухоли на организм, не связанное с непосредственным поражением органов и тканей самой опухолью или её метастазами. Дело в том, что онкологические больные чаще гибнут не от резкого истощения, не от кахексии, а от нарушения нейроэндокринной регуляции обмена веществ, от дисфункции и дистрофии жизненно-важных органов и особенно часто от различных присоединившихся инфекций вследствие сниженного иммунитета. Мы уже говорили, что опухоль функционирует как ловушка глюкозы и азота. Это стимулирует глюконеогенез (главный поставщик глюкозы). Опухоль начинает потреблять углеводы, азот, жиры тканей. Уже это неблагоприятно сказывается на трофике тканей и может, хотя и сравнительно редко, приводить к кахексии. При гипогликемии возникает гипертрофия и гиперфункция коры надпочечников, усиливается секреция глюкокортикоидов, прежде всего кортизола, который стимулирует глюконеогенез преимущественно в лимфоидном аппарате. Это приводит к его атрофии, а значит к снижению иммунитета. Кроме того, иммунитет организма со злокачественной опухолью снижается и в силу действия ряда других факторов, на которых мы остановимся позднее. Если глюконеогенез будет не в состоянии компенсировать гипогликемию, то по механизму обратной связи перестанет вырабатываться инсулин, а значит мышечные и некоторые другие ткани не смогут в должной мере ассимилировать глюкозу и аминокислоты. Для сбережения азота и поддержания реактивности организма больным со злокачественными опухолями надо рекомендовать продукты, достаточно богатые белком, давать достаточно сахара, фруктов, витаминов, кроме фолиевой кислоты. Низкобелковый рацион стимулирует канцерогенез. Кроме того, к системному действию относится снижение окислительно-восстановительных процессов во всём организме, а также довольно часто встречающаяся гиперкальциемия - увеличение кальция в крови, вплоть до летального исхода из-за этого увеличения. При этом возникает остеолизис вследствие образования в опухоли паратгормона и простагландина Е-2. С увеличением концентрации простагландинов в крови в большой мере ввязана иммунодепрессия. В опухоли могут образовываться любые гормоны, преимущественно пептидного строения, нейропептиды, другие биологически активные вещества. Это усугубляется тем, что в результате повышения проницаемости клеточных мембран опухолевых клеток и её отмирания в организм поступают клеточные ферменты. К системному действию относится и упоминавшиеся изменения содержания в плазме крови белковых и жировых веществ, а также нарастающая дизергия и анергия сосудов организма по отношению к адреналину и норадреналину. Т. о. в организме больного со злокачественной опухолью складывается неблагоприятная метаболическая ситуация с нарушением регуляции функций и иммунодепрессией. К этому надо прибавить нарушение вкуса и аппетита, что часто бывает у опухолевых больных и все это объясняет гибель больных иногда ещё до того, как будут существенно поражены опухолью и метастазами жизненно-важные органы. V. Инвазивно-деструктивный рост, т.е. прорастание окружающих тканей и повреждение, гибель их. Инвазивный рост злокачественной опухоли объясняется многими факторами. В процессе роста внутритканевое давление в опухоли увеличивается. Клетки злокачественной опухоли имеют свойство активно двигаться, благодаря актомиозиновым сократительным элементам. Из-за сиаловых кислот они имеют на поверхности высокий отрицательный заряд, благодаря которому они отталкиваются друг от друга, т.е. расталкиваются. Опухолевые клетки лишены контактного торможения, которое блокирует движение и размножение нормальных клеток. В опухолевой клетке мало кальция и магния, необходимых для построения правильных, устойчивых тканевых агрегатов. Двигающаяся опухолевая клетка выделяет ряд ферментов: лизосомные гидролазы, нейтральные протеазы, коллагеназу, которые разрушает межклеточное вещество, прокладывая движущейся клетке дорогу. Вместе с тем, опух. клетки стимулируют пролиферацию фибробластов, благодаря чему строится соединительно-тканная строма, которая несёт сосуды. Кстати, развитие сосудов также стимулируется опухолью .Деструкция - повреждение окружающих тканей - объясняется, главным образом, голоданием клеток, потому что участки нормальной ткани окружённой опухолевыми клетками, которые успешно конкурируют за глюкозу и азотосодержащие вещества, благодаря этому вокруг опухолевой клетки образуется "мертвая зона", в которой не могут жить нормальные клетки. Можно отметить, что инвазивный рост характерен не только для злокачественных опухолей. Железистый эпителий молочных желёз при беременности инвазирует окружающую жировую ткань, ворсинки плаценты инвазируют стенку матки. Но в этих случаях инвазия тотчас прекращается после включения соответствующей гормональной стимуляции. А опухолевая инвазия не подчиняется регулирующим влияниям организма. VI. Метастазирование. Метастазы - это новые очаги роста в результате переноса опухолевых клеток по кровеносным и лимфатическим сосудам. Соответственно, различают метастазы гематогенные и лимфогенные. Однако метастазирующие клетки могут переноситься и другими жидкостями организма (например, цереброспинальной), а также внедряться в ткани при прямом контакте (губы). В процессе метастазирования различают ряд этапов. 1) Инфильтрация сосудистой стенки и выход в кровьили лимфу. Опухолевые клетки могут проходить между эндотелиальными клетками, через поры в нихили непосредственно отрываться, вываливаясь в просвет сосуда, т.к. часть сосудистой стенки в опухоли может состоять из опухолевой ткани. Этот процесс может начаться очень быстро после возникновения роста злокачественной опухоли 2) Циркуляция в крови или движение по лимфососудам. В крови опухолевые клетки повреждаются из-за перепадов давления. Большинство их гибнет в лёгочных микрососудах. 3) Фиксация опухолевых клеток в кровеносных капиллярах или региональных лимфоузлах. Часть опухолевых клеток может проходить лимфоузлы и достигать крови. Прилипанию клеток способствуют мукополисахариды, содержащие сиаловые кислоты на поверхности опухолевых и эндотелиальных клеток, а также тромбопластические энзимы, выделяемые опухолевыми клетками и тромбоцитами. При этом фибринный слой микротромбов, внутри которых содержатся опухолевые клетки, предохраняет их от контакта с клетками защитной системы - лимфоцитами и другими клетками. Способствует фиксации опухолевых клеток и повреждение сосудов. 4) Выход во внесосудистое пространство (экстравазация). 5) дремлющее состояние опухолевых клеток. При этом клетки иногда сохраняют потенциальную способность к размножению очень долго, например, при меланоме, раке молочной железы, толстого кишечника - 20-40 лет. 6) Размножение опухолевых клеток, чаще - единичной клетки с образованием метастатического зачатка. При этом выживает, в среднем, 1 клетка из 1 миллиона, вышедших в кровь, лимфу. 7) Образование стромы и васкуляризация метастатического узла. 8) Рост метастатического узла с образованием зрелого метастаза. Надо иметь в виду, что выжившие опухолевыеклетки могут начать размножатьсятолько в благоприятных для этого условиях. Поэтому разные опухоли имеют свои излюбленные локализации метастазов .Одни опухоли дают метастазы преимущественно в печень, другие в лёгкие, третьи в ЦНС, четвертые в кости и т. д. Этим же объясняется поздние метастазы, возникающие иногда через десятилетия после удаления основного опухолевого узла. В этих случаях опухолевые клетки, как видно, "дожидаются" ослабления защитных сил организма. Однако надо считаться и с тем, что благодаря генетической нестабильности, свойства опухолевых клеток метастаза могут меняться, в том числе и в сторону увеличения злокачественности, что также может способствовать началу безудержной пролиферации. Какие же условия способствует образованию метастазов из опухолевых клеток, застрявших в каких-то органах и тканях? Это, прежде всего, механическое воздействие - травмы, массаж и др. В дальнейшем было установлено, что такое же влияние оказывает гипоксия, гепатотропные яды - четырехлористый углерод и хлороформ. Причем, чем больше застревает клеток, тем скорее они начинают расти. Что касается других условий, способствующих появлению метастазов, то это, во-первых, продолжительность и скорость роста самой опухоли. Чем дольше и быстрее растет основной опухолевый узел, тем, обычно, больше шансов появления метастазов. Тем более, что в процессе роста опухолевых клеток продолжается изменение и селекция более злокачественных клеток. Очень важно знать, что травма самой опухоли очень способствует метастазированию. Когда опухоль пальпируют, она мириады клеток посылает в лимфатические или кровеносные сосуды. То же когда делают биопсию, пункцию опухоли. Было установлено, что когда хирурги делают операцию очень аккуратно, не дотрагиваются до опухоли, то результаты оказывались вдвое лучше, по сравнению с тем, когда хирурги оперируют неаккуратно. Любое угнетение резистентности организма приводит к бурному росту как самой опухоли, так и способствует образованию не только первичных, но и вторичных, и третичных метастазов, когда метастазы в свою очередь дают метастазы. Лучшей профилактикой метастазов остается наиболее раннее и минимально травматичное удаление основного опухолевогоузла. Иногда после этого рассасываются и отдаленные мелкие метастазы. VII. Прогрессия. Это стойкие изменения одного или нескольких свойств опухоли в сторону злокачественности, т.е. усиление злокачественности опухоли, а не увеличение её массы. Причем прогрессия одних признаков происходит независимо от других. Например, уменьшение гормональной зависимости может не сопровождаться усилением способности давать метастазы и т.д. Это очень важное свойство, благодаря чему доброкачественная опухоль превращается в злокачественную. Важным, но не единственным механизмом прогрессии является селекция более злокачественных элементов. Существует свойство опухолевых клеток, противоположное прогрессии. Это VIII. реверсия, т.е. уменьшение злокачественных свойств опухоли, а не уменьшение размеров опухолей (регрессия). Она встречается редко в естественных условиях, а в эксперименте её легко наблюдать: при пассажах, особо при выращивании в культуре опухолевых клеток животных и человека. Они могут превращаться в доброкачественные, а затем и в нормальные клетки. В настоящее время известно много индукторов дифференцировки опухолевых клеток. Ими оказались и многие противоопухолевые препараты, т.е. они не убивает опухолевые клетки, а вызывают их дифференцировку, созревание. И при этом реверсия, связанная с процессом дифференцировки, идёт в направлении, обратном опухолевому превращению клетки: путём включения иди выключения функции определенных генов, что приводит к появлению необходимых рецепторов на поверхности, нормализации в клетке уровня Са, цАМФ и др. Клетка становится регулируемой, нормальной. В естественных условиях, например, злокачественная нейробластома у детей, примерно в 10% случаев благодаря реверсии превращается в доброкачественную ганглионеврому, а некоторые дети полностью выздоравливают, благодаря полной нормализации клеток. Достоверно известны случаи, к сожалению, редкие, полного самоизлечения при запущенной иноперабельной опухоли. В 1/3 таких случаях это происходит после острых инфекций с высокой температурой. Чаще это наблюдается при злокачественной нейробластоме, злокачественной гипернефроме, злокачественной меланоме, хорионической карциноме Реже при других опухолях. Часть этих случаев связаны с реверсией, а часть, по-видимому, с мобилизацией каких-то сил резистентности.
|
