экзамен по химии. экзамен по химии!!!. 1. Химическая термодинамика и её применение к биосистемам
 Скачать 0.97 Mb. Скачать 0.97 Mb.
|
5. Осмотические свойства растворов электролитов. Электролиты в организме а) давления # Диссоциация слабых электролитов не зависит от б) температуры в) природы электролита г) природы растворителя д) концентрации раствора # На степень диссоциация слабых электролитов влияет а) добавление анионов б) добавление катионов   добавление одноименных ионов в) добавление любых ионов г) д) добавление гидрофобных неэлектролитов  а) степени диссоциации *Закон Вант-Гоффа: осмотическое давление разбавленных растворов электролитов прямо пропорционально б) константе диссоциации
# Математическое выражение закона Вант-Гоффа для разбавленных растворов электролитов а) = inRT б) = imRT в) = inRT/m  г) = imRT/V д) = imRT/MV г) = imRT/V д) = imRT/MV# Осмотическое давление разбавленных растворов электролитов прямо пропорционально а) массе раствора  б) константе диссоциации в) абсолютной температуре б) константе диссоциации в) абсолютной температурег) массовой доле растворённого вещества д) молярной доле растворённого вещества # Осмотическое давление разбавленных растворов электролитов прямо пропорционально а) массе раствора б) константе диссоциации  в) молярной концентрации раствора в) молярной концентрации раствораг) массовой доле растворённого вещества д) молярной доле растворённого вещества # Осмотическое давление разбавленных растворов электролитов прямо пропорционально а) массе раствора  б) степени диссоциации в) константе диссоциации б) степени диссоциации в) константе диссоциацииг) массовой доле растворённого вещества д) молярной доле растворённого вещества # Осмотическое давление разбавленных растворов электролитов прямо пропорционально а) массе раствора б) константе диссоциации  д) количеству ионов, образующихся при диссоциации в) массовой доле растворённого вещества г) молярной доле растворённого вещества # Кажущаяся степень диссоциации и изотонический коэффициент связаны  в) α = i – 1/n – 1 соотношением а) i = α – 1/n – 1 б) i = α – 1/n + 1 г) α = i – 1/n + 1 д) α = n – 1/i – 1 # Изотонический коэффициент рассчитывается по формуле 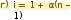 а) i = α – 1/n – 1 б) i = 1 – α(n + 1) в) i = 1 + α(n + 1) а) i = α – 1/n – 1 б) i = 1 – α(n + 1) в) i = 1 + α(n + 1)д) i = 1 + n(α – 1)  а) прямо пропорциональна степени диссоциации # Величина изотонического коэффициента б) обратно пропорциональна степени диссоциации в) прямо пропорциональна константе диссоциации г) обратно пропорциональна количеству образующихся ионов д) прямо пропорциональна молярной доле растворённого вещества # Величина изотонического коэффициента а) обратно пропорциональна степени диссоциации б) прямо пропорциональна константе диссоциации в) обратно пропорциональна количеству образующихся ионов  д) прямо пропорциональна количеству ионов, образующихся при диссоциации г) прямо пропорциональна молярной доле растворённого вещества *Закон разведения Оствальда: степень диссоциации слабого бинарного электролита  в) прямо пропорциональна квадратному корню из константы диссоциации а) прямо пропорциональна константе диссоциации б) обратно пропорциональна константе диссоциации г) обратно пропорциональна квадратному корню из молярной концентрации   д) прямо пропорциональна количеству ионов, образующихся при диссоциации # Водные растворы сильных электролитов содержат а) ионы  в) гидратированные ионы б) молекулы г) гидратированные молекулы д) гидратированные ионы и молекулы # Водные растворы слабых электролитов содержат а) ионы б) молекулы в) гидратированные ионы  д) гидратированные ионы и молекулы г) гидратированные молекулы а) 7,4 б) 7,5 в) 7,6  г) 7,7 г) 7,7д) 7,8 # Изотоничным крови является раствор NaСl в концентрации а) 0,09 %  в) 0,9 % б) 0,15 % г) 0,09 моль/л д) 0,9 моль/л # Причины повышения осмотического давления в организме человека а) повышение температуры б) повышение артериального давления в) потеря организмом солей  д) введение больших количеств солей г) введение больших количеств воды *Причины понижения осмотического давления в организме человека а) понижение температуры  в) потеря организмом солей б) понижение артериального давления г) введение больших количеств воды   д) введение больших количеств солей # При помещении крови в гипертонический раствор хлорида натрия наблюдается а) лизис  в) плазмолиз б) гемолиз г) цитолиз д) эритроцитолиз # При помещении крови в гипотонический раствор хлорида натрия наблюдается а) осмос б) обратный осмос в) диализ  г) гемолиз д) плазмолиз г) гемолиз д) плазмолиз б) фосфаты *В биологических жидкостях организма человека нерастворимыми могут быть а) хлориды в) гидрофосфаты  г) дигидрофосфаты д) гидрокарбонаты | ||||||||||||
