1. общая этиология и патогенез расстройств функций системы кровообращения. Факторы риска в возникновении сердечной патологии управляемые и неуправляемые
 Скачать 2.8 Mb. Скачать 2.8 Mb.
|
|
Механизмы возникновения и развития заболевания (Патогенез) При остром затруднении или полном прекращении внешнего дыхания вначале развивается предасфиктическое состояние, которое характеризуется включением компенсаторно-приспособительных реакций организма. Однако продолжающееся накопление в организме углекислоты приводит к срыву приспособительных реакций и развитию асфиксии, в течении которой различают пять периодов: —ипспираторной одышки (затруднение вдоха); — экспираторной одышки (затруднение выдоха); — кратковременной остановки дыхания; — терминального дыхания; — стойкой остановки дыхания. Каждый период продолжается от 1 до 3-5 мин. Ведущую роль в развитии асфиксии играет накопление в организме углекислоты, избыточная концентрация которой вначале приводит к раздражению и возбуждению дыхательного центра продолговатого мозга (периоды одышки), затем снижению возбудимости этого центра и его полному параличу (период кратковременной остановки дыхания), раздражению и возбуждению дыхательного центра спинного мозга (период терминального дыхания), его истощению и параличу (период окончательной остановки дыхания). 22.Обструкция нижних дыхательных путей. Патогенез бронхитического и эмфизематозного типов обструкции. ОБСТРУКЦИЯ НИЖНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ К острой обструкции нижних дыхательных путей (НДП) -- трахеи и бронхов -- приводят аспирация жидкостей (вода, кровь, желудочный сок и др.) и твердых инородных тел, анафилактические реакции и обострение хронических легочных заболеваний, сопровождающиеся бронхообструктивным синдромом. Аспирация рвотных масс часто происходит в состоянии комы, наркоза, выраженного алкогольного опьянения или при угнетении ЦНС, вызванном другими причинами, т.е. в тех случаях, когда нарушен механизм кашля. При попадании пищевых масс в дыхательные пути развивается реактивный отек слизистой оболочки, при аспирации кислого желудочного сока к местному реактивному отеку присоединяется токсический отек дыхательных путей. Клинически это проявляется быстро нарастающей асфиксией, цианозом, выраженным ларинго- и бронхоспазмом, падением АД. Аспирация крови особенно опасна при нарушенном кашлевом механизме. Кровь может поступать из полостей носа и рта, при трахеостомии, если гемостаз недостаточен, или из бронхиальных сосудов. Кровь свертывается в бронхиолах, а при повышенном содержании кислорода во вдыхаемой газовой смеси -- даже в крупных бронхах и трахее, что приводит к обструкции дыхательных путей. Лечение. При кровотечении из полости рта и носа и сохраненном сознании производят переднюю или заднюю тампонаду полости носа и хирургический контроль кровотечения. Больному с выраженным аспирационным синдромом в бессознательном состоянии придают положение, обеспечивающее дренирование дыхательных путей. Быстро очищают ротоглотку, проводят интубацию трахеи и с помощью отсоса восстанавливают проходимость трахеи и бронхов. Раздувание манжетки эндотрахеальной трубки позволяет защитить трахеобронхиальное дерево от повторного поступления крови из ВДП. При кровотечении из бронхов важно установить, из какого легкого оно происходит. Для этого срочно проводят бронхоскопию. Установив источник кровотечения, больного укладывают на бок так, чтобы кровоточащее легкое было внизу. Вводят кровоостанавливающие средства (плазма, аминокапроновая кислота, препараты кальция и т.д.). Показаны срочное рентгенологическое обследование грудной клетки и хирургический контроль кровотечения. Массивная аспирация воды в легкие ведет к тяжелой гипоксии вследствие полного прекращения дыхания и газообмена. Даже при умеренной аспирации воды (1--3 мл/кг) возникают ларинго- и бронхоспазм, шунтирование крови в легких, приводящие к значительным нарушениям газообмена. Лечение. При значительной гипоксии и бессознательном состоянии следует очистить ротоглотку, провести интубацию трахеи и удалить секрет из трахеи и бронхов. При апноэ проводят ИВЛ, при остановке сердца -- весь комплекс реанимационных мероприятий. Частичная обструкция трахеи твердым инородным телом проявляется кашлем, удушьем и одышкой. При полной обструкции пострадавший не может дышать и говорить. Если обструкция неполная и газообмен не нарушен, оперативное вмешательство не показано -- больной должен продолжать кашлять, так как кашель обычно эффективен. Если устранить обструкцию не удается, прибегают к специальным приемам. Анафилаксия возникает как специфическая реакция по типу антиген-антитело или как реакция повышенной чувствительности к определенным, чаще всего лекарственным, веществам. В патогенезе анафилактической реакции основное значение придают освобождению гистамина и других медиаторов, воздействующих не только на сосудистый тонус, но и на гладкую мускулатуру дыхательных путей. Причиной анафилактической реакции может быть введение лекарственных препаратов, в том числе антибиотиков, инфузионных сред (особенно белковой природы) и др. Реакция обычно возникает немедленно -- в течение 30 мин -- и проявляется в виде выраженного ларинго- и бронхоспазма, прогрессирующего удушья, иногда на фоне вазомоторной атонии. Лечение заключается в немедленном прекращении введения препарата, вызвавшего анафилактическую реакцию. Если обструкция дыхательных путей не сопровождается шоком, вводят 0,5 мл 0,1 % раствора адреналина подкожно или внутримышечно; при анафилактическом шоке -- 1--2 мл внутривенно. В случае недостаточной эффективности указанных средств повторяют введение адреналина в той же дозе через 15 мин. Одновременно вводят большие дозы кортикостероидов (например, 60--90 мг преднизолона или эквивалентные дозы гидрокортизона и дексаметазона). Показаны также антигистаминные препараты. При шоке показана соответствующая инфузионная терапия. 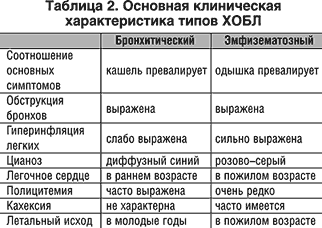 ХОБЛ является неуклонно прогрессирующим воспалительным процессом, локализованным в слизистой трахеобронхиального дерева. Диагноз ХОБЛ включает хронический бронхит, пневмосклероз, эмфизему легких. Различают два клинических типа заболевания. Эмфизематозный тип характеризуется преобладанием одышки и небольшим кашлем. Кожные покровы гиперемированы. Доминируют эмфизематозные процессы. Повышенная воздушность легких обусловлена бронхиальной обструкцией, изменением альвеол, снижением эластичности легочной ткани. При хронической эмфиземе легких одышка у пациента развивается незаметно. Возникают внезапные приступы одышки, сопровождающиеся кашлем без выделения или со скудным выделением мокроты. Развитие легочного сердца наблюдается редко. Обструктивный тип (исход хронического бронхита). Больные второго типа имеют цианотичный вид, в клинической картине преобладает воспалительный процесс в бронхах с обструкцией, которая приводит к накоплению углекислого газа (гиперкапнии) и гипоксемии (низкому содержанию в крови кислорода). При этом типе прогрессирование заболевания происходит быстрее. Раньше формируется легочное сердце, раньше наступает смерть. Бронхитический вариант характерен для обструктивного бронхита, при котором развиваются необратимые воспалительно-фиброзные изменения мелких бронхов. Курение сигарет (активное и пассивное) — наиболее частый этиологический и поддерживающий прогрессирование болезни фактор. Больных с этим вариантом ХОБЛ описывают как «синих отёчников» вследствие высокой частоты цианоза и других симптомов сердечной недостаточности. При этом варианте обструктивного синдрома вслед за воспалительным отёком слизистой оболочки терминальных бронхиол, приводящим к гиповентиляции альвеол, снижению РaO2 и повышению РaCO2, возникают спазм альвеолярных капилляров и гипертензия в малом круге кровообращения. Эти факторы являются основными патогенетическими механизмами, способствующими формированию хронического легочного сердца. Эмфизематозный вариант развивается у больных эмфиземой лёгких, которых образно называют «розовые пыхтельщики» вследствие превалирования одышки над цианозом. С этим связаны увеличение объема альвеол, сокращение числа альвеолярных капилляров, отсутствие шунтирования крови и нормальный ее газовый состав. Наряду с этим имеет место и бронхиальная обструкция. При спазме бронхов воздух из альвеол выходит с трудом, потому что с выдохом повышается давление воздуха на мелкие суженые бронхи. 23.Нарушения регуляции дыхания. Рефлекторные расстройства дыхания, поражения дыхательного центра. Патологические формы дыхания. Регуляция дыхания осуществляется по принципу обратной связи: отклонение газового состава крови от физиологических показателей рефлекторно ведет к соответствующему изменению параметров дыхания,обеспечивающему поддер-жание Рао2 и Расо2 на оптимальном уровне. При изменении Рао2 и Расо2 в крови и тканях кровообращение является каналом обратной связи, по которому информация передается на хеморецепторы (периферические и центральные). Хеморецепторы обнаруживают разницу между действительными и нормальными величинами напряжения газов крови и передают эту информацию дыхательным нейронам ствола мозга. Дыхательный центр формирует импульсы, передающиеся по нервам к дыхательным мышцам, работа которых обеспечивает установление адекватной вентиляции с минимальными изменениями напряжения газов крови. Нарушение функций дыхательного центра. Дыхательный центр человека (ДЦ) человека представляет собой функциональную совокупность нервных образований, расположенных на различных уровнях ЦНС: в спинном мозге, продолговатом мозге, Варолиевом мосту, буграх четверохолмия, коре головного мозга. К ДЦ поступают импульсы от центральных и периферических хеморецепторов, барорецепторов, рецепторов легких (растяжения, ирритантных, юкстакапиллярных), рецепторов носовой полости, верхних дыхательных путей, суставов, мышц, болевых и температурных рецепторов. Центральные хеморецепторы реагируют на изменение химического состава омывающей их крови, а именно, на изменение Расо2, и участвуют в постоянном контроле адекватной вентиляции. Повышение Расо2 сопровождается стимуляцией ДЦ и увеличением уровня вентиляции. Периферические хеморецепторы играют большую роль в увеличении вен- тиляции при артериальной гипоксемии. Раздражение барорецепторов дуги аорты и каротидного синуса при увеличении артериального давления может привести к рефлекторной гиповентиляции, брадипноэ, вплоть до апноэ (остановке дыхания); при снижении артериального давления – к гипервентиляции. Каротидные тельца реагируют на изменения рН артериальной крови вне зависимости от того, в результате каких (дыхательных или метаболических) процессов изменился рН. Формы нарушения деятельности ДЦ. 1. Угнетение ДЦ (при действии наркотических средств, раздражении слизистой верхних дыхательных путей в условиях развития ОРЗ, примении ингаляционных наркотических средств, сильных болевых ощущениях). 2. Возбуждение ДЦ (при стрессовых воздействиях. Неврозах, поражениях структур среднего мозга, нарушениях кровообращения, остром воспалении, механической травме). 3. Дезинтеграция автоматической и произвольной регуляциидыхания (при формировании мощных потоков афферентной импульсации: болевой, психогенной, хеморецепторной, барорецепторной, хаотической афферентации). 4. Повреждение ДЦ (при энцефалитах, нарушениях мозгового кровообращения, бульбарной форме полиомиелита, дегенеративных изменениях ткани головного мозга, тяжелой гипоксии, шоковых и коматозных состояниях. Основная форма патологии внешнего дыхания — дыхательная недостаточность. В зависимости от характера течения патологического процесса различают острую и хроническую дыхательную недостаточность. Кроме того, выделяют три типа дыхательной недостаточности: обструктивый тип; рестриктивный тип; смешанный тип. Тахипно́э— учащённое поверхностное дыхание (ЧД свыше 20 дыхательных движений в минуту). Учащённое дыхание возникает обычно при раздражении дыхательного центра продуктами жизнедеятельности организма (углекислый газ). Наблюдается при анемии, лихорадке, заболеваниях крови. При истерии частота дыхательных движений может достигать 60—80 в минуту. Брадипно́э — патологическое урежение дыхания — развивается при понижении возбудимости дыхательного центра, либо при угнетении его функции, которое может быть вызвано повышением внутричерепного давления (опухоль головного мозга, менингит, кровоизлияние в мозг, отёк мозга) или воздествием на дыхательный центр накопившихся в значительных количествах в крови токсических продуктов метаболизма (уремия, печёночная или диабетическая кома, некоторые острые инфекционные заболевания и отравления). Апно́э — отсутствие или остановка дыхательных движений. Патологический процесс, связанный с патологией дыхательной мускулатуры, например, отравление ядом, действующим подобно кураре либо параличом дыхательного центра, например, в результате отёка мозга или черепно-мозговой травмы. Отдельно выделяют синдром обструктивного апноэ сна, вызываемый провисанием верхних дыхательных путей. Этот вид апноэ обычно встречается у людей, которые храпят во сне и является плохим прогностическим признаком в плане риска развития острой сердечно-сосудистой недостаточности. Так называемое рефлекторное или «ложное апноэ» иногда наступает при сильном раздражении кожи (например, при погружении тела в холодную воду). Апноэ (как патологическое состояние) также следует отличать от искусственно вызванной задержки дыхания (например при погружении в жидкость) — в результате развившегося кислородного голодания (на фоне прекращения поступления кислорода из атмосферного воздуха в альвеолы) происходит отключение коры головного мозга (потеря сознания или прекращение процессов высшей нервной деятельности) после чего подкорковые и стволовые структуры (дыхательный центр) дают команду на вдох. Если при этом атмосферный воздух проникает в лёгкие, то по мере достижения кислородом тканей и органов (в том числе и ЦНС) происходит спонтанное восстановление сознания. Если тело находится в жидкой среде, то происходит проникновение жидкости в дыхательные пути и развивается утопление (обычное или «сухое», связанное с ларингоспазмом). Одышка или диспно́э — нарушение частоты и глубины дыхания, сопровождающееся ощущением нехватки воздуха. В случае патологических изменений сердечной мышцы одышка поначалу появляется при физической нагрузке, а затем возникает и в покое, особенно в горизонтальном положении (в связи с увеличением венозного возврата крови к сердцу), заставляя пациента принимать вынужденное положение сидя, способствующее депонированию венозной крови системы нижней полой вены в ногах (ортопное). Приступы резкой одышки (чаще ночные) при заболеваниях сердца — проявление сердечной астмы: одышка в этих случаях инспираторная (затруднён вдох). Экспираторная одышка (затруднён выдох) возникает при сужении просвета мелких бронхов и бронхиол (например, при бронхиальной астме) или при потере эластичности лёгочной ткани (например, при развитии хронической эмфиземе лёгких). «Мозговая» одышка возникает при непосредственном раздражении дыхательного центра (опухоли, кровоизлияния и другие этиологические факторы). 24.Нарушения легочного кровотока, их причины и последствия. Общая недостаточность легочной перфузии. Легочная гипертензия, пре- и посткапилярные формы. Локальная неравномерность вентиляционно-перфузионных отношений. Легочные кровотечения могут быть разделены на первичные и вторичные. Вторичные кровотечения - это кровотечения, возникающие при нарушениисистемы коагуляции, при нарушении гемостаза, что наблюдается при геморрагических диатезах, передозировки антикоагулянтной терапии. Данные кровотечения не вызывают большой сложности при постановки диагноза, так как имеются множественные признаки возникшей патологии: подкожные кровоизлияния различной степени выраженности (могут быть петехии, синяки, а также другие элементы). Первичные кровотечения - фактически имеется кровотечение только из дыхательных путей. Две причины возникновения первичных кровотечений:1) Легочная гипертензия,2) Поражение собственно легочной ткани. При первичных кровотечениях мы имеем то или иное количество крови, отходящей с кашлем. Кровь поступает в дыхательные пути, раздражает стенки бронхов, что приводит к вызыванию кашлевого рефлекса. Кровотечение считается: • малым при потере до 5 % ОЦК,• умеренным — от 5 до 15 % ОЦК, • профузным — больше 15 % ОЦК. Во время легочного кровотечения больные возбуждены, испуганы, бледны. Вскоре появляются одышка, тахикардия, падает артериальное давление. В легких выслушиваются обильные разнокалиберные влажные хрипы, причем на ранних стадиях кровотечения они преобладают на стороне источника кровотечения. В норме величина общего кровотока в легких равна минутному объему крови сердца (МО) и составляет 4,5 — 5 л/мин. К нарушению перфузии легких могут привести следующие патологические процессы: 1) макро- и микроэмболии тромботическими массами, жиром, околоплодными водами, газом, вызывающие ишемию легкого; рефлекторные реакции в малом и большом круге кровообращения, бронхоспазм, выделение БАВ; 2) легочные васкулиты, в том числе аллергические, септические и др.; 3) легочная артериальная гипертензия, которая может быть следствием врожденных или приобретенных пороков сердца, левожелудочковой сердечной недостаточности, тромбоэмболии, гипоксии; 4) кардиогенный, анафилактический, гиповолемический шок и другие его виды. Нарушения легочной перфузии. Недостаточность легочного капиллярного кровотока может быть обусловлена уменьшением притока крови к капиллярам, затруднениями оттока и первичными нарушениями в системе микрососудов. Уменьшение притока крови к легким наблюдается при общей гиповолемии и правожелудочковой сердечной недостаточности, сопровождающихся падением системного давления крови в сосудах малого круга, а также при сужении просвета легочного ствола, легочных артерий в результате стеноза, тромбоза, эмболии, сдавления опухолью. Снижение капиллярного кровотока возникает при избыточном внутрилегочном шунтировании крови, в результате чего часть венозной по газовому составу крови переходит из системы бронхиальных вен и легочной артерии в систему легочных вен и в артериальную систему большого круга, минуя альвеолярные капилляры, и, следовательно, не участвует в газообмене. Легочный капиллярный кровоток может также уменьшаться из-за спазма артериол, их сдавления при сильном кашле и сужения суммарного просвета артериол при некоторых заболеваниях легких. Отток крови из легких затрудняется при левожелудочковой сердечной недостаточности, стенозе устий легочных вен или их сдавлении, врожденных дефектах межжелудочковой перегородки. Во всех этих случаях наблюдаются гипертензия малого круга кровообращения, уменьшение капиллярного кровотока и общего объема газообмена. Первичные нарушения капиллярного кровотока развиваются при сгущении крови и повышении ее вязкости, агрегации форменных элементов, нарушении стенок микрососудов, диссеминированном внутрисосудистом свертывании и микротромбозах мелких сосудов. Такое состояние может возникнуть при тяжелых интоксикациях, массивных кровопотерях, перегревании и других экстремальных состояниях Локальные нарушения вентиляционно-перфузионных отношений. Среди расстройств внешнего Д. важное значение имеют регионарные нарушения функций легких в виде локальных неравномерностей вентиляции и кровотока. При нарушении адекватности вентиляции и перфузии отдельные альвеолы, их группы или более значительные участки легочной ткани становятся для газообмена полностью или частично бесполезными. Легочное пространство, вентилируемое, но лишенное кровотока, включается в состав физиологического мертвого пространства. Альвеолы, омываемые кровью, но не вентилируемые, также не участвуют в газообмене, оттекающая от них кровь остается по газовому составу венозной и увеличивает долю неартериализированной крови, поступающей в левые отделы сердца и большой круг кровообращения Неравномерная альвеолярная вентиляция может быть обусловлена неодинаковой растяжимостью и эластичностью разных участков легочной ткани при ее ограниченных патологических изменениях (пневмофиброз, рубцевание, локальное растяжение) или при диффузных формах патологии (эмфизема легких, пневмокониозы и др.). Перераспределение давлений и объемов, связанное с различными условиями растяжения и спадения альвеол в процессе дыхательного цикла, приводит к сочетанию гипо- и гипервентилируемых участков легочной ткани, маятникообразному перемещению воздуха из одних альвеол в другие, увеличению физиологического мертвого пространства и венозной примеси к артериальной крови (так называемое функциональное шунтирование). Подобные явления возникают при неравномерном нарушении проходимости разных участков бронхиального дерева вследствие локального спазма бронхиол, скопления вязкого секрета, набухания слизистой оболочки и т.д. Неравномерная перфузия альвеол может быть обусловлена уменьшением кровотока по отдельным ветвям легочных артерий, локальной редукцией капилляров или локальным спазмом легочных сосудов. Причинами указанных явлений могут быть эмболия в системе легочных артерий, сдавление их ветвей, облитерирующие процессы, воздействие высоких концентраций гистамина, серотонина, микробных токсинов и др. легочная гипертензия — повышение кровяного давления в сосудах малого круга кровообращения. Причины возникновения легочной гипертензии разнообразны. Это прежде всего прекапиллярная легочная вазоконстрикция вследствие гипоксии и ацидоза в зонах гиповентиляции (альвеолокапиллярный рефлекс Эйлера—Лильестранда). Снижение уровня кислорода в ингалируемом воздухе до 10% повышает легочное давление вдвое. Гипоксия вызывает высвобождение гуморальных прессорных субстанций, увеличение концентрации внеклеточного калия, что способствует сдвигу отрицательного трансмембранного потенциала покоя к нулю. В соответствии с уровнем трансмембранного потенциала отмечается расслабление или сокращение гладких мышц легочных артерий. Гипоксия также обусловливает увеличение концентрации в крови катехоламинов, которые усугубляют вазоконстрикцию. Поэтому имеется обратная и тесная связь между степенью легочной гипертензии и парциальным давлением кислорода в артериальной крови, выраженностью ацидоза и уменьшением ЖЕЛ. 25.Нарушение альвеолокапалярной диффузии. Их причины и последствия. Смешанные формы нарушений внешнего дыхания НАРУШЕНИЯ ДИФФУЗИИ ГАЗОВ В ЛЕГКИХ Проникновение кислорода из альвеолярного пространства в кровь и углекислоты из крови в альвеолярное пространство происходит, как известно, по законам диффузии. Установлено, что для того, чтобы молекулярный кислород соединился с гемоглобином, ему необходимо преодолеть тонкий слой жидкости на поверхности альвеолярных клеток, альвеолокапиллярную мембрану, представленную слоем альвеолярных и эндотелиальных клеток и находящимся между ними слоем волокнистых элементов и межуточного вещества соединительной ткани, слой плазмы крови и мембрану эритроцитов. Углекислота проходит тот же путь, но в обратном направлении. Диффузионная способность легких зависит, главным образом, от толщины указанных слоев, а также от степени их проницаемости для газов. Кроме того, для нормального течения диффузии имеет значение общая площадь мембран, через которые проходят O2 и СO2, и время контакта крови с альвеолярным воздухом. Изменение одного из этих факторов может привести к развитию недостаточности дыхания. Нарушение структуры альвеолокапиллярной мембраны. В легких могут развиваться патологические процессы, сопровождающиеся утолщением стенки альвеол и капиллярных сосудов, увеличением количества соединительной ткани между ними (рис. 20.4). При этом увеличивается путь для диффузии газов, понижается проницаемость мембран — развивается альвеолокапиллярный блок. К возникновению альвеолокапиллярного блока ведут многие диффузные поражения легких — саркоидоз, пневмокониоз различной этиологии, фиброз, склеродермия, пневмония (хроническая или острая), эмфизема, отек легкого. Следует отметить, что при таких заболеваниях, как пневмония или недостаточность сердца в стадии декомпенсации, путь прохождения газов удлиняется вследствие увеличения количества жидкости в просвете легочных артериол, а также в тканях легкого. 26.Этиология и патогенез ОДН при респираторном дистресс-синдроме. РДСВ - форма острой дыхательной недостаточности (ОДН), полиэтиоло гическое заболевание, характеризующееся острым началом, выраженной ги поксемией не устраняемой оксигенотерапией, интерстициальным отеком и диффузной инфильтрацией легких. Этиология. - множественная трава или ожоги- геморрагический шок, массивные трансфузии и искусственное кро вообращение при операциях или интенсивной терапии- длительная гиповолемия, включая травматический, кардиогенный, анафилактический и др. виды шока.синдром рассеянного внутрисосудистого свертывания.сепсис, а также инфекционно- токсический шоковый синдром.аспирация, включая утопление и вдыхание токсических газов (включая 100% кислород).острые заболевания и повреждение легких - тотальная пневмония, контузии, эмболии, в т.ч. жировая.острый панкреотит, перитонит. Патогенез: РДСВ может возникнуть при прямом повреждении легких кислотами, токсинами (в т.ч. бактериальными), гипероксии, а также под действием агрессивных веществ, выделяющихся при деструкции задержанных легкими микроэмболов, состоящих из агрегатов клеток (в частности, нейтрофилов) и капель дезэмульгированного жира. Освободившиеся из нейтрофилов фер менты - гл. образом, эластазы, коллагеназы и др.- повреждают интерсти ций, растворяя эластин, коллаген, фибронектин и др. белки. Фибронек тин, например, встречающийся в циркулирующей и тканевой форме, обеспе чивает сцепление между собой клеток эндотелия и неспецифическую опсо ниновую защитную активность организма.Свободные радикалы, выделяющиеся вместе с ферментами, повреждают клеточные мембраны, вызывая пероксидацию липидов, а также разрушают гиалуроновую кислоту- связывающую массу соедлинительной ткани. Прони цаемость мембраны возрастает еще более. Эффект усиливается при ингаля ции 100% кислорода.Липиды мембраны, содержащие арахидоновую и др. кислоты, дают при их гидролизе альдегиды, еще больше повреждая целостность мембраны. Не насыщенные жирные кислоты, образующиеся при гидролизе микроэмболов жи ра, также повреждают альвеолокапиллярную мембрану.Присоединяется и непрямой эффект эйкозаноидов, т.е. продуктов распада арахидоновой кислоты (простагландины, тромбоксаны, лейкотрие ны), которые не только еще больше увеличивают проницаемость мембраны, но и обладают выраженной бронхо- и вазомоторной активностью, вызывают спазм легочных вен и усиливают тромбообразование. Агрегация и дегрануляция нейтрофилов сочетается с активацией комплемента и выходов хемотаксических анафилатоксинов С3 и С5, с обра зованием продуктов деградации фибрина в ходе фибринолиза и с активаци ей калликреин - кининовой системы. При таком массивном ударе биологически активных веществ по алвео локапиллярной мембране она резко утолщается и, следовательно, диффузия газов через нее нарушается. Мембрана пропускает внутрь альвеолы плаз менные белки, например, фибриноген, которые не только инактивируют сурфактантную систему легких (и без того угнетенную в связи с ишемией альвеолярной ткани, продуцирующей сурфактант), но и образует т.н. гиа линовые мембраны, выстилающие изнутри альвеолярную поверхность. Благо даря этому растяжимость легких резко снижается, они становятся жестки ми, образуются микроателектазы, возникают выраженная гиповентиляции и шунтирование крови, благодаря которой артериальная гипоксемия не пода ется оксигенотерапии даже 100% кислородом. В конечных стадиях РДСВ могут развиваться легочная артериальная гипертензия и правожелудочковая, а затем и левожелудочковая недоста точность. Однако в начале РДСВ легочное артериальное давление низкое меньше 12 мм рт.ст. В дальнейшем легочная артериальная гипертензия постепенно нарастает параллельно правожелудочковой недостаточности, но одновременно увеличивается и левожелудочковая недостаточность, гл. об разом в связи с гипоксией и метаболическими расстройствами Этиология и патогенез новорождённых. Сурфактант начинает вырабатываться в легких плода с 20—24-й недели беременности, и к 36-й неделе система, обеспечивающая его синтез, полностью созревает. В момент родов синтез сурфактанта резко возрастает, что облегчает первичное расправление и стабилизацию альвеол новорожденного. При преждевременных родах, особенно при родах до 36-й недели беременности, легкие незрелые, количество сурфактанта недостаточно для полноценного расправления альвеол, чем и объясняется высокая частота развития Д.-с. р. н. у недоношенных детей: тяжелый Д.-с. р. н., развивающийся у недоношенных детей с массой тела менее 1500 г, носит название синдрома Вильсон — Микити (см. Пневмония, у детей). Дефицит сурфакислотанта значительно возрастает при быстрых родах. Содержание сурфактанта в альвеолах снижается также при острой гипоксии плода во время родов и асфиксии после рождения, надпочечниковой недостаточности, гипотиреозе, ацидозе различного генеза у новорожденного, родоразрешении путем кесарева сечения, сахарном диабете у беременной. При недостатке сурфактанта не все участки легкого расправляются после рождения. Формируются первичные ателектазы (см. Ателектаз легкого). Вследствие неполноценной вентиляции развиваются гипоксия и ацидоз, иногда снижается АД. Возникают рефлекторный спазм легочных артериол, отек стенок альвеол, нарушается проницаемость альвеолокапиллярной мембраны. Последнее может привести к выходу плазмы из легочных капилляров с последующим выпадением на поверхности дыхательных бронхиол, альвеолярных протоков и альвеол гиалиноподобных веществ и образованием так называемых гиалиновых мембран (гиалиново-мембранная болезнь). Гиалиновые мембраны способствуют еще большему снижению синтеза сурфактанта и развитию ателектазов легких. Вследствие развивающихся легочной гипертензии и ацидоза нарушается обычная для раннего неонатального периода перестройка кровообращения, в связи с чем сохраняются фетальные коммуникации (овальное отверстие в межпредсердной перегородке, артериальный проток, соединяющий легочный ствол с аортой). При этом усугубляется гипоксия, происходит диссеминированное внутрисосудистое свертывание крови (см. Тромбогеморрагический синдром), появляются отеки, кровоизлияния, кровоточивость (отечно-геморрагический синдром); все это приводит к еще большему нарушению синтеза сурфактанта, возникает так называемый порочный круг. Провоцирующими факторами в развитии Д.-с. р. н. могут быть также аспирация (например, околоплодных вод), транзиторное тахипноэ, апноэ, гипотермия, гиповолемия (например, вследствие разрыва пуповины при рождении, кровотечения из пересеченной пуповины, скопления крови в плаценте до перерезки пуповины). Эти факторы могут приводить к формированию гиалиновых мембран и развитию отечно-геморрагического синдрома без предшествующего образования ателектазов легких. 27. Компенсаторно-приспособительные процессы в системе внешнего дыхания ,при повреждении её звеньев. Альвеолярная гипервентиляция .Причины ,механизмы, последствия Поскольку основным патогенетическим фактором гипоксии является кислородное голодание тканей, развитие компенсаторно-приспособительных реакций направлено на увеличение оксигенации крови и поддержание обменных процессов на достаточном для жизненного функционирования тканей уровне. Естественно, что при различных формах гипоксии и при разной степени ее выраженности как общий объем этих механизмов и их «набор», так и удельный вес каждого из них будет неодинаков. Однако всегда в процессы саногенеза при гипоксии включаются компенсаторные изменения системы дыхания, кровообращения и крови.Одна из наиболее ранних реакций на гипоксию - изменения внешнего дыхания, которые выражаются в увеличении альвеолярной вентиляции, прежде всего за счет углубления и учащения дыхания, а также включения в дыхательный акт резервных альвеол. Эти реакции возникают как рефлекторно при раздражении хеморецепторов синокаротидной зоны, так и вследствие непосредственного возбуждения дыхательного центра из-за недостаточного содержания кислорода, а также ряда физико-химических изменений, возникающих в крови при гипоксии (в частности, первичного метаболического ацидоза). При гистотоксической гипоксии, несомненно, играют роль рефлекторные влияния из органов с нарушенным тканевым дыханием. Усиление легочной вентиляции сопровождается возрастанием легочного кровотока, что способствует усилению диффузии кислорода в систему легочных капилляров.Второй ранней приспособительной реакцией в условиях кислородного голодания являются изменения деятельности сердечно-сосудистой системы.Наряду с повышением частоты сердечных сокращений наблюдается увеличение ударного выброса сердца, что приводит к значительному повышению его минутного объема и объемной скорости кровотока. Наблюдения над участниками экспедиции на Эльбрус свидетельствуют о том, что при быстром подъеме на высоту 5000 м минутный объем сердца возрастал в среднем на 100%, а у отдельных участников этот показатель увеличивался на 150% и более.Стимуляция сердечной деятельности в условиях кислородного голодания осуществляется сложными нейрогуморальными механизмами, включающими рефлекторные влияния с хеморецепторов синокаротидной и аортальной областей, а также воздействие на β-адренорецепторы сердца катехоламинов, концентрация которых при гипоксии в крови повышена, так как кислородное голодание - это стрессорное состояние организма, а любой стресс характеризуется выбросом катехоламинов.Существенное значение в развитии процесса адаптации к гипоксии имеют перераспределительные реакции сосудистого русла, благодаря которым основная масса крови направляется через локально расширенные артериолы в область головного мозга и сердца.Исследования коронарного кровотока при острой экзогенной гипоксии, проведенные в условиях барокамеры, имитирующих подъем на высоту, показали несомненное усиление кровоснабжения сердечной мышцы. Механизмы этой реакции включают несколько факторов. Во-первых, для повышения коронарного кровотока существенное значение имеет усиление сократительной функции сердца и обусловленное этим увеличение перфузии коронарных сосудов. Во-вторых, несомненную роль в генезе интенсификации коронарного кровотока при гипоксии играет активация симпато-адреналовой системы и обусловленное катехоламинами расширение коронарных артерий. И в-третьих, в механизмах этой реакции определенное значение имеют и местные метаболические реакции, связанные с накоплением при гипоксии в сердечной мышце веществ, обладающих сосудорасширяющим действием. К таким веществам, в частности, относится аденозин, образующийся при распаде АТФ и обладающий коронарорасширяющим эффектом, а также простагландины, регулирующие кровообращение на уровне капилляров.Следует также отметить, что гипоксия сопровождается рефлекторным раскрытием нефункционирующих в интактном организме капилляров (усиление коллатерального кровообращения), что улучшает кровоснабжение тканей.Несомненно, для адаптации к гипоксии имеют значение и своеобразные свойства молекулы гемоглобина, заключающиеся в том, что по мере присоединения кислорода к железу геминовых группировок сродство последних к кислороду увеличивается и окисление четвертого гема происходит в 500 раз быстрее, чем первого, что обуславливает достаточно высокое насыщение гемоглобина кислородом, даже при выраженном снижении напряжения кислорода в плазме легочных капилляров.Имеется также определенная зависимость сродства гемоглобина к кислороду от активной реакции среды и pCO2 - показателей, меняющихся в условиях гипоксии. При смещении pH в кислую сторону сродство гемоглобина к кислороду снижается, и это способствует усилению отдачи последнего тканям.К реакциям быстрой адаптации при гипоксии относится и увеличение кислородной емкости крови за счет выброса эритроцитов из депо и активации их образования в костном мозге. В результате повышается содержание гемоглобина в крови, что выявляется, например, уже через 2-3 суток после быстрого подъема в горы.Если выброс эритроцитов из депо при гипоксии имеет преимущественно рефлекторный генез, то механизмы стимуляции эритропоэза более многоплановы и сложны. В основном они сводятся к следующему.Кислородное голодание приводит к метаболическим сдвигам, вследствие чего раздражаются специфические хеморецепторы, расположенные в различных органах и тканях, что стимулирует выработку и высвобождение в почках эритрогенина и в печени - эритропоэтиногена. Взаимодействие этих двух веществ приводит к образованию эритропоэтина, который и активирует эритропоэз путем воздействия на незрелые стволовые клетки костного мозга, а также на уже дифференцированные ядросодержащие клетки эритроцитарного ряда. Эритропоэтин стимулирует также выход в периферическую кровь ретикулоцитов.Определенные приспособительные реакции развиваются и на уровне обменных процессов в клетках и заключаются в снижении интенсивности протекания тех из них, которые не принимают непосредственного участия в процессах обеспечения организма кислородом, а также в повышении активности дыхательных ферментов, усилении сопряженности окисления и фосфорилирования и в активации гликолиза с анаэробным синтезом АТФ.Выше были описаны реакции срочной адаптации организма к гипоксии. При длительной адаптации, которая включается при всех видах хронической гипоксии, имеет место и ряд других механизмов, заключающихся не только в функциональной, но и структурной перестройке органов и тканей. При долговременной адаптации увеличивается мощность дыхательной мускулатуры, емкость грудной клетки и число альвеол в легких, что повышает общую дыхательную поверхность последних. Развивается гипертрофия миокарда и повышение его сократительной способности при одновременном снижении потребления кислорода сердечной мышцей. Значительно увеличивается образование эритроцитов за счет активации регенераторной функции красного костного мозга, что может быть обусловлено повышением чувствительности последнего к действию эритропоэтинов. Гипервентиляция лёгких (альвеолярная гипервентиляция) — типовая форма нарушения внешнего дыхания, характеризующаяся превышением реальной вентиляции лёгких за единицу времени в сравнении с необходимой организму в данных условиях. • Причины альвеолярной гипервентиляции. - Неадекватный режим ИВЛ (например, при проведении наркоза, переводе пациента на искусственное дыхание при травме мозга или коме). Развивающуюся при этом гипервентиляцию называют пассивной. - Стресс-реакции, невротические состояния (например, истерии или фобии). - Органические повреждения мозга (например, в результате кровоизлияния, ишемии, при внутричерепных опухолях, ушибе и сотрясении мозга). - Гипертермические состояния (лихорадка, тепловой удар и др.). - Экзогенная гипоксия. • Проявления альвеолярной гипервентиляции. Основные проявления альвеолярной гипервентиляции представлены на рисунке. - Гипокапния (потенцирует торможение утилизации 02 тканями, снижает коронарный и мозговой кровоток за счёт уменьшения тонуса стенок артериол и развития артериальной гипотензии). - Дыхательный алкалоз (как следствие альвеолярной гипервентиляции). - Снижение потребления кислорода тканями и органами (что может привести к тканевой гипоксии). - Дисбаланс ионов в плазме крови и интерстициальной жидкости (характеризуется гипернатриемией, гипокалиемией, гипокальциемией, гипомагниемией). - Мышечные судороги (в связи с гипокальциемией и другими проявлениями ионного дисбаланса). - Парестезии (как следствие ишемии мозга и ионного дисбаланса). 28 Изменение вентиляционных показателей газового состояния крови при дых. Недостаточности и при гипервентиляции. Профилактика и лечение. Под недостаточностью легочного дыхания понимают неспособность аппарата дыхания обеспечивать на должном уровне насыщение крови кислородом и удаление из нее углекислоты. Показатели недостаточности внешнего дыхания К числу показателей, характеризующих недостаточность внешнего дыхания, относятся: 1) показатели вентиляции легких; 2) коэффициент эффективности (диффузии) легких; 3) газовый состав крови; 4) одышка. Нарушения легочной вентиляцииИзменения легочной вентиляции могут носить характер гипервентиляции, гиповентиляции и неравномерной вентиляции. Практически газообмен происходит только в альвеолах, поэтому истинным показателем вентиляции легких является величина альвеолярной вентиляции (АВ). Она представляет собой произведение частоты дыхания на разницу между дыхательным объемом и объемом мертвого пространства: АВ – частота дыхания х (дыхательный объем – объем мертвого пространства). В норме АВ = 12 х (0,5 – 0,14) = 4,3 л/мин. Гипервентиляция легких означает увеличение вентиляции больше, чем это требуется для поддержки необходимого напряжения кислорода и углекислоты в артериальной крови. Гипервентиляция ведет к повышению напряжения О2 и падению напряжения СО2 в альвеолярном воздухе. Соответственно падает напряжение СО2 в артериальной крови (гипокапния), возникает газовый алкалоз. По механизму развития различают гипервентиляцию, связанную с заболеванием легких, например, при спадении (коллапсе) альвеол или при накоплении в них воспалительного выпота (экссудата). В этих случаях уменьшение дыхательной поверхности легких компенсируется за счет гипервентиляции. Гипервентиляция может быть результатом различных поражений центральной нервной системы. Так, некоторые случаи менингита, энцефалита, кровоизлияния в мозг и его травмы приводят к возбуждению дыхательного центра (возможно, в результате повреждения функции варолиева моста, тормозящего бульбарный дыхательный центр). Гипервентиляция может возникнуть и рефлекторно, например, при болях, особенно соматических, в горячей ванне (перевозбуждение терморецепторов кожи) и т. п. В случаях острой гипотензии гипервентиляция развивается либо рефлекторно (раздражение рецепторов аортальных и синокаротидных зон), либо центрогенно – гипотензия и замедление кровотока в тканях способствуют повышению рСО2 в них и, как следствие, возбуждению дыхательного центра.Усиление метаболизма, например, при лихорадке или гиперфункции щитовидной железы, как и ацидоз обменного происхождения, приводит к повышению возбудимости дыхательного центра и гипервентиляции.В некоторых случаях гипоксии (например, при горной болезни, анемии) рефлекторно возникающая гипервентиляция имеет приспособительное значение.Гиповентиляция легких. Зависит, как правило, от поражения аппарата дыхания – болезни легких, дыхательных мышц, нарушения кровообращения и иннервации аппарата дыхания, угнетения дыхательного центра наркотиками. Повышение внутричерепного давления и расстройства мозгового кровообращения, угнетающие функцию дыхательного центра, также могут стать причиной гиповентиляции.Гиповентиляция ведет к гипоксии (снижение рО2 в артериальной крови) и гиперкапнии (повышение рСО2 в артериальной крови).Неравномерная вентиляция. Наблюдается в физиологических условиях даже у здоровых молодых людей и в большей степени у пожилых в результате того, что не все альвеолы легких функционируют одновременно, в связи с чем различные участки легких тоже вентилируются неравномерно. Эта неравномерность бывает особенно резко выраженной при некоторых заболеваниях аппарата дыхания.Неравномерная вентиляция может возникнуть при потере эластичности легких (например, при эмфиземе), затруднении бронхиальной проходимости (например, при бронхиальной астме), скоплении экссудата или другой жидкости в альвеолах, при фиброзе легких.Неравномерная вентиляция, как и гиповентиляция, ведет к гипоксемии, но не всегда сопровождается гиперкапнией.Изменения легочных объемов и емкостей. Нарушения вентиляции, как правило, сопровождаются изменениями легочных объемов и емкостей. Объем воздуха, который легкие могут вместить при максимально глубоком вдохе, называют общей емкостью легких (ОЕЛ). Эта общая емкость складывается из жизненной емкости легких (ЖЕЛ) и остаточного объема.Жизненная емкость легких (в норме она колеблется от 3,5 до 5 л) в основном характеризует ту амплитуду, в пределах которой возможны дыхательные экскурсии. Ее снижение указывает, что какие-то причины препятствуют свободным экскурсиям грудной клетки. Уменьшение ЖЕЛ наблюдается при пневмотораксе, экссудативном плеврите, спазме бронхов, стенозе верхних дыхательных путей, нарушениях движений диафрагмы и других дыхательных мышц.Остаточный объем представляет собой объем легких, занятых альвеолярным воздухом и воздухом мертвого пространства. Его величина в нормальных условиях такова, что обеспечивается достаточно быстрый газообмен (в норме он равен примерно 1/3 общей емкости легких). При заболеваниях легких величина остаточного объема и его вентиляция меняются. Так, при эмфиземе легких остаточный объем увеличивается значительно, поэтому вдыхаемый воздух распределяется неравномерно, альвеолярная вентиляция нарушается – снижается рО2 и нарастает рСО2. Остаточный объем возрастает при бронхитах и бронхоспастических состояниях. При экссудативном плеврите и пневмотораксе значительно уменьшаются общая емкость легких и остаточный объем. Для объективной оценки состояния вентиляции легких и его отклонений в клинике определяют следующие показатели: 1) частота дыхания – в норме у взрослых равна 10 – 16 в минуту; 2) дыхательный объем (ДО) – около 0,5 л; 3) минутный объем дыхания (МОД = частота дыханиях х ДО) в условиях покоя колеблется от 6 до 8 л; 4) максимальная вентиляция легких (МВЛ) и др. Все эти показатели существенно меняются при различных заболеваниях аппарата дыхания.Изменение коэффициента эффективности (диффузии) легкихКоэффициент эффективности падает при нарушении диффузионной способности легких. Нарушение диффузии кислорода в легких может зависеть от уменьшения дыхательной поверхности легких (в норме около 90 м2), от толщины альвеоло-капиллярной мембраны и ее свойств. Если бы диффузия кислорода происходила одновременно и равномерно во всех альвеолах легких, диффузионная способность легких, рассчитанная по формуле Крога, составляла бы около 1,7 л кислорода в минуту. Однако в силу неравномерной вентиляции альвеол коэффициент диффузии кислорода в норме равен 15 – 25 мл/мм рт. ст./мин. Эта величина считается показателем эффективности легких и падение ее – один из признаков недостаточности дыхания. Изменения газового состава крови Нарушения газового состава крови – гипоксемия и гиперкапния (в случае гипервентиляции – гипокапния) являются важными показателями недостаточности внешнего дыхания. Гипоксемия. В норме в артериальной крови содержится 20,3 мл кислорода на 100 мл крови (из них 20 мл связаны с гемоглобином, 0,3 мл находятся в растворенном состоянии), насыщение гемоглобина кислородом – около 97 %. Нарушения вентиляции легких (гиповентиляция, неравномерная вентиляция) уменьшают оксигенацию крови. В результате увеличивается количество восстановленного гемоглобина, возникает гипоксия (кислородное голодание тканей), цианоз – синюшная окраска тканей. При нормальном содержании в крови гемоглобина цианоз появляется в том случае, если насыщение артериальной крови кислородом падает до 80 % (содержание кислорода меньше 16 об.%). Гипер– или гипокапния и нарушения кислотно-щелочного равновесия – это важные показатели недостаточности дыхания. В норме в артериальной крови содержание СО2 равно 49 об.% (напряжение СО2 – 41 мм рт. ст.), в смешанной венозной крови (из правого предсердия) – 53 об.% (напряжение СО2 – 46,5 мм рт. ст.). Напряжение углекислого газа в артериальной крови увеличивается при тотальной гиповентиляции легких или при несоответствии между вентиляцией и перфузией (легочным кровотоком). Задержка выделения СО2 с повышением его напряжения в крови приводит к изменениям кислотно-щелочного равновесия и развитию ацидоза. Падение напряжения СО2 в артериальной крови в результате увеличенной вентиляции сопровождается газовым алкалозом. Недостаточность внешнего дыхания может возникнуть при нарушениях функции или строения дыхательных путей, легких, плевры, грудной клетки, дыхательных мышц, расстройствах иннервации и кровоснабжения легких и изменении состава вдыхаемого воздуха. 29 Этиология и патогенез расстройств пищеварительной системы. Функциональные связи различных отдельных пищ. систем в пат.условиях? Недостаточность пищеварения - состояние желудочно-кишечного тракта (ЖКТ), при котором не происходит достаточного усвоения поступающей в организм пищи. Желудочно-кишечная патология весьма многообразна, так как наряду с кожей и органами дыхания чаще других подвергается действию чрезвы чайных раздражителей. Причины, вызывающие патологию ЖКТ, подразделяют на повреждающие органы пищеварения непосредственно и опосредованно.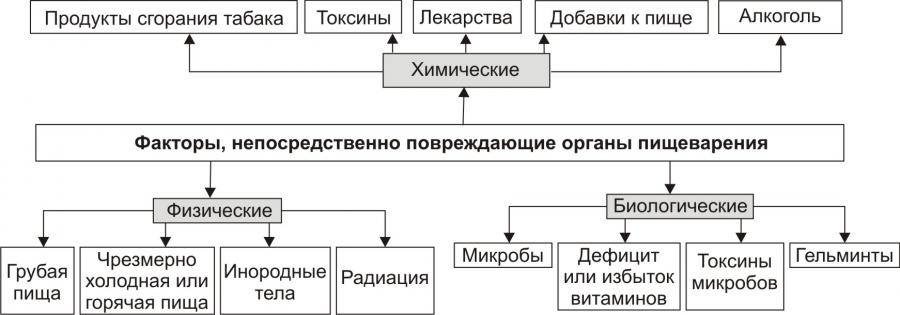 Рис. 1. Основные причины нарушения пищеварения в желудке и кишечнике: факторы, непосредственно повреждающие органы пищеварения. 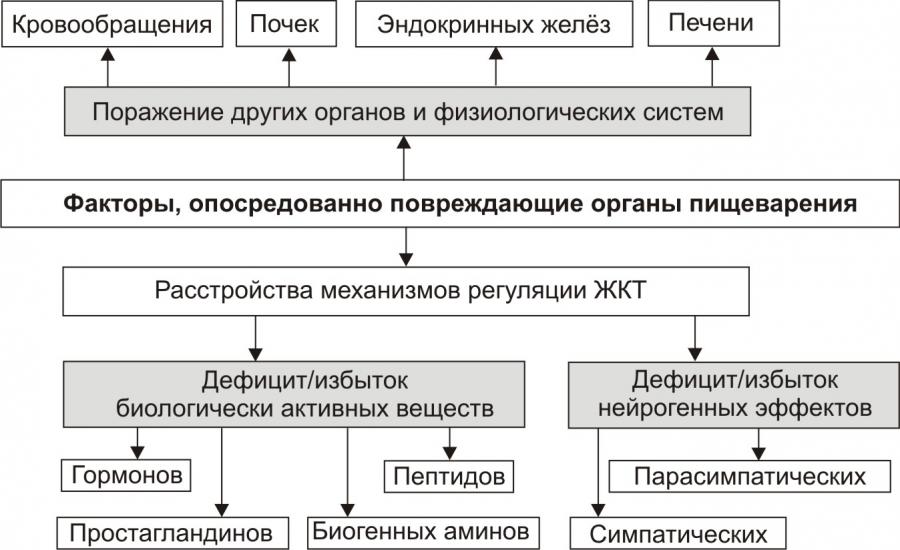 Рис. 2. Основные причины нарушения пищеварения в желудке и кишечнике: факторы, опосредованно повреждающие органы пищеварения. |
