инфекция и им-т. 1. Понятие об инфекционном процессе. Факторы инфекционного процесса. Формы симбиоза макро и микроорганизма. Роль макроорганизма и микроорганизмов в инфекционном процессе
 Скачать 188.19 Kb. Скачать 188.19 Kb.
|
|
Реакция непрямой (пассивной) гемагглютинации (РНГА, РПГА) основана на использовании эритроцитов (или латекса) с адсорбированными на их поверхности антигенами или антителами, взаимодействие которых с соответствующими антителами или антигенами сыворотки крови больных вызывает склеивание и выпадение эритроцитов на дно пробирки или ячейки в виде фестончатого осадка. Компоненты. Для постановки РНГА могут быть использованы эритроциты барана, лошади, кролика, курицы, мыши, человека и другие, которые заготавливают впрок, обрабатывая формалином или глютаральдегидом. Адсорбционная емкость эритроцитов увеличивается при обработке их растворами танина или хлорида хрома. Антигенами в РНГА могут служить полисахаридные АГ микроорганизмов, экстракты бактериальных вакцин, АГ вирусов и риккетсий, а также другие вещества. Эритроциты, сенсибилизированные АГ, называются эритроцитарными диагностикумами. Для приготовления эритроцитарного диагностикума чаще всего используют эритроциты барана, обладающие высокой адсорбирующей активностью. Применение. РНГА применяют для диагностики инфекционных болезней, определения гонадотропного гормона в моче при установлении беременности, для выявления повышенной чувствительности к лекарственным препаратам, гормонам и в некоторых других случаях. Механизм. Реакция непрямой гемагглютинации (РНГА) отличается значительно более высокой чувствительностью и специфичностью, чем реакция агглютинации. Ее используют для идентификации возбудителя по его антигенной структуре или для индикации и идентификации бактериальных продуктов — токсинов в исследуемом патологическом материале. Соответственно используют стандартные (коммерческие) эритроцитарные антительные диагностикумы, полученные путем адсорбции специфических антител на поверхности танизированных (обработанных танином) эритроцитов. В лунках пластмассовых пластин готовят последовательные разведения исследуемого материала. Затем в каждую лунку вносят одинаковый объем 3 % суспензии нагруженных антителами эритроцитов. При необходимости реакцию ставят параллельно в нескольких рядах лунок с эритроцитами, нагруженными антителами разной групповой специфичности. Через 2 ч инкубации при 37 °С учитывают результаты, оценивая внешний вид осадка эритроцитов (без встряхивания): при отрицательной реакции появляется осадок в виде компактного.диска или кольца на дне лунки, при положительной реакции — характерный кружевной осадок эритроцитов, тонкая пленка с неровными краями. 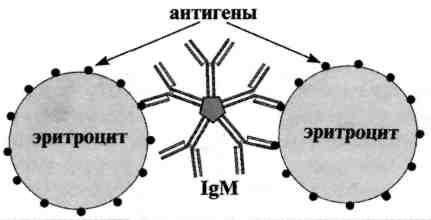 Реакция торможения гемагглютинации (РТГА) - метод идентификации вируса или выявления противовирусных антител в сыворотке крови больного, основанный на феномене отсутствия агглютинации эритроцитов препаратом, содержащим вирус, в присутствии иммунной к нему сыворотки крови. Реакция торможения гемагглютинации (РТГА) основана на блокаде, подавлении антигенов вирусов антителами иммунной сыворотки, в результате чего вирусы теряют свойство агглютинировать эритроциты. РТГА применяют для диагностики многих вирусных болезней, возбудители которых (вирусы гриппа, кори, краснухи, клещевого энцефалита и др.) могут агглютинировать эритроциты различных животных. Механизм. Типирование вируса проводят в реакции торможения гемаг-глютинации (РТГА) с набором типоспецифических сывороток. Результаты реакции учитывают по отсутствию гемагглютинации. Подтипы вируса А с антигенами H0N1, H1N1, Н2N2, H3N2 и др. могут быть дифференцированы в РТГА с набором гомологичных типоспецифических сывороток. 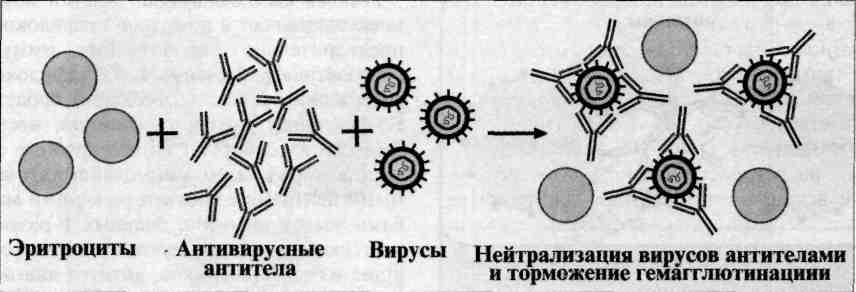 23 Иммуноферментный метод исследования. Принцип метода. Определение антигенов и антител с помощью ИФА. Иммуноферментный анализ — лабораторный иммунологический метод качественного или количественного определения различных соединений, макромолекул, вирусов и пр., в основе которого лежит специфическая реакции антиген-антитело. Выявление образовавшегося комплекса проводят с использованием фермента в качестве метки для регистрации сигнала. Классификация: Конкурентный (в системе одновременно присутствует анализируемое соединение и его аналог) Неконкурентный (Если в системе присутствуют только анализируемое соединение и соответствующие ему центры связывания (антиген и специфические антитела)) Прямой и непрямой Прямой: 1.сыворотку,содержащую смесь ат, инкубируют с аг, фиксированным на твердом субстрате. 2.ат,не связывающие аг, удаляют многократным промыванием. 3. вносят меченную ферментом антисыворотку к ат, связывавшим аг 4.определят количество фермента-маркера, связавшегося с ат Непрямой: Ат-положительная сыворотка 1.специфические ат в иследуемой сыворотке связывают аг, фиксированный на твердом субстрате 2. специфичные ат, меченные ферментом,не взаимодействуют со связанным аг-содержание маркера в субстрате низкое Ат-отрицательная сыворотка 1. Неспецифические ат в исследуемой сыворотке не связывают аг, фиксированный на твердом субстрате 2. Специфические ат, меченные ферментом, взаимодействуют, с фиксированным аг –содержание маркера высокое Наиболее распространен твердофазный ифа, при котором один из компонентов иммунной реакции(антиген или антитело) сорбирован на твердом носителе. В качестве твердого носителя используется микропанели из полистирола. При определении антител в лунки с сорбированным антигеном последовательно добавляют сыворотку крови, меченную ферментом, и смесь растворов для фермента и хромогена. Каждый раз после добавления очередного компонента из лунок удаляют не связавшиеся реагенты путем тщательного промывания. При положительном результате изменяется цвет раствора хромогена. Твердофазный носитель можно сенсибилизировать не только антигеном, но и антителом. Тогда в лунки с сорбированными антителами вносят искомый антиген, добавляют иммунную сыворотку против антигена, меченную ферментом, а затем-смесь растворов субстрата для фермента и хромогена. Применение:для диагностики заболеваний, вызванных вирусными и бактериальными возбудителями. 24 Гиперчувствительность замедленного типа. Механизм ее проявления. Аллергические пробы. Практическое использование в диагностике инфекционных заболеваний. К аллергическим реакциям относят два типа реагирования на чужеродное вещество: гиперчувствительность немедленного типа (ГНТ) и гиперчувствительность замедленного типа (ГЗТ). К ГНТ относятся аллергические реакции, проявляющиеся уже через 20—30 мин после повторной встречи с антигеном, а к ГЗТ — реакции, возникающие не ранее чем через 24—48 ч. Механизм и клинические проявления ГНТ и ГЗТ различны. ГНТ связана с выработкой антител, а ГЗТ — с клеточными реакциями. ГЗТ впервые описана Р. Кохом (1890). Эта форма проявления не связана с антителами, опосредована клеточными механизмами с участием Т-лимфоцитов. К ГЗТ относятся следующие формы проявления: туберкулиновая реакция, замедленная аллергия к белкам, контактная аллергия. В отличие от реакций I, II и III типов реакции IV типа не связаны с антителами, а обусловлены клеточными реакциями, прежде всего Т-лимфоцитами. Реакции замедленного типа могут возникать при сенсибилизации организма: 1. Микроорганизмами и микробными антигенами (бактериальными, грибковыми, протозойными, вирусными); 2. Гельминтами; 3. Природными и искусственно синтезированными гаптенами (лекарственные препараты, красители); 4. Некоторыми белками. Следовательно, реакция замедленного типа может вызываться практически всеми антигенами. Но наиболее ярко она проявляется на введение полисахаридов, низкомолекулярных пептидов, т. е. малоиммуногенных антигенов. При этом реакцию вызывают малые дозы антигенов и лучше всего при внутрикожном введении. Механизм аллергической реакции этого типа состоит в сенсибилизации Т-лимфоцитов-хелперов антигеном. Сенсибилизация лимфоцитов вызывает выделение медиаторов, в частности интерлейкина-2, которые активируют макрофаги и тем самым вовлекают их в процесс разрушения антигена, вызвавшего сенсибилизацию лимфоцитов. Цитотоксичность проявляют также и сами Т-лимфоциты. О роли лимфоцитов в возникновении аллергий клеточного типа свидетельствуют возможность передачи аллергии от сенсибилизированного животного несенсибилизированному с помощью введения лимфоцитов, а также подавление реакции при помощи антилимфоцитарной сыворотки. Морфологическая картина при аллергиях клеточного типа носит воспалительный характер, обусловленный реакцией лимфоцитов и макрофагов на образующийся комплекс антигена с сенсибилизированными лимфоцитами. Аллергические реакции клеточного типа проявляются в виде туберкулиновой реакции, замедленной аллергии к белкам, контактной аллергии. Туберкулиновая реакция возникает через 5—6 ч после внутрикожного введения сенсибилизированным туберкулезной палочкой животным или человеку туберкулина, т. е. антигенов туберкулезной палочки. Выражается реакция в виде покраснения, припухлости, уплотнения на месте введения туберкулина. Сопровождается иногда повышением температуры тела, лимфопенией. Развитие реакции достигает максимума через 24—48 ч. Туберкулиновая реакция используется с диагностической целью для выявления заболеваний туберкулезом или контактов организма с туберкулезной палочкой. Замедленная аллергия возникает при сенсибилизации малыми дозами белковых антигенов с адъювантом, а также конъю-гатами белков с гаптенами. В этих случаях аллергическая реакция возникает не раньше чем через 5 дней и длится 2—3 нед. Видимо, здесь играют роль замедленное действие конъюгированных белков на лимфоидную ткань и сенсибилизация Т-лимфо-цитов. Контактная аллергия возникает, если антигенами являются низкомолекулярные органические и неорганические вещества, которые в организме соединяются с белками, образуя конъюга-ты. Конъюгированные соединения, выполняя роль гаптенов, вызывают сенсибилизацию. Контактная аллергия может возникать при длительном контакте с химическими веществами, в том числе фармацевтическими препаратами, красками, косметическими препаратами (губная помада, краска для ресниц). Проявляется контактная аллергия в виде всевозможных дерматитов, т. е. поражений поверхностных слоев кожи. Значение. Все реакции гиперчувствительности, в том числе и ГЗТ имеют большое значение. Их механизмы лежат в основе воспаления, которое способствует локализации инфекционного агента или иного антигена в пределах определённых тканей и формированию полноценной иммунной реакции защитного характера. 25 Гиперчувствительность немедленного типа. Анафилаксия. Механизм ее возникновения. Методы предупреждения. Анафилаксия представляет собой реакцию немедленного типа, возникающую при парентеральном повторном введении антигена в ответ на повреждающее действие комплекса антиген — антитело и характеризующуюся стереотипно протекающей клинической и морфологической картиной. Основную роль в анафилаксии играет цитотропный IgE, имеющий сродство к клеткам, в частности базофилам и тучным клеткам. После первого контакта организма с антигеном образуется IgE, который вследствие цитотропности адсорбируется на поверхности названных выше клеток. При повторном попадании в организм этого же антигена IgE связывает антиген с образованием на мембране клеток комплекса IgE — антиген. Комплекс повреждает клетки, которые в ответ на это выделяют медиаторы — гистамин и гистаминоподобные вещества (серотонин, кинин). Эти медиаторы связываются рецепторами, имеющимися на поверхности функциональных мышечных, секреторных, слизистых и других клеток, вызывая их соответствующие реакции. Это ведет к сокращению гладкой мускулатуры бронхов, кишечника, мочевого пузыря, повышению проницаемости сосудов и другим функциональным и морфологическим изменениям, которые сопровождаются клиническим проявлением. Клинически анафилаксия проявляется в виде одышки, удушья, слабости, беспокойства, судорог, непроизвольного мочеиспускания, дефекации и др. Анафилактическая реакция протекает в три фазы: в 1-й фазе происходит сама реакция антиген — антитело; во 2-й фазе выделяются медиаторы анафилактической реакции; в 3-й фазе проявляются функциональные изменения. Анафилактическая реакция возникает спустя несколько минут или часов после повторного введения антигена. Протекает в виде анафилактического шока или как местные проявления. Интенсивность реакции зависит от дозы антигена, количества образующихся антител, вида животного и может закончиться выздоровлением или смертью. Анафилаксию легко можно вызвать в эксперименте на животных. Оптимальной моделью для воспроизведения анафилаксии является морская свинка. Анафилаксия может возникать на введение любого антигена любым способом (подкожно, через дыхательные пути, пищеварительный тракт) при условии, что антиген вызывает образование иммуноглобулинов. Доза антигена, вызывающая сенсибилизацию, т. е. повышенную чувствительность, называется сенсибилизирующей. Она обычно очень мала, так как большие дозы могут вызвать не сенсибилизацию, а развитие иммунной защиты. Доза антигена, введенная уже сенсибилизированному к нему животному и вызывающая проявление анафилаксии, называется разрешающей. Разрешающая доза должна быть значительно больше, чем сенсибилизирующая. Состояние сенсибилизации после встречи с антигеном сохраняется месяцами, иногда годами; интенсивность сенсибилизации можно искусственно уменьшить введением малых разрешающих доз антигена, которые связывают и выводят из циркуляции в организме часть антител. Этот принцип был использован для десенсибилизации (гипосенсибилизации), т.е. предупреждения анафилактического шока при повторных введениях антигена. Впервые способ десенсибилизации предложил русский ученый А. Безредка (1907), поэтому он называется способом Безредки. Способ состоит в том, что человеку, ранее получавшему какой-либо антигенный препарат (вакцину, сыворотку, антибиотики, препараты крови и др.), при повторном введении (при наличии у него повышенной чувствительности к препарату) вначале вводят небольшую дозу (0,01; 0,1 мл), а затем, через 1—1'/2 ч, — основную. Таким приемом пользуются во всех клиниках для избежания развития анафилактического шока; этот прием является обязательным. Возможен пассивный перенос анафилаксии с антителами. 26 Вакцины. Определение. Типы вакцин. Их получение. Вакцинопрофилактика и вакцинотерапия. Вакцинопрофилактика – введение препаратов с целью предотвращения развития инфекционных заболеваний. Вакцинотерапия – введение препаратов лечебными целями. Вакцинные препараты вводят внутрь, подкожно, внутрикожно, парентерально, интраназально и ингаляционно. Способ введения определяют св-ва препарата. По степени необходимости выделяют плановую вакцинацию и вакцинацию по эпидемиологическим показаниям. Первую проводят в соответствии с регламентированным календарем иммунопрофилактики наиболее распространенных или опасных инфекций. Вакцинацию по эпидемиологическим показаниям проводят для срочного создания иммунитета у лиц, подвергающихся риску развития инфекции, например, у персонала инфекционных больниц, при вспышке инфекционного заболевания в населенном пункте или предполагаемой поездке в эндемичные районы (желтая лихорадка, гепатит А) Живая вакцина: получение, требование к вакцинным штаммам, достоинства и недостатки. Получение: Получают при использовании двух основных принципов: Принцип Дженнера – использование штаммов возбудителей инфекционных заболеваний животных генетически близкородственных сходным болезням человека. На основе этого принципа были получены осповакцина и вакцина БЦЖ. Протективные агенты (иммуногены) этих микробов оказались практически идентичными. Принцип Пастера – получение вакцин из искусственно ослабленных (аттенуированных) вирулентных штаммов возбудителей инфекции человека. Метод основан на селекции штаммов с измененными наследственными признаками. Эти штаммы отличабтся от исходных тем, что они утратили вирулентность, но сохранили иммуногенные св-ва. Так была получена Пастером вакцина против бешенства, позднее вакцина против сибирской язвы, чумы, туляремии. Применяют следующие методы получения аттенуированных штаммов патогенных микробов: Изменение вирулентности возбудителя путем воздействия на него неблагоприятных факторов внешней среды с последующей селекцией Отбор авирулентных штаммов из существующих коллекций микробов. Требования к вакцинным штаммам: селекция спотанных мутантов с пониженной вирулентностью и сохраненными иммуногенными свойствами путем культивирования их в определенных условиях или пассирования через организм устойчивых к донной инфекции животных. Достоинства – полностью сохраненный набор Аг возбудителя, что обеспечивает развитие длительной невосприимчивости даже после однократной иммунизации. Недостатки – риск развития манифестной инфекции в результате снижения аттенуации вакцинного штамма. 39. Убитые вакцины. Принцип получения. Химические вакцины. Убитые вакцины. Производят из типичных по антигенному строению высоковерулентных штаммов возбудителей инфекции. Бактериальные штаммы выращивают на плотных или жидких питательных средах (штаммы вирусов – в организме животных или культурных клетках). нагревание, обработка фармалином, ацетоном, спиртом обеспечивает надежную инактивацию возбудителей и минимальное повреждение Аг. Проводится производственный контроль на стерильность, безвредность, реактогенность, иммуногенность. Вакцины стерильно разливаются в ампулы, затем высушиваются в вакууме при низкой температуре. Высушивание вакцин обеспечивает высокую стабильность препаратов (хранение 2 и более года) и снижает концентрацию некоторых примесей (формалина, фенола). Хранятся вакцины при температуре 4-8 градусов. Иммунизация убитыми вакцинами приводит к созданию активного антимикробного иммунитета. Оценка эффиктивности иммунизации проводится в эпидемиологических опытах путем сравнения частоты заболеваемости у привитых и непривитых людей, а также по уровню защитных Ат, определяемых у привитых. Эффективность данных вакцин в целом ниже, по сравнению с живыми, но при повторном введении они создают достаточно стойкий иммунитет, наиболее частый способ введения – парентеральный. |
