Лекции Лаборант школы (химия). 1 посуда лабораторная
 Скачать 1.87 Mb. Скачать 1.87 Mb.
|
Концентрация растворов. Приготовление растворовКонцентрацией раствора называется количество (масса или объем) растворенного вещества, содержащееся в определенном количестве (мас- се или объеме) раствора или растворителя. Ее выражают различными спо- собами. В химии наиболее часто применяются следующие способы: Процентная концентрация по массе - это отношение массы рас- творенного вещества к массе всего раствора, умноженное на 100. Если раствор состоит из компонентов А и В, то процент компонента А вычис- ляется по формуле: где а и b – массовые количества каждого компонента раствора. Например, 5%-ный раствор гидроксида натрия содержит 5 г гидроксида натрия в 100 г раствора, или, что то же самое, 5 г гидроксида натрия при- ходится на 100 - 5 = 95 г воды. Процентная концентрация – безразмерная величина. Молярнаяконцентрация, или молярность, выражается числом молей растворенного вещества, содержащихся в 1 л раствора. Раствор, в 1 л которого содержится один моль растворенного вещества, называется молярным. Если в 1 л раствора содержится 0,1 моль вещества, то он назы- вается децимолярным, 0,01 моль-сантимолярным, 0,001 моль- миллимолярным. Размерность молярной концентрации – моль/л. Молярность раствора обычно обозначается буквой М. Например, 1 М NaOH – молярный раствор гидроксида натрия, 1 л такого раствора содержит 40 г NaOH; 0,01 М NaOH – сантимолярный раствор, 1 л его со- держит 0,01 моль, т.е. 0,4 г NaOH, и т.д. Чтобы приготовить, например, децимолярный раствор гидроксида натрия, надо взвесить 0,1 моль его, т. е. 4 г внести в литровую мерную колбу, на горлышке которой отмечен объем, точно равный 1 л, добавить воды до полного растворения вещества и затем раствор довести до метки (нижняя часть мениска должна касаться метки) и тщательно перемешать. Моляльная концентрация, или моляльность – это число молей растворенного вещества, содержащихся в 1 кг растворителя. Например, одномоляльный водный раствор серной кислоты состоит из 98 г кислоты и 1 кг воды. Если в 1 кг воды растворено 0,5/моля вещества, то такой рас- твор называется полумоляльным. Размерность моляльной концентрации - моль/кг. Моляльность обычно обозначается буквой m. Нормальная концентрация, или нормальность, выражается чис- лом эквивалентов вещества, содержащихся в 1 л раствора. Раствор, в 1 л которого содержится один эквивалент (экв) растворенного вещества, называется нормальным. Если в 1 л раствора содержится 0,1 экв вещества, то он называется децинормальным, 0,01 экв-сантинормальным, 0,001 экв- миллинормальным. Нормальность обычно обозначается буквой н. (иногда N). Так, например, 1 н. H2SO4 - нормальный раствор серной кислоты, 1 л такого раствора содержит 1 экв, т.е. 49 г H2SO4; 0,01 н. NaOH- сантинормальный раствор гидроксида натрия, 1 л его содержит 0,01 экв, т.е. 40/100 = 0,4 г NaOH, и т.д. Нормальный раствор готовится аналогично молярному. Приготовление неточных растворов. Для растворов, используемых при проведении синтезов и опытов, как правило, не требуется очень высо- кая точность их приготовления. Для приготовления неточного раствора: Взвесить на весах навеску вещества с точностью 0,1 – 0,01 г. Рассчитать массу растворителя, необходимую для приготовле- ния раствора заданной концентрации. Вычислить объем растворителя, ис- ходя из его массы и плотности. Отмерить с помощью мерного цилиндра или мензурки, необ- ходимый для приготовления раствора объем жидкости. Перенести взвешенное вещество в химический стакан (или в плоскодонную колбу). При этом обязательно обмыть стаканчик для взве- шивания жидкостью из цилиндра и перелить в химический стакан остаток жидкости. Растворить навеску вещества в рассчитанном количестве жид- кости при перемешивании стеклянной палочкой. Для ускорения растворения стакан с раствором можно подо- греть через асбестовую сетку или стеклокерамическую пластину. Приготовление растворов точной концентрации. Для приготовле- ния растворов точной концентрации используют только дистиллирован- ную воду. Готовят такие растворы в мерных колбах с кольцевой меткой. Для приготовления раствора точной концентрации: Заполнить мерную колбу (1) примерно наполовину дистилли- рованной водой (рис. 14, а). Взвесить в стаканчике для взвешивания (3) на весах с точно- стью до 0,01 г навеску вещества. Осторожно через химическую воронку (2) перенести навеску вещества в мерную колбу (1). Остатки вещества из стаканчика для взвешивания и с воронки тщательно смыть дистиллированной водой в мерную колбу, используя промывалку (4). Содержимое колбы тщательно перемешать круговыми движе- ниями до полного смешения жидкостей или растворения твердого веще- ства. По достижении раствором комнатной температуры довести объем раствора до кольцевой метки. 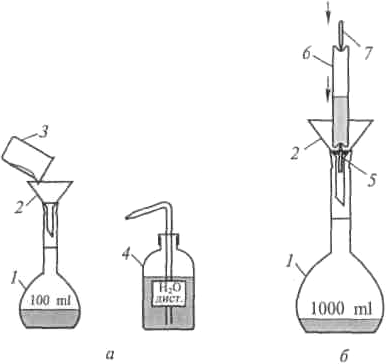 Колбу закрыть пробкой и, многократно переворачивая ее вверх дном, тщательно перемешать раствор. Колбу закрыть пробкой и, многократно переворачивая ее вверх дном, тщательно перемешать раствор.Рис.14. Приготовление растворов: а) – из навески вещества; б) – из фикса- нала; 1 – мерная колба; 2 – воронка; 3 – стаканчик для взвешивания; 4 – промывалка с дистиллированной водой; 5 – нижний боек; 6 – ампула с фиксаналом; 7 – верхний боек Для быстрого приготовления растворов точной концентрации удоб- но применять фиксаналы - заранее приготовленные и запаянные в стек- лянных ампулах точно отмеренные количества реактива, необходимого для приготовления 1 л 1 н. или 0,05 н. раствора. Для вскрытия ампул с фиксаналами прилагаются специальные бойки. Информация об объеме и концентрации получаемого раствора из одной ампулы фиксанала приво- дится на этикетке. Для получения раствора с помощью фиксанала содержимое ампулы количественно перенести в мерную колбу (рис. 14, б). Для этого: В мерную колбу (1) емкостью 1 л налить небольшое количе- ство воды. Вставить в мерную колбу химическую воронку (2) диаметром 9 - 10 см с вложенным в нее бойком (5) с утолщением. Снять этикетку с ампулы с фиксаналом (6). Вымыть и вытереть насухо ампулу с фиксаналом. Сухую и вымытую ампулу со снятой этикеткой повернуть дном вниз и слегка ударить углублением об острие бойка (5). Вторым бойком (7) пробить верхнее отверстие и дать жидко- сти полностью вылиться, твердое вещество при осторожном встряхивании высыпать в воронку. Не изменяя положения ампулы, тщательно промыть ее изнутри дистиллированной водой из промывалки. Для промывания рекомендуется не менее чем шестикратное (по объему ампулы) количество воды. После растворения всего вещества и достижения комнатной температуры довести объем раствора до кольцевой метки. Колбу закрыть пробкой и, переворачивая ее вверх дном, тща- тельно перемешать раствор. Ампулы с сухими фиксаналами можно вскрыть над сухой воронкой и с помощью одного бойка (второй боек в воронку не ставится): вначале вскрыть дно ампулы, затем ампулу перевернуть и пробить верхнее отвер- стие, вещество из ампулы осторожным встряхиванием высыпать в колбу, а ампулу промыть изнутри дистиллированной водой. Разбавлениерастворов.Для разбавления раствора в кратное число раз: Налить на дно мерной колбы с кольцевой меткой небольшое количество дистиллированной воды. Внести в нее разбавляемый раствор известного объема. Довести общий объем раствора до метки и тщательно переме- шать. Для точного измерения объема вносимой жидкости лучше использо- вать пипетку Мора с кольцевой меткой или, в крайнем случае, градуиро- ванную пипетку. |
