Шпора к экзамену 2 курс 2сем.. 1, Система уравнений Максвела в интегральной форме
 Скачать 1.11 Mb. Скачать 1.11 Mb.
|
25, Постулаты БораПервая квантовая теория строения атома быда предложена в 1913 г. датским физиком Нильсом Бором. Она была основана на ядерной модели атома, согласно которой атом состоит из положительно заряженного ядра, вокруг которого вращаются отрицательно заряженные электроны. Теория Бора основана на двух постулатах. I постулат Бора - постулат стационарных состояний. В атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергию. Этим стационарным состояниям соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением энергии. II постулат Бора получил название "правило частот". При переходе электрона с одной стационарной орбиты на другую излучается (или поглощается) квант энергии, равный разности энергий стационарных состояний  где h - постоянная Планка; v - частота излучения (или поглощения) энергии; hv - энергия кванта излучения (или поглощения); En и Em - энергии стационарных состояний атома до и после излучения (поглощения), соотвественно. При Em < En происходит излучение кванта энергии, а при Em > En - поглощение. По теории Бора значение энергии электрона в атоме водорода равно 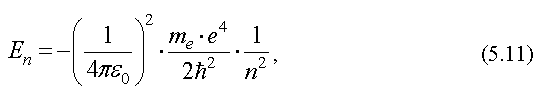 где me - масса электрона, e - заряд электрона, εe - электрическая постоянная , , h - постоянная Планка, n - целое число, n = 1,2,3,... Таким образом, энергия электрона в атоме представляет собой дискретную величину, которая может изменяться только скачком. Набор возможных дискретных частот квантовых переходов определяет линейчатый спектр атома  Вычисленные по этой формуле частоты спектральных линий для водородного атома оказались в прекрасном согласии с экспериментальными данными. Но теория не обясняла спектры других атомов (даже следующего за водородом гелия). Поэтому теория Бора была только переходным этапом на пути построения теории атомных явлений. Она указывала на неприменимость классической физики к внутриатомным явлениям и главенствующее значение квантовых законов в микромире. 26, Принцип Паули Введение В 1925 г. Паули установил квантово - механический принцип (принцип запрета Паули). В любом атоме не может быть двух электронов, находящихся в одинаковых стационарных состояниях, определяемых набором четырех квантовых чисел: n, , m, ms. Например, на энергетическом уровне может находиться не более двух электронов, но с противоположным направлением спинов. Принцип Паули дал возможность теоретически обосновать периодическую систему элементов Менделеева, создать квантовые статистики, современную теорию твердых тел и др. Принцип Паули Состояние каждого электрона в атоме характеризуется четырьмя квантовыми числами: 1. Главное квантовое число n (n = 1, 2 ...). 2. Орбитальное (азимутальное) квантовое число l (l = 0, 1, 2, ... n-1). 3. Магнитное квантовое число m (m = 0, +/-1, +/-2, +/-... +/-l). 4. Спиновое квантовое число ms (ms = +/-1/2 ). Для одного фиксированного значения главного квантового числа n существует 2n2 различных квантовых состояний электрона. Один из законов квантовой механики, называемый принципом Паули, утверждает: В одном и том же атоме не может быть двух электронов, обладающих одинаковым набором квантовых чисел, (т.е. не может быть двух электронов в одинаковом состоянии). Принцип Паули дает объяснение периодической повторяемости свойств атома, т.е. периодической системе элементов Менделеева. Периодическая система элементов Д. И. Менделеева В 1869 г. Менделеев открыл периодический закон изменения химических и физических свойств элементов. Он ввел понятие о порядковом номере элемента и получил полную периодичность в изменении химических свойств элементов. При этом часть клеток периодической системы осталась незаполненной, т.к. соответствующие им элементы были неизвестны к тому времени. В 1998 г. в России синтезирован изотоп 114-го элемента. Менделеев предсказал ряд новых элементов (скандий, германий и др.) и описал их химические свойства. Позднее эти элементы были открыты, что полностью подтвердило справедливость его теории. Даже удалось уточнить значения атомных масс и некоторые свойства элементов. Химические свойства атомов и ряд их физических свойств объясняются поведением внешних (валентных) электронов. Стационарные квантовые состояния электрона в атоме (молекуле) характеризуются набором 4-х квантовых чисел: главного (n), орбитального (l), магнитного (m) и магнитного спинового (ms). Каждое из них характеризует квантование: энергии (n), момента импульса (l), проекции момента импульса на направление внешнего магнитного поля (m) и проекции спина (ms). Согласно теории порядковый номер химического элемента Z равен общему числу электронов в атоме. Если Z - число электронов в атоме, находящихся в состоянии, которое задается набором 4-х квантовых чисел n, l, m, ms, то Z(n, l, m, ms) = 0 или 1. Если Z - число электронов в атоме, находящихся в состояниях, определяемых набором 3-х квантовых чисел n, l, m, то Z(n, l, m)=2. Такие электроны отличаются ориентацией спинов. Если Z - число электронов в атоме, находящихся в состояниях, определяемых 2-мя квантовыми числами n, l,то Z(n, l)=2(2l+1). Если Z - число электронов в атоме, которые находятся в состояниях, определяемых значением главного квантового числа n, то Z(n)=2n2. Электроны в атоме, занимающие совокупность состояний с одинаковыми значениями главного квантового числа n, образуют электронный слой: при n=1 К - слой; при n=2 L - слой; при n=3 М - слой; при n=4 N - слой; при n=5 О - слой и т.д. В каждом электронном слое атома все электроны распределены по оболочкам. Оболочка соответствует определенному значению орбитального квантового числа (табл. 1 и рис. 1).
При заданном l магнитное квантовое число m принимает 2l+1 значений, а ms - два значения. Поэтому число возможных состояний в электронной оболочке с заданным l равно 2(2l+1). Так оболочка l=0 (s - оболочка) заполнена двумя электронами; оболочка l=1 (р - оболочка) - шестью электронами; оболочка l=2 (d - оболочка) - десятью электронами; оболочка l=3 (f - оболочка) - четырнадцатью электронами. Последовательность заполнения электронных слоев и оболочек в периодической системе элементов Менделеева объясняется квантовой механикой и основывается на 4-х положениях: 1. Общее число электронов в атоме данного химического элемента равно порядковому номеру Z. 2. Состояние электрона в атоме определяется набором 4-х квантовых чисел: n, l, m, ms. 3. Распределение электронов в атоме по энергетическим состояниям должно удовлетворять минимуму энергии. 4. Заполнение электронами энергетических состояний в атоме должно происходить в соответствии с принципом Паули. При рассмотрении атомов с большим Z, из-за возрастания заряда ядра, электронный слой стягивается к ядру и начинает заполняться слой с n=2 и т.д. При заданном n сначала заполняется состояние s-электронов (l=0), затем р-электронов (l=1), d-электронов (l=2) и т.д. Это приводит к периодичности химических и физических свойств элементов. Для элементов первого периода сначала происходит заполнение оболочки 1s; для электронов второго и третьего периодов - оболочек 2s, 2p и 3s и 3р. Однако, начиная с четвертого периода (элемент калий, Z=19), последовательность заполнения оболочек нарушается вследствие конкуренции близких по энергии связи электронов. Прочнее могут оказаться (энергетически выгоднее) связанными электроны с большим n, но меньшим l (например, электроны 4s прочнее связаны, чем 3d). Распределение электронов в атоме по оболочкам определяют его электронную конфигурацию. Для указания электронной конфигурации атома пишут в ряд символы заполнения электронных состояний оболочек nl, начиная с самой близкой к ядру. Индексом справа вверху отмечают числа электронов в оболочке, находящихся в этих состояниях. Например, у атома натрия 2311Na, где Z=11 - порядковый номер элемента в таблице Менделеева; число электронов в атоме; число протонов в ядре; A=23 - массовое число (число протонов и нейтронов в ядре). Электронная конфигурация имеет вид: 1s2 2s2 2p6 3s1, т.е. в слое с n=1 и l=0 - два s-электрона; в слое с n=2 и l=0 - два s-электрона; в слое с n=2 и l=1 - шесть р-электронов; в слое с n=3 и l=0 - один s-электрон. Наряду с нормальной электронной конфигурацией атома, соответствующей наиболее прочной энергии связи всех электронов, при возбуждении одного или нескольких электронов возникают возбужденные электронные конфигурации. Например, у гелия все уровни энергии разбиваются на две системы уровней: система уровней ортогелия, соответствующая параллельной ориентации спинов электронов и система уровней парагелия, соответствующая антипараллельной ориентации спинов. Нормальная конфигурация гелия 1s2 вследствие принципа Паули возможна только при антипараллельной ориентации спинов электронов, соответствующей парагелию. Заклю Итак, принцип запрета Паули объясняет, долго считавшуюся загадочной, периодическую структуру элементов, открытую Д.И.Менделеевым.чение |
