1. скорость химической реакции
 Скачать 1.62 Mb. Скачать 1.62 Mb.
|
|
1. СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ Скорость является важнейшей количественной характеристикой химической реакции. Изучение закономерностей изменения скорости, ее зависимости от таких факторов, как концентрация вещества, температура, давление, присутствие катализаторов, природа растворителя является важнейшей задачей химической кинетики. Эти знания фактически определяют возможность организации эффективного промышленного производства того или иного химического продукта (обоснование выбора аппаратуры, предполагаемые объёмы расхода сырья, расчётная производительность и т.п.). 1.1. Кинетическая классификация реакций В химической кинетике реакции подразделяют по следующим признакам: 1. Число молекул, участвующих в реакции (молекулярность и порядок реакции). Молекулярность реакции определяется числом молекул, принимающих участие в элементарном акте химического превращения. Различают моно-, би- и тримолекулярные реакции. Мономолекулярными называются реакции, в которых только одна молекула претерпевает превращение в элементарном химическом акте (изомеризация или распад на несколько более мелких молекул), например, А В или А С + В. Стехиометрический коэффициент перед исходным веществом в этом случае всегда равен единице. Бимолекулярные – реакции, элементарный акт в которых осуществляется при столкновении двух одинаковых молекул (стехиометрический коэффициент в этом случае равен двум) или двух молекул разных веществ (коэффициенты перед реагентами равны единице), например, 2А С или А + В С. В тримолекулярных реакциях участвуют три молекулы одного или разных веществ, например, 3А С, или А + В + С Д, или А + 2В С. Ясно, что необходимым условием химического взаимодействия молекул является их столкновение друг с другом. Поскольку при любом давлении тройных столкновений значительно меньше, чем двойных, тримолекулярные реакции весьма редки. Реакции большей молекулярности практически не встречаются. Порядок реакции будет рассмотрен ниже – при изучении зависимости скорости реакции от концентраций реагирующих веществ. 2. Природа частиц, участвующих в элементарном акте реакции. Реакции, в которых участвуют молекулы, называются молекулярными. Реакции с участием атомов или свободных радикалов называются цепными, с участием ионов – ионными. 3. Число фаз реакционной системы. Фазой называется часть системы, отделенная от других ее частей хотя бы одной поверхностью раздела. Фаза может быть механически отделена от других фаз системы. Под системой мы понимаем обособленную часть пространства, или часть пространства, мысленно выделенную из окружающей среды, содержащую определенную совокупность веществ, находящихся во взаимодействии. Например: водный раствор различных солей, смесь газов, атом водорода (система из ядра и электрона) и т.п. Системы, состоящие только из одной фазы, называются гомогенными, а системы, содержащие две или большее число фаз – гетерогенными. Различают жидкие, твердые и газовые фазы. На границе между двумя фазами всегда существует некоторая поверхность раздела, при переходе через которую многие свойства вещества скачкообразно изменяются. Жидкая вода, например, представляет собой одну фазу, а система жидкая вода – лед состоит из двух фаз, которые, хотя и обладают одинаковым составом, различаются по своим свойствам (по внутреннему строению, плотности и др.). Газы при не очень высоких давлениях смешиваются между собой в любых относительных количествах, поэтому в таких условиях между ними не может быть поверхности раздела, и они всегда образуют одну фазу. Жидкости в случае ограниченной растворимости могут образовать две или большее число фаз. Например, вода, керосин и ртуть образуют три фазы. Реакции, протекающие в одной фазе, называются гомогенными. Реакции, протекающие в многофазных системах на границе раздела фаз, называются гетерогенными. По механизму химического взаимодействия и по многим закономерностям кинетики гомогенные и гетерогенные реакции существенно различаются. 4. По признаку обратимости: обратимые и необратимые. Теоретически все химические процессы являются обратимыми, т.е. могут протекать как в прямом, так и обратном направлениях. Но если скорость прямой реакции несоизмеримо больше скорости обратной реакции, то процесс можно считать практически необратимым, т.е. протекающим только в одном направлении. Схема обратимой реакции: 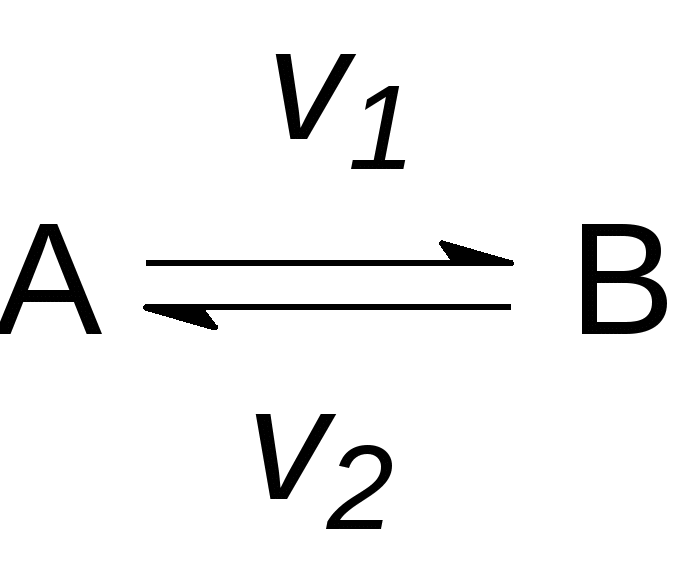 Здесь стрелки показывают направление реакций, а v1и v2– их скорости. Если v1 v2, то реакция называется необратимой и схематически изображается: При непрерывном отводе продуктов реакции из реакционной зоны все реакции являются практически необратимыми. В случае обратимых реакций наблюдаемая скорость определяется разностью скоростей прямой и обратной реакций: vнабл = v1 v2 5. По числу стадий: элементарные (одностадийные) и сложные (многостадийные, последовательные или консекутивные). При элементарной реакции в системе протекает только один процесс, и уравнение реакции раскрывает её механизм. Подавляющее большинство реакций (в том числе почти все изучаемые в курсе общей и неорганической химии) являются сложными и представляют собой суммарный результат нескольких последовательных элементарных стадий. Обычная запись этих реакций, как правило, не отражает их реальный механизм. Например, реакция выражается суммарным уравнением А С, а схема процесса, учитывающая промежуточные стадии, где В и Д – промежуточные продукты (интермедиаты) в процессе получения конечного вещества С. Первое прямое экспериментальное свидетельство образования промежуточного вещества было получено еще в 19 веке (А. Вильямсон, 1851г.). При изучении реакции дегидратации этанола в растворе серной кислоты было уста- 2C2H5OH (C2H5)2O + H2O новлено, что сначала образуется этиловый эфир серной кислоты C2H5OSO2OH. Достаточная стабильность позволила выделить это соединение из реакционной смеси, установить его химическую природу и показать, что к образованию (C2H5)2O приводит последующая реакция C2H5OSO2OH с C2H5OH. Заведомо последовательно протекают все реакции, стехиометрическое уравнение которых включает четыре и более частиц реагентов, например: C6H6 + 3H2 C6H12 CH4 + 4Cl2 CCl4 + 4HCl 3H2O2 + 2KMnO4 2KOH + 2MnO2 + 3O2 + 2H2O Посмотрев на эти уравнения, можно уверенно предсказать по крайней мере часть интермедиатов: продукты неполного гидрирования бензола C6H8, C6H10; неполного хлорирования метана CH3Cl, CH2Cl2, CHCl3; промежуточные формы восстановления марганца (+7) до марганца (+4). Последовательными являются в большинстве своем и реакции, стехиометрия которых достаточно проста, например: 2NO + O2 2NO2 2O3 3O2 2Na + HgCl2 Hg + 2NaCl Промежуточными веществами в этих реакций являются cоответственно димер оксида азота N2O2 (І), атомарный кислород, монохлорид ртути. Идентификация интермедиатов в этих реакциях, определение последовательных стадий и определение констант скоростей результат детальных кинетических исследований с использованием физических методов. Долгие годы классическим примером одностадийной реакции считалось взаимодействие цезия с хлоридом рубидия в газовой фазе: Cs(г) + RbCl(г) CsCl(г) + Rb(г), однако впоследствии было обнаружено, что первичным результатом столкновения Cs с RbCl является образование промежуточного комплекса Cs…RbCl. Время жизни C2H5OSO2OH относительно стабильного промежуточного вещества измеряется многими годами, а время жизни комплекса Cs…RbCl всего 1010 с, но принципиального отличия нет и эта реакция относится к последовательным. В простейшем случае признаками последовательного характера протекания реакции служат: различие скоростей расходования реагентов и образования продуктов и так называемый S - образный характер кинетической кривой накопления продуктов (рис.1): 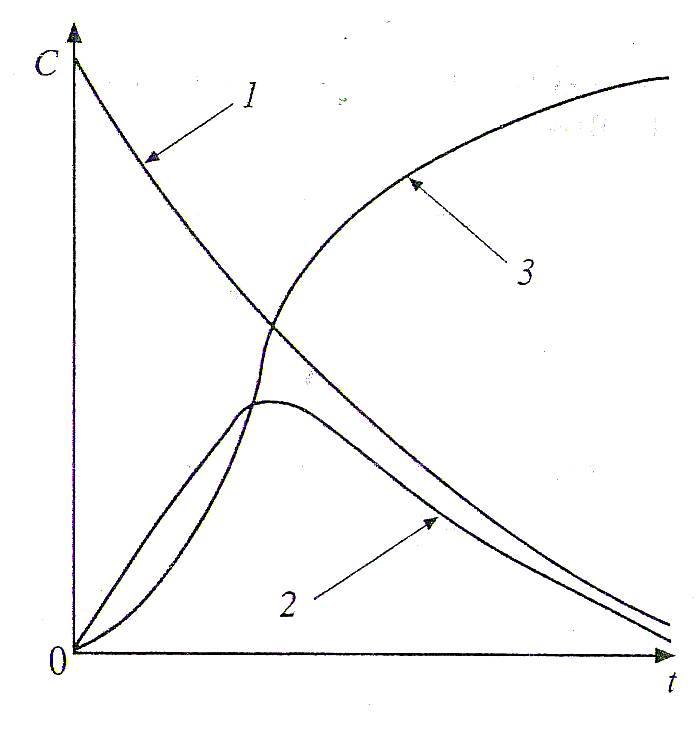 Рис.1. Изменение концентрации реагента (1), промежуточного Рис.1. Изменение концентрации реагента (1), промежуточного вещества (2) и продукта (3) по мере протекания реакции Кинетический расчет последовательных реакций сложен. Если одна из промежуточных стадий обладает меньшей скоростью, чем другие, то общая скорость реакции определяется именно этой наиболее медленной стадией. Она называется лимитирующей или скоростьопределяющей. Установление лимитирующей стадии важно при поиске путей управления скоростью превращения. Очевидно, что ускорение и замедление суммарной реакции возможно лишь при воздействии на лимитирующую стадию. Стадиями реакций могут быть не только химические процессы, но и, например, переход вещества из объёма фазы к её границе, на которой протекает реакция, или перенос продуктов взаимодействия от этой поверхности в объём. Скорость подобных процессов определяется скоростью диффузии. Кроме отмеченных выше, в кинетической классификации выделяют также изолированные и параллельные, а также сопряжённые реакции. Изолированные реакции – реакции, в ходе которых образуется продукт только одного типа, что схематично можно отобразить: А В Параллельные реакции – такие, в которых взятые вещества одновременно реагируют в двух или более направлениях (в результате образуются разные продукты). Например, реакция разложения бертолетовой соли при медленном нагревании: | 2KCl + 3O2 (v1) 6KClO3 | | 3KClO4 + KCl (v2) Наблюдаемая скорость реакции (скорость расходования исходных веществ) в этом случае равна сумме скоростей параллельных реакций: vнабл = v1 + v2 Сопряженные реакции – это совместные реакции вида А +В М (I) А + С N (II) из которых одна (например, реакция II) протекает лишь совместно с другой, т.е. идет при условии, если взяты вещества А, В и С. Здесь реакция II индуцируется (т.е. возбуждается) реакцией I. Вещество В называется индуктором реакции II, вещество А, общее для обеих реакций – актором, и вещество С – акцептором. Примером такой реакции может служить окисление FeSO4 (вещество В) и HJ (вещество С) перекисью водорода (H2O2, вещество А). FeSO4 окисляется независимо от присутствия HJ, но HJ не окисляется перекисью водорода без FeSO4. Процесс FeSO4 + H2O2 идет независимо. Процесс HJ + H2O2 идет лишь в присутствии FeSO4. Такое явление передачи реакционной способности от одной реакции к другой называется химической индукцией. 1.2. Понятие о скорости химической реакции Любая реакция представляет собой результат совокупности элементарных актов, т.е. одновременных взаимодействий между несколькими частицами, при которых получаются продукты реакций. Продукты могут получаться за один или несколько последовательных элементарных актов (стадий). Скоростью химической реакции называется число элементарных актов реакции, происходящих в единицу времени в единице объема (в случае гомогенных реакций) или на единице поверхности раздела фаз (в случае гетерогенных реакций). Все способы выражения скорости реакции сводятся к изменению коли-чества вещества во времени. Для гетерогенных реакций скорость определяется выражением v = Δn/(S Δτ), где Δn изменение количества вещества, S площадь поверхности раздела фаз, Δτ промежуток времени; для гомогенных v = Δn/(V Δτ), здесь V объем реакционной системы. В последнем уравнении отношение изменения количества вещества к объему представляет собой изменение его концентрации, поэтому скорость гомогенной реакции обычно характеризуют изменением концентрации (моль/л) какого-либо из реагирующих веществ или продуктов реакции за единицу времени ( обычно в минутах или секундах). Пусть в некоторой реакции А + В = АВ нас интересует изменение концентрации вещества А во времени. В начальный момент времени, когда эта концентрация максимальна, скорость вовлечения этого вещества в реакцию будет наибольшей. С течением времени в единице объема системы число молекул вещества А будет становиться все меньше и меньше. В связи с этим будет уменьшаться и число соударений молекул А и В в единицу времени. Скорость реакции в результате этого будет постепенно понижаться. В общем, концентрация вещества А в реакционной смеси будет падать по некоторой кривой КL (рис.2), а концентрация продукта реакции (АВ) будет возрастать по некоторой кривой MN (рис.3). На рис.2 и 3 на осях ординат отложены концентрации веществ А и АВ, а на осях абсцисс – время (τ) протекания реакции. 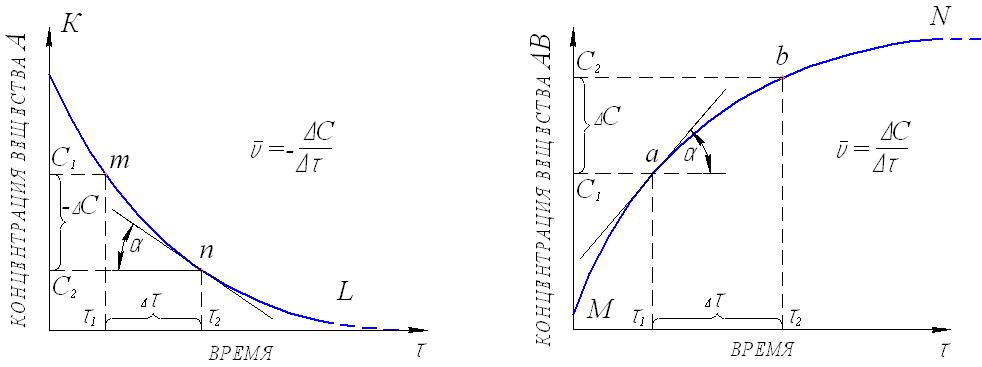 Рис.2. Изменение концентрации одного Рис.3. Изменение концентрации из исходных веществ во времени продукта реакции во времени. Из рисунка видно, что некоторым моментам времени τ1 и τ2 соответствуют концентрации веществ А и АВ, соответственно равные С1 и С2 (точки f иg на рис.2 и точки а и в на рис.3). Если за промежуток времени Δτ = τ2 – τ1 концентрация одного из веществ, участвующих в реакции, уменьшится на С2 – С1, то средняя скорость его расходования за указанный промежуток времени составит: Скорость реакции всегда является величиной положительной. Поэтому, для того, чтобы скорость имела положительное значение, при измерении убы- вающей концентрации вещества в правой части уравнения (1.1) ставится знак минуса. Концентрация продукта реакции с течением времени будет возрастать (рис. 3). Тогда в правой части уравнения скорости знак минуса не ставят: Величина Следовательно, истинная (мгновенная) скорость равна: Если замеряется изменение концентрации одного из исходных веществ, то При практическом определении скорости химической реакции обычно измеряют ряд концентраций одного из реагирующих веществ в следующие друг за другом моменты времени. Очевидно, что значение скорости реакции может быть получено по изменению концентрации любого компонента реакции, т.к. само стехиометрическое уравнение реакции показывает, что между концентрациями реагирующих веществ имеется простое соотношение. Так, для реакции аА + вВ → сС + dD скорость можно вычислить Например, при изучении скорости образования воды из водорода и кислорода можно измерять или изменение концентрации водорода, или кислорода, или воды; при этом изменение концентрации водорода будет в два раза больше изменения концентрации кислорода, а изменение концентрации воды будет равно изменению концентрации водорода: 2H2 + O2 = 2H2O Методы, с помощью которых определяют концентрации веществ, очень разнообразны и зависят от природы рассматриваемой реакции. За ее ходом можно следить, например, фиксируя изменение давления во времени, в других случаях можно регистрировать изменение во времени показателя преломления, вязкости, объема, плотности, интенсивности окраски, изменение температуры кипения или замерзания, электрической проводимости или вращения плоскости поляризации света (если продукты оптически активны). Если соединения, образующиеся в ходе реакции, поглощают определенные излучения, то пользуются методами спектроскопии (в инфракрасной, видимой и ультрафиолетовой областях). Интенсивность поглощения зависит от концентрации соединений. Если реакция протекает медленно, то можно воспользоваться методом отбора проб через определенные промежутки времени, измеряя процентный состав методами классического химического анализа или физико-химическими методами. Если реакция идет с большой скоростью, то для отбора пробы ее останавливают резким охлаждением, резким уменьшением концентрации, быстрым удалением катализатора или совместным действием указанных факторов. 1.3. Факторы, влияющие на скорость реакции Скорость реакции зависит от многих факторов. На неё влияют: природа и концентрация реагентов, температура, давление (в случае реакций с участием газов), катализаторы, степень измельчения веществ (в реакциях с участием твёрдых веществ), среда (если реакции протекают в растворах), форма реакционного сосуда (в цепных реакциях), интенсивность света (в фотохимических реакциях), мощность излучения (в радиационно-химических процессах). Основными параметрами, которые следует учитывать при изучении кинетики конкретного процесса, являются температура, давление, концентрация вещества. 1.3.1. Зависимость скорости реакции от природы реагирующих веществ Очевидно, что необходимым условием протекания реакции является столкновение молекул. Число соударений молекул очень велико (порядка 1028 в секунду в 1 см3 при обычных условиях), поэтому если бы все столкновения приводили к химическому взаимодействию, то все реакции проходили бы со скоростью взрыва. Большая же часть реакций имеет наблюдаемую скорость. Причина в том, что к реакции могут приводить не все, а только так называемые эффективные столкновения, число которых составляет лишь малую долю от их общего числа. Столкновение может быть эффективным, если оно происходит между молекулами, обладающими некоторым избытком энергии по сравнению со средней энергией молекул системы (Еср) при данной температуре (рис.4). Молекулы, обладающие такой избыточной энергией, называются активными, а сам избыток энергии энергией активации (Еа). Понятно, что, чем больше доля активных молекул, тем выше скорость реакции. Энергия активации является тем фактором, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции.Очевидно поэтому, что она различна для разных реакций. Если энергия активации очень мала (меньше 40 кДж/моль), то это означает, что значительная часть столкновений частиц реагирующих веществ приводит к химическим превращениям. Скорости таких реакций велики, они могут протекать практически мгновенно (например, ионные реакции в растворах). Если энергия активации очень велика (больше 120 кДж/моль), то это означает, что лишь малая часть столкновений взаимодействующих частиц приво- 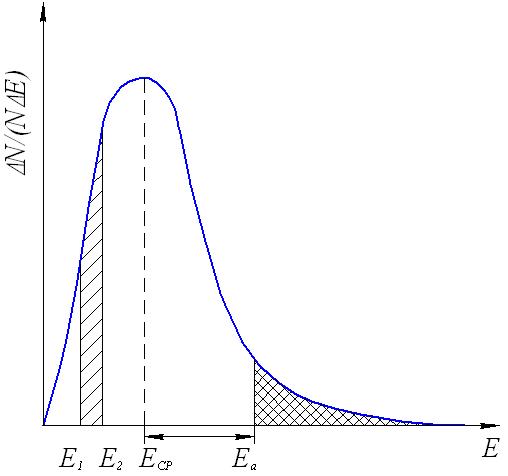 Рис.4. Распределение молекул по кинетической энергии: Еср-средняя энергия молекул; Еа-энергия активации реакции; N/(NЕ)- доля молекул с определенной энергией. дит к химическим превращениям. Такие реакции идут очень медленно (например, процессы коррозии). Если же значение энергии активации находится в пределах 40-120 кДж/моль, то такая реакция будет протекать не очень быстро и не очень медленно, в удобном для наблюдения и управления режиме; её скорость можно из- мерить (например, взаимодействие цинка с водным раствором сульфата меди, тиосульфата натрия с серной кислотой и множество других). Для того, чтобы произошла реакция, необходимо сначала преодолеть отталкивание электронных оболочек молекул, ослабить связи между атомами исходных веществ. На это надо затратить определенную энергию. При этом вещества переходят в неустойчивое промежуточное состояние. Это состояние называется активированным комплексом или переходным состоянием. Именно для его образования и необходима энергия активации (рис.5). Измерение энергии активации показывает, что она всегда меньше энергии связей, т.е. для создания возможности протекания реакции нет необходимости полностью разрывать связи атомов в молекулах, их нужно только несколько ослабить. Это более энергетически выгодный процесс, поэтому образование активированного комплекса характерно для подавляющего большинства реакций. Неустойчивый активированный комплекс существует очень короткое время. Он может распасться с образованием либо исходных веществ, либо продуктов реакции; при этом энергия выделяется. Очевидно, что переходное состояние возникает как в ходе прямой, так и в ходе обратной реакции. Приведем энергетическую диаграмму условной реакции: АВ + СД АС + ВД 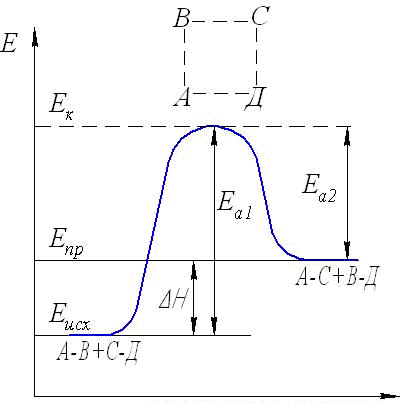 Координата (ход) реакции Рис.5. Изменение потенциальной энергии в ходе реакции. На рисунке 5 уровень EK отвечает энергии системы в состоянии активированного комплекса и определяет тот наименьший энергетический запас, которым должны обладать молекулы, чтобы их столкновения могли приводить к химическому взаимодействию. Разность между уровнем энергии активированного комплекса EK и средним уровнем энергий исходных веществ Eисх. представляет собой энергию активации прямой реакции Еа1, а разность между уровнем ЕК и средним уровнем энергий продуктов реакции Епр – энергию активации обратной реакции Еа2. Разность уровней энергии продуктов реакции и исходных веществ равна изменению энтальпии прямой реакции. Общий запас энергии продуктов реакции в приведенном примере больше, чем исходных веществ, поэтому ΔНпрям = Епр–Еисх > 0, т.е., прямая реакция эндотермическая, идёт с поглощением тепла. Обратная реакция, соответственно, экзотермическая, тепло в результате её протекания выделяется. Избыточная энергия в молекуле может проявляться в разных формах: 1) повышенная кинетическая энергия поступательного и вращательного движения; 2) повышенная энергия взаимного колебания атомов или атомных групп, составляющих молекулу; 3) повышенная энергия движения электронов. Неактивные молекулы можно перевести в активное состояние. Для этого неактивной молекуле необходимо сообщить достаточную дополнительную энергию в той или иной форме с тем, чтобы она стала реакционноспособной. Это – процесс активации. Важнейшие пути активации: 1) увеличение кинетической энергии молекулы (например, путем повышения температуры системы); 2) повышение внутримолекулярной энергии, в частности, возбуждение молекулы в результате поглощения квантов света, лучистой энергии соответствующей длины волны; 3) образование свободных атомов или радикалов в результате диссоциации при высоких температурах или ультрафиолетовом облучении. Эти частицы обладают очень высокой реакционной способностью (см. п.1.5 Цепные реакции); 4) образование ионов (при диссоциации, в результате воздействия радиации и т.д.). Ионное состояние можно рассматривать как состояние активированное. Именно этим объясняется обычно высокая скорость ионных реакций; 5) активация при адсорбции, которая заключается в ослаблении внутримолекулярных сил реагирующих веществ. Активация при адсорбции играет большую роль в гетерогенном катализе (см. п.1.4.2). Причиной, определяющей влияние природы реагирующих веществ на скорость их химического взаимодействия является характер внутримолекулярных и межмолекулярных связей. Скорости реакций между неполярными молекулами, как правило, невысоки. Это является результатом прочности внутримолекулярных связей и относительной слабости межмолекулярных сил. С другой стороны, полярные вещества, находясь в водных растворах и в среде других полярных растворителей в виде ионов, очень быстро взаимодействуют между собой. При значительных силах взаимодействия между молекулами реагирующих веществ скорость реакции возрастает. Полярность молекул является важным фактором именно в этом отношении. В кинетике химических реакций важнейшую роль играет их внутренний механизм. Именно знание механизма реакции позволяет управлять процессом, проводить его в оптимальном режиме. В процессе реакции нарушаются внутренние связи между атомами в молекулах исходных веществ и образуются новые межатомные связи в молекулах продуктов реакции. Способ этой перестройки у различных реакций не одинаков. Проявляющиеся здесь особенности оказывают большое влияние на скорость химического процесса. Различают два следующих типичных случая перестройки химических связей: а) перестройка химических связей в молекулах исходных веществ идет без разрыва связывающих электронных пар; новая связь в молекулах продуктов реакции обеспечивается за счет электронов, которые были уже спаренными в молекулах исходных веществ. Этот случай характерен для сильно полярных веществ, ковалентная связь в которых близка по характеру к ионной. В водных растворах такие соединения реагируют между собой быстро, подобно ионным веществам; б) во многих случаях при химической перестройке молекул исходных веществ А и В происходит разрыв электронных пар связи, и новая электронная пара в молекулах продуктов реакции образуется за счет неспаренного электрона одного из атомов молекулы вещества А и неспаренного электрона одного из атомов молекулы вещества В. Такой тип перестройки часто встречается при химическом взаимодействии органических соединений. Реакция этого типа, в целом, протекает медленнее. 1.3.2. Зависимость скорости реакции от концентраций реагирующих веществ Концентрации реагирующих веществ является одним из важнейших факторов, влияющих на скорость химических реакций. Чем выше концентрация, т.е. чем больше частиц вещества находится в единице объема, тем больше вероятность соударений молекул реагирующих веществ и, следовательно, тем выше скорость реакции. На основании обширного экспериментального материала норвежские ученые Гульдберг и Вааге в 1867г. сформулировали важное для химической кинетики положение, известное под названием закона действующих масс или основного постулата химической кинетики. Для одностадийных реакций и любой отдельной стадии многостадийных процессов этот закон формулируется следующим образом: Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их стехиометрическим коэффициентам. Для реакции аА + Вв +…+ сС закон действующих масс выражается соотношением где СА и СВ – концентрации веществ А и В; а и в – стехиометрические коэффициенты в уравнении реакции; k – коэффициент пропорциональности, называемой константой скорости химической реакции. При СА = СВ = 1 В случае гетерогенных реакций в уравнения скорости входят только концентрации веществ, находящихся в газовой фазе или в растворе величины переменные. Концентрация твердого вещества величина постоянная и поэтому входит в константу скорости. Сравним: а) 2NO(г) + O2(г) = 2NO2(г) гомогенная реакция v = k[NО]2[О2], б) С(тв) + O2(г) 2СО2(г) гетерогенная реакция v = k[О2]. Порядок химической реакции по данному веществу (или частный порядок реакции) – это число, равное степени (например, в вышеприведенной реакции а и в), в которой концентрация этого вещества входит в кинетическое уравнение реакции, т.е. в выражение скорости реакции по закону действующих масс. Сумма показателей степеней (а + в +…), в которых концентрации всех исходных веществ входят в кинетическое уравнение закона действующих масс, определяет общий порядок реакции. Для одностадийных реакций численные значения их порядка и молекулярности совпадают. Несовпадение экспериментально определенного порядка реакции с молекулярностью свидетельствует о её более сложном характере. Почти все реакции представляют собой сложные многостадийные процессы, т.е. осуществляются в результате одновременного (или последовательного) протекания нескольких простых реакций; при этом продукты промежуточных стадий обычно быстро расходуются, и поэтому присутствуют в небольших количествах. Для вычисления истинной скорости химического процесса необходимо знать численное значение константы скорости реакции, порядок реакции и экспериментально определить значения концентраций реагирующих веществ в тот момент времени, для которого вычисляется скорость. Найдем количественные соотношения между скоростью реакции и концентрациями реагентов (или так называемое кинетическое уравнение) для простейших случаев – для необратимых реакций первого и второго порядков. Реакции первого порядка. В реакциях первого порядка скорость пропорциональна концентрации одного реагирующего вещества. Примерами реакций первого порядка могут служить, например, разложение оксида азота (+5) уже при комнатной температуре: N2O5 NO2 + NO + O2, изомеризация бутана при температуре 1000С в присутствии хлорида алюминия: CH3CH2CH2CH2CH3 CH3CH(CH3)CH3, крекинг бутана при температуре примерно 6000С: CH3CH2CH2CH3 CH3CH3 + CH2=CH2 и др. В общем виде уравнение реакции первого порядка можно записать: А продукты (1.6) Выражение скорости, как функции концентрации, имеет вид: Пусть концентрация исходного вещества в начальный момент реакции, т.е. при τ = 0, равно «а» моль/л; в какой-то момент времени (τ) x моль/л вещества А превращаются в продукты. Следовательно, остается (а–x) моль/л вещества А (при условии, что объем реакционной системы остается постоянным). Таблица 1 Изменение концентрации веществ во времени для реакции первого порядка
|
