1. скорость химической реакции
 Скачать 1.62 Mb. Скачать 1.62 Mb.
|
|
1.4.3. Ферментативный катализ Этот вид катализа имеет место в биологических системах (биокатализ). Активными, ускоряющими протекание многих биохимических процессов, частицами являются вещества, имеющие органическую, белковую природу – ферменты (энзимы). Некоторые из них состоят из одного компонента (например, пепсин, трипсин и др.); большинство имеет более сложный состав и строение. Можно считать, что фермент представляет собой адсорбционный комплекс, состоящий из ионоорганического соединения, связанного с белковым носителем. В качестве каталитически активных центров обычно служат ионы металлов (обычно d-элементов – Fe2+, Cu2+, Zn2+, V3+ и др.) или полярные группировки (OH–, NH2–, HS– и др.). Основные особенности ферментов: 1) исключительно высокая каталитическая активность. Лучшие неорганические катализаторы по своей активности уступают ферментам в десятки тысяч и более раз. Например, активность ионов железа, входящего в состав ферментов, катализирующих окислительно-восстановительные процессы, протекающие в организмах человека и животных, выше таковой у ионов железа в неорганической форме примерно в триста тысяч раз. В составе ферментов в организме человека содержится 3 4 грамма железа, а неорганического железа для выполнения такого же «объёма работы» понадобилось бы около 10 тонн. 2) очень высокая избирательность. Данный фермент, сильно ускоряя протекание одного процесса, оказывается совершенно неактивным для другого. В организме человека одновременно функционируют порядка тысячи ферментов. 3) инактивация. В ходе реакции, активируемой данным ферментом, его каталитическая способность теряется. При этом установлена следующая закономерность: чем активнее фермент как катализатор, тем быстрее он инактивируется в процессе реакции. Этим ферментативный катализ существенно отличается от неорганического, в котором, как уже отмечалось, катализатор к концу реакции остаётся в неизменном виде и теряет активность только в течение более или менее длительного времени. 1.5. Цепные реакции Как уже было отмечено выше, подавляющее большинство химических реакций протекает последовательно, постадийно, и образование макроскопических количеств продукта является результатом ряда элементарных актов реакции, каждый из которых связан с определенным результатом предыдущего акта и, в свою очередь, обусловливает возможность последующего. В зависимости от природы реагирующих веществ и условий их взаимодействия в элементарных актах реакций могут принимать участие атомы, молекулы, ионы или радикалы. Свободными радикалами называют частицы с неспаренными электронами (R), проявляющие, вследствие этого, очень высокую химическую активность. К свободным радикалам относятся и свободные атомы. При взаимодействии свободных радикалов с молекулами исходных веществ образуются молекулы продукта реакции и новые свободные радикалы, способные к следующему акту взаимодействия, и так далее. Таким образом, свободные радикалы вызывают цепи последовательных превращений веществ. По цепному механизму протекают многие реакции. Их особенность состоит в том, что один первичный акт активации, вызывающий появление в системе первых свободных радикалов, приводит к превращению огромного числа молекул исходных веществ. Различают два типа цепных реакций – с неразветвлёнными и с разветвлёнными цепями. Примером реакции первого типа может служить фотохимический синтез хлористого водорода: H2+Cl2 = 2HCl Поглощение кванта лучистой энергии (реакция инициируется действием света) hν приводит к возбуждению молекул, появлению в них энергичных колебаний атомов. Если энергия колебаний превышает энергию связи между атомами, то молекула распадается: Диссоциации подвергаются именно молекулы хлора, а не водорода, так как энергия связи Cl―Cl равна 243 кДж/моль, а энергия связи Н―Н составляет 436 кДж/моль. Данная стадия цепной реакции, в которой впервые образуются свободные радикалы, называется зарождением цепи. Следующая стадия – развитие или продолжение цепи. Она представляет собой чередующиеся процессы: Каждый отдельный акт взаимодействия в этой последовательности называется звеном цепи. В рассматриваемом примере число звеньев может достигать 100000. Иначе говоря, один поглощённый квант света приводит к образованию до ста тысяч молекул HCl. Число звеньев цепи, приходящихся в среднем на каждый свободный радикал, получившийся при зарождении цепей, называется длиной цепи. Появление в системе свободных радикалов может быть вызвано также электронным ударом, электрическим разрядом, нагреванием, α, β и γ – излучением. Стадии цепного процесса, приводящие к исчезновению радикалов, называются обрывом цепи. Обрыв цепи может произойти при столкновении двух свободных радикалов – рекомбинация радикалов при участии одной неактивной частицы (М), которая поглотит выделяющуюся при этом энергию и перейдет в возбужденное состояние: Если сталкиваются одинаковые радикалы, то обрыв цепи называют квадратичным, если разные перекрестным: В обоих случаях скорость обрыва цепей пропорциональна произведению концентраций радикалов. Цепь может оборваться также в результате столкновения свободного радикала со стенкой сосуда; в результате радикалы адсорбируются поверхностью: Скорость обрыва цепей в этом случае прямо пропорциональна концентрации радикалов, а также сильно зависит от формы, материала и состояния поверхности сосуда. Причиной обрыва цепи может быть и взаимодействие радикала с примесями (если они не служат источником свободных радикалов), а также образование малоактивного радикала (обрыв в объёме). Скорость цепной реакции очень чувствительна к наличию посторонних частиц. Так, содержание в смеси хлора с водородом долей процента кислорода в сотни раз уменьшает длину цепей, а поэтому и скорость реакции. Атом водорода, легко реагируя с молекулой кислорода, образует малоактивный радикал В любом случае, чем выше скорость обрыва цепей, тем меньше их длина и тем ниже скорость реакции, которая в случае неразветвлённого процесса равна произведению скорости зарождения цепей на длину цепи. Энергии активации отдельных стадий цепных реакций обычно в десятки раз меньше, чем энергии активации межмолекулярных реакций, что обусловливает протекание цепных реакций с большой скоростью. Примерами процессов с неразветвлёнными цепями служат также реакции галогенирования углеводородов, полимеризации, многие реакции органических соединений, например, уксусного альдегида. Реакции с разветвлёнными цепями отличаются тем, что в них единичная реакция одного свободного радикала приводит к образованию более чем одного нового свободного радикала. Один из них продолжает цепь, а другой (другие) – начинает (начинают) новую (новые). Примером реакций этого типа служит окисление водорода, которое при определенных условиях протекает следующим образом: Образующиеся в двух первых реакциях радикалы обеспечивают развитие неразветвлённой цепи, а атом кислорода, обладающий двумя неспаренными электронами, вступая в третью реакцию, даёт два дополнительных радикала, формирующих свои цепи. Так начинается разветвление и получается огромное число свободных радикалов, значительно превышающее концентрации радикалов в неразветвлённых реакциях. «Размножение» радикалов приводит к лавинообразному течению процесса, которое может вызвать взрыв. 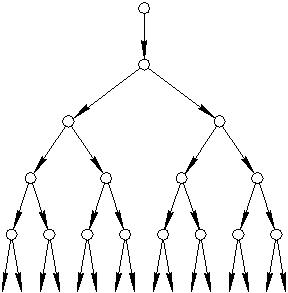 Рис.15. Схема нарастания количества свободных радикалов и скорости цепной радикальной реакции Однако и в этих процессах происходит обрыв цепей. Ясно, что лишь в том случае, когда разветвление цепи идет с большей скоростью, чем ее обрыв, скорость реакции в целом увеличивается. Некоторые вещества, например, тетраэтилсвинец, йод и другие, взаимодействуя с активными частицами (атомами и радикалами), образуют устойчивые соединения, тем самым снижая или полностью устраняя возможность взрыва. Такие вещества называют антидетонаторами. Инициаторы и ингибиторы. Наиболее энергоемкой стадией цепного процесса является реакция инициирования первичного образования активных частиц. При фото - и радиационно-химическом инициировании цепная реакция может проходить при относительно низких температурах, так как энергии активации реакций продолжения цепи обычно невелики. В случае термического инициирования, то есть реакции гомолитического разрыва связи, для наблюдения цепной реакции необходимо повышение температуры на многие десятки сотни градусов. Инициирование цепи способно происходить и при введении в смесь реагентов веществ, для которых гомолитический разрыв связи требует незначительной энергии, а образующиеся радикалы достаточно активны для того, чтобы при реакции образовывались переносчики цепи. Характерными веществами – инициаторами являются органические пероксиды и диазосоединения: В растворах к инициированию цепи приводит добавка веществ, легко отдающих электрон. Например, при добавлении соли Fe(ІІ) в раствор H2O2 (реактив Фентона) происходит реакция и последующий процесс разложения H2O2 с участием OH как переносчика цепи Вещества-инициаторы ускоряют цепной процесс, расходуясь по мере его протекания. Превышение скорости реакции над скоростью инициирования основной признак цепных реакций. Отношение этих скоростей характеризует длину цепи. Добавка ингибитора (In) уменьшает концентрацию переносчиков цепи R за счет создания дополнительных каналов их гибели. Простейшим по механизму действия является ингибитор стабильный радикал, При молекулярной природе ингибитора продукт его взаимодействия с Применение ингибиторов для практических целей позволяет увеличить сроки хранения технических и пищевых жиров и масел, сроки годности лекарственных препаратов, уменьшить процент разложения компонентов ракетных топлив при длительном хранении, увеличить сроки сохранения технических свойств полимерных веществ и т.п. Накоплен опыт использования ингибиторов в качестве лекарственных препаратов, тормозящих развитие опухолей и старения. (Большой вклад в изучение механизмов действия ингибиторов и развитие методов их применения в химической практике и медицине сделан Н.М.Эмануэлем и учеными его школы.) Наиболее распространены ингибиторы процессов окисления органических веществ. Их называют антиоксидантами. Общей характеристикой антиоксидантов является наличие в молекуле слабосвязанного атома водорода, с которым и взаимодействуют радикалы переносчики цепи. Большинство антиоксидантов относится к классу ароматических фенолов и аминов. Антиоксидантом природного происхождения является, в частности, аскорбиновая кислота витамин С. Важнейшими крупномасштабными промышленными нефтехимическими процессами, химическую основу которых составляют цепные реакции, являются полимеризация ненасыщенных соединений, крекинг нефти и окисление органических веществ. К цепным процессам относятся и ядерные цепные реакции. Здесь роль активной частицы играет нейтрон, проникновение которого в ядро атома может и привести к его распаду, сопровождающемуся выделением большой энергии и образованием новых свободных нейтронов, продолжающих цепь ядерных превращений. 1.6. Фотохимические реакции К фотохимическим относятся реакции, обуславливаемые действием лучистой энергии, главным образом , видимой части спектра электромагнитного излучения. Например, смесь газов водорода и фтора при ее освещении реагирует со взрывом; бромид серебра на свету разлагается с выделением металлического серебра; синтез сложных органических веществ растениями в процессе их жизнедеятельности также имеет фотохимическую основу (фотосинтез) и т.д. Очевидно, что на химическое состояние вещества может влиять то излучение, фотоны которого имеют энергию не ниже значений энергии химической связи, составляющей, в основном, 40 – 400 кДж/моль, что соответствует 1–10 эв (электронвольт) на одну связь. Фотоны, энергия которых лежит в указанных пределах, могут быть названы фотохимическими. Они возбуждают молекулу (ослабляют связи), вызывают перестройку ее внутренней структуры, разрыв старых внутримолекулярных связей и формирование новых, таким образом образуются новые молекулы – продукты реакции. Часто разрыв связей в молекулах приводит к образованию отдельных атомов или радикалов, обладающих очень высокой реакционной способностью, что инициирует цепные реакции. Фотохимические фотоны отвечают очень узкой области длин волн электромагнитного излучения, приблизительно 1000 – 10000А0, что и отвечает квантам с энергиями порядка десятка электронвольт. Некоторые примеры реакций, способных протекать фотохимическим путем (в скобках приведены длины волн излучения в ангстремах, вызывающие эти реакции): 1) 2NH3 N2 + 3H2 (2141) 2) 2CO O2 2CO2 (1470) 3) 2HI H2 + I2 (20002800) 4) H2S H2 + S (2080) В принципе, инициировать протекание подобных реакций можно и за счет повышения температуры. Однако, аналогичный эффект может быть достигнут только при температурах порядка 1000 15000С, что, чаще всего, невыгодно по технологическим и экономическим соображениям. Фотохимических реакций очень много. Важнейшим процессом в природе, значение которого невозможно переоценить, является фотосинтез в растениях. Под воздействием энергии солнечной радиации в зеленом листе растения протекает целый комплекс синтетических процессов, исходным материалом для которого служат углекислый газ, вода, минеральные соли. Конечными продуктами являются крахмал, клетчатка, белки, жиры и другие сложные органические вещества. Процесс фотосинтеза осуществляется при непосредственном участии важнейшего природного фотокатализатора – хлорофилла, а также многих других окислительно-восстановительных ферментов (биокатализаторов). Процесс фотосинтеза простейшего углевода – глюкозы C6H12O6 – можно представить в виде следующего суммарного уравнения: 6CO2 + 6H2O C6H12O6 + 6O2 161 кДж Масса органического вещества, синтезируемая растениями ежегодно, достигает многих сотен миллиардов тонн. Подсчитано, что из углекислого газа воздуха ежегодно фотосинтетически усваивается приблизительно 1,75 1011 тонн углерода, что эквивалентно десятку богатых (с запасами 57 млрд. тонн) месторождений угля. Одновременно в атмосферу возвращается около 4,7 1011 тонн газообразного кислорода (всего в воздухе содержится 1,3 1015 тонн кислорода, что, как считается, имеет биогенное происхождение, т.е. является продуктом фотосинтетического процесса). Схожим процессом является фоторедукция, составляющая основу углеродистого питания микроорганизмов. Отличие от фотосинтеза состоит в том, что газообразный кислород не выделяется (остается химически связанным в продуктах реакции). Процесс фоторедукции имеет место, например при жизнедеятельности определенного вида бактерий, выделяющих серу из сероводорода по схематическому уравнению CO2 + 2H2S CH2O + H2O + 2S Еще одним важнейшим процессом, играющим важнейшую роль для сохранения жизни на земле, является процесс образования озона в верхних слоях атмосферы. За счет коротковолновой составляющей солнечной радиации протекает фотохимический процесс (звездочкой отмечены возбужденные молекулы): O2 O2 ; O2 + O2 O3 + O Таким путем в атмосфере возникает зона, относительно богатая озоном. Последний поглощает и, таким образом, не пропускает на поверхность земли губительную для человека и всего живого составляющую солнечной радиации - лучи с длиной волны 2500 2600 А0. |
