1. скорость химической реакции
 Скачать 1.62 Mb. Скачать 1.62 Mb.
|
|
2.3. Способы выражения константы равновесия Константа равновесия может быть выражена различными способами. Если концентрации веществ, участвующих в реакции, выражены в молярных единицах молярности , т.е. в моль/л, то она обычно обозначается Кс и для равновесия обратимой реакции аА + bB dD + rR записывается в виде: 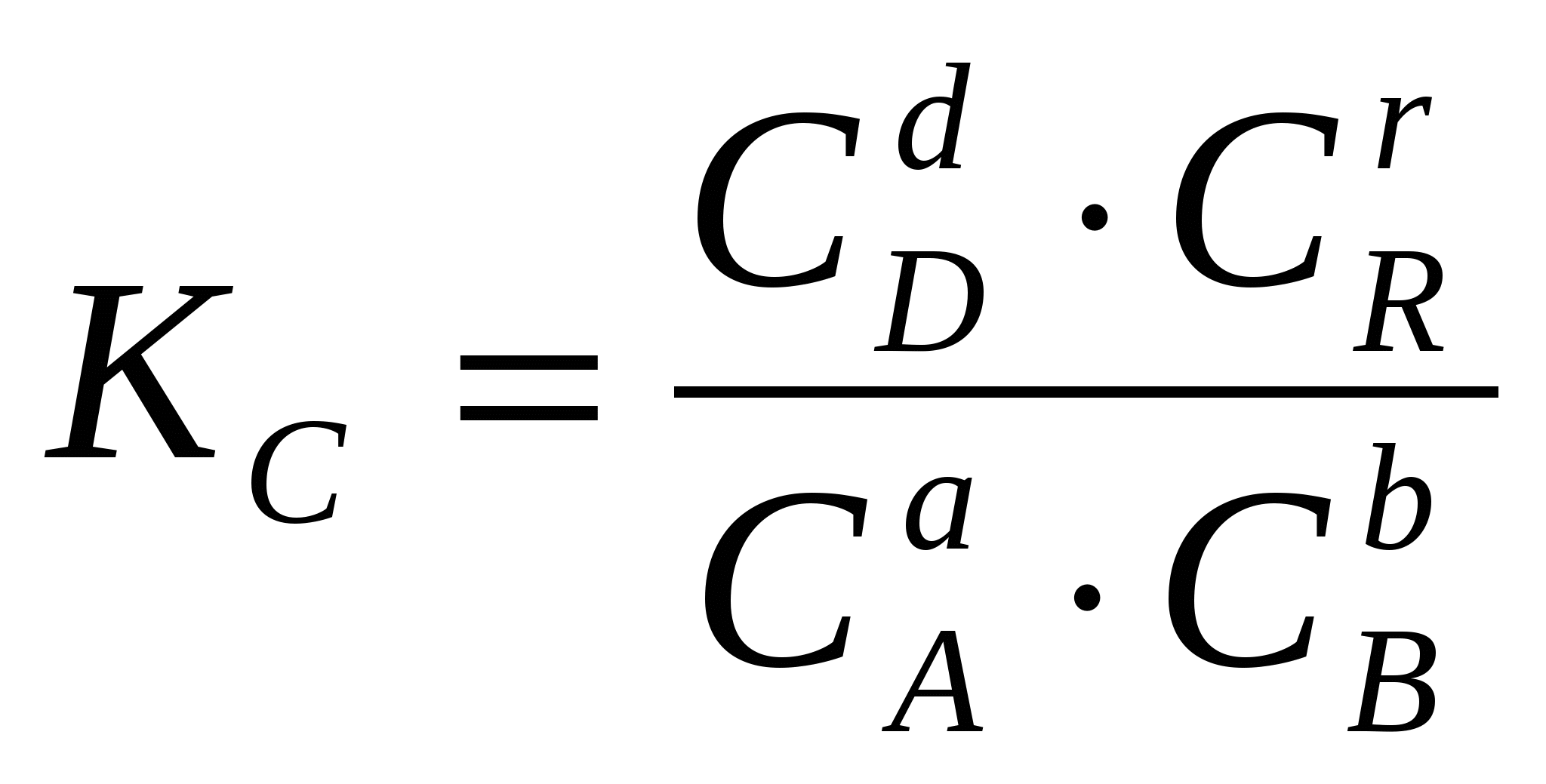 (2.4) (2.4)Для гомогенной газовой реакции константу равновесия удобнее выразить через парциальные давления веществ: 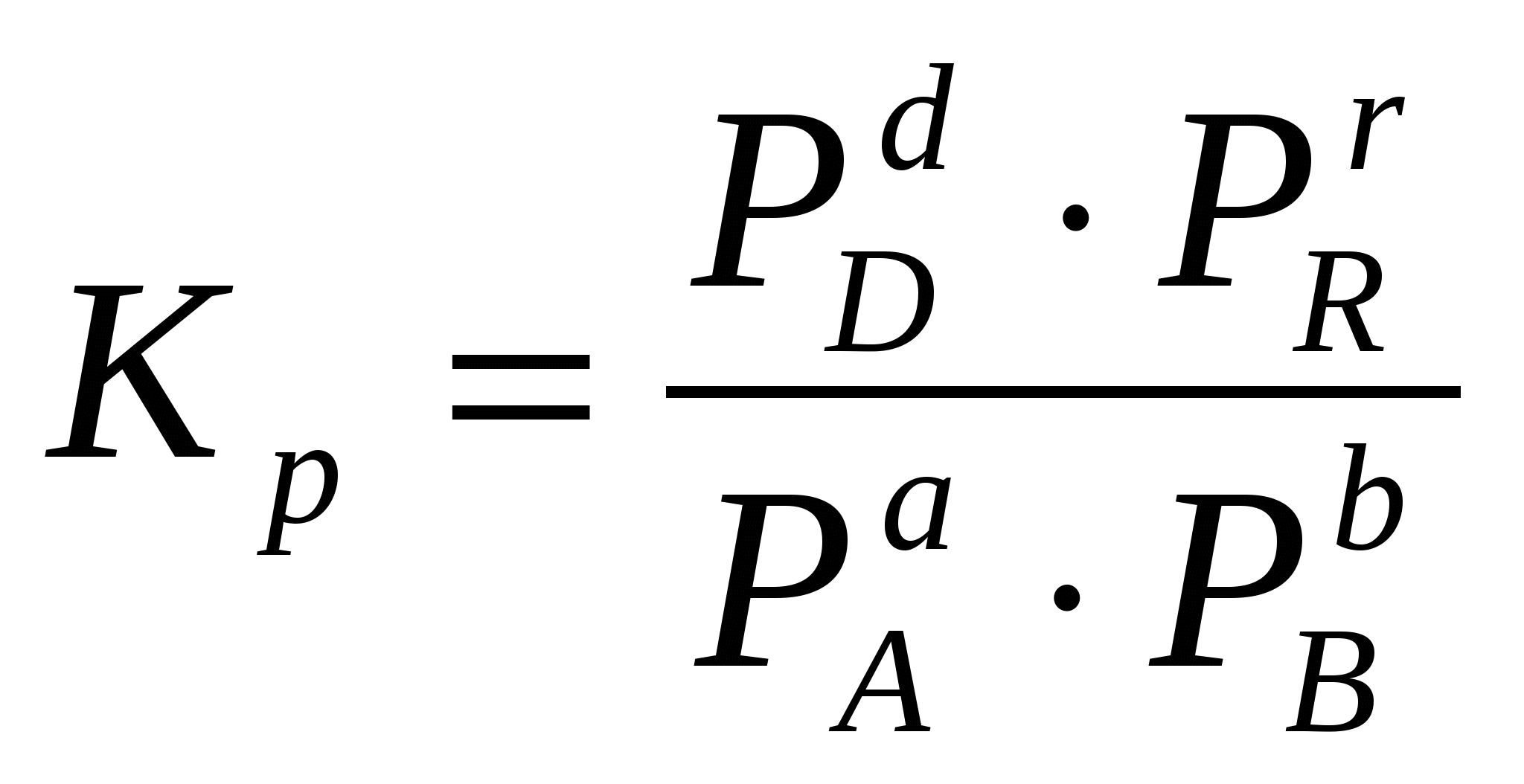 (2.5) (2.5)Иногда константу равновесия удобно выразить не через парциальные давления и концентрации, а через количества веществ: 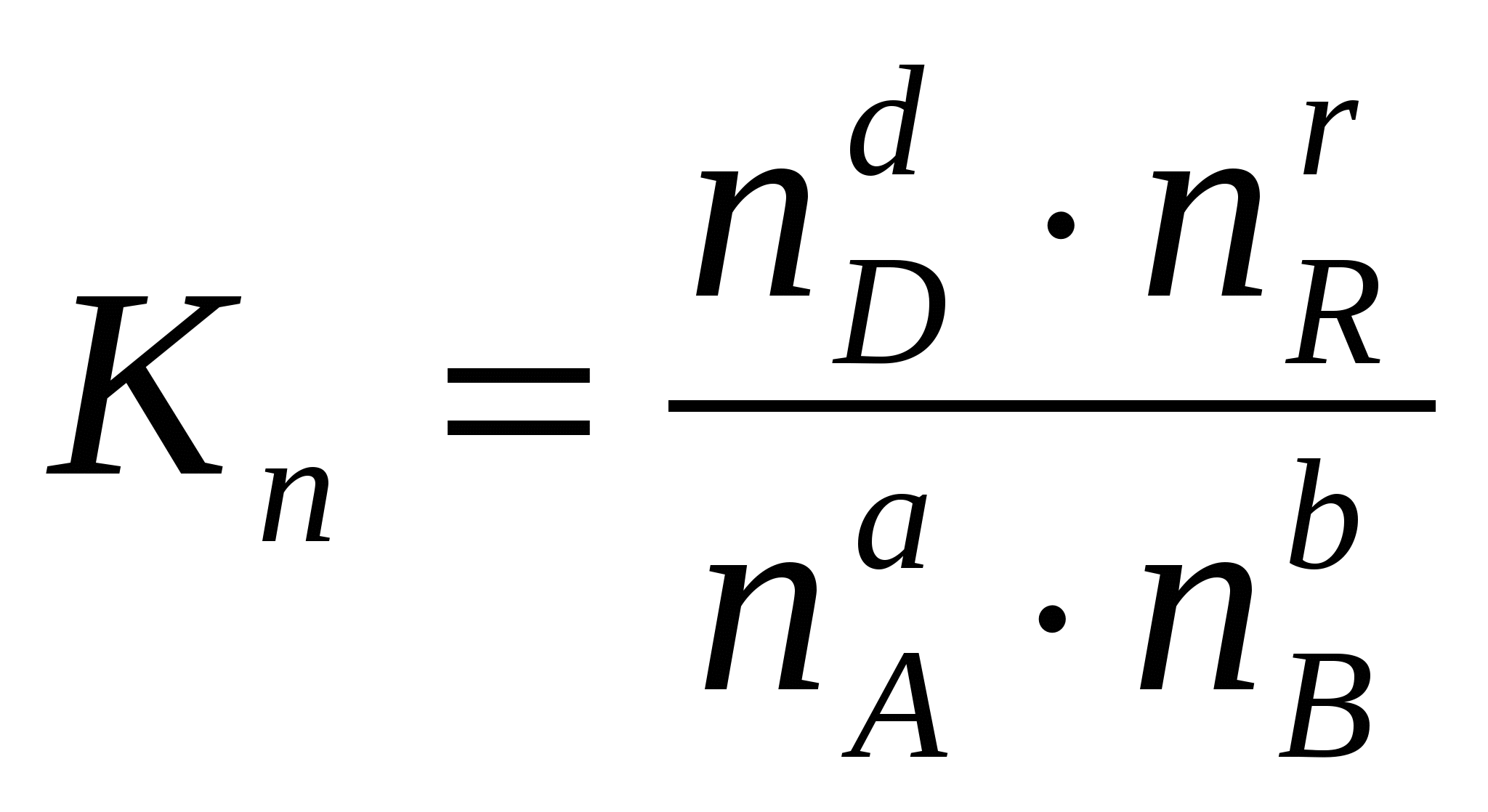 (2.6) (2.6)или через соответствующие мольные доли: 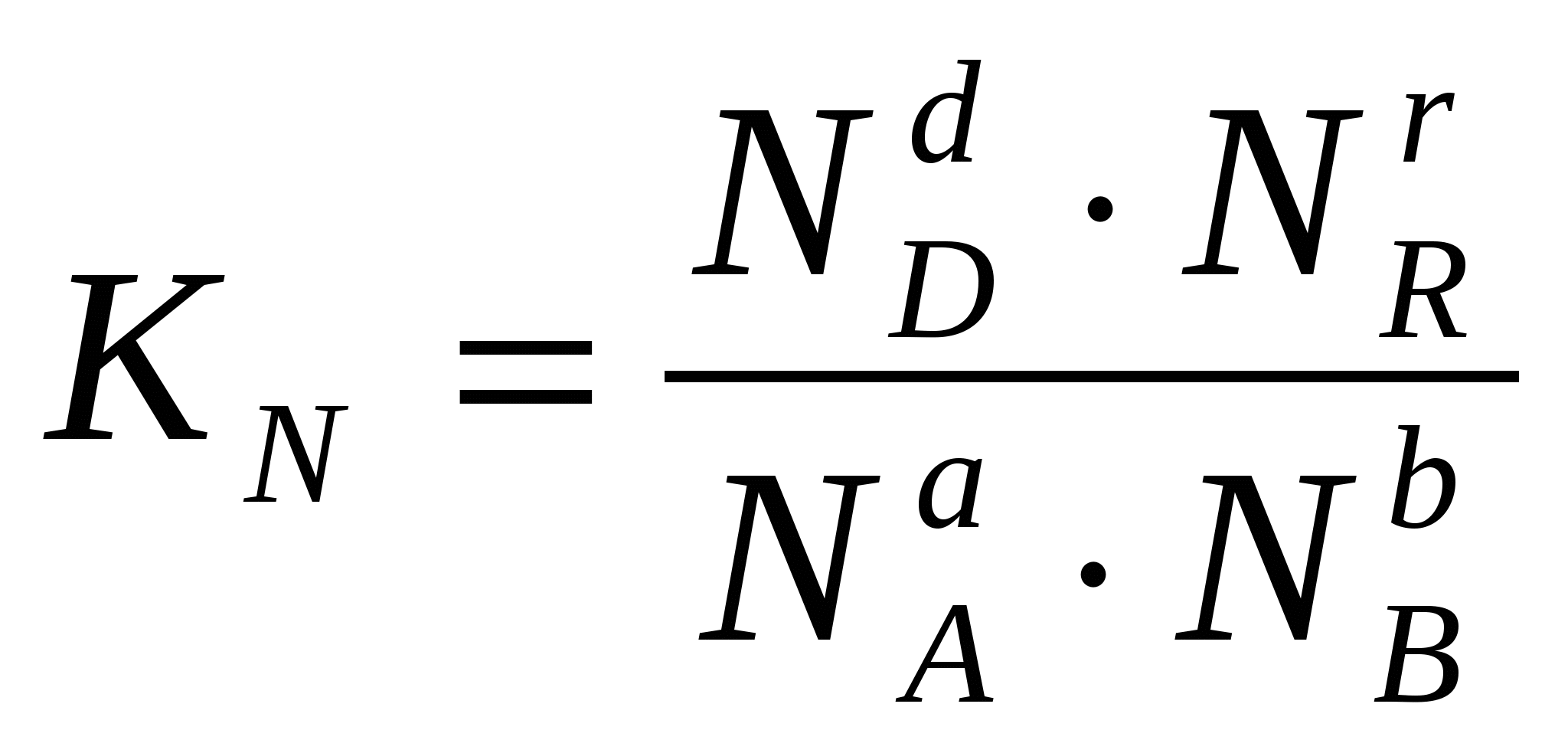 (2.7) (2.7)В общем случае константы равновесия Кс, Кр, Кn и КN различны по значениям. Установим связь между ними. В газовых системах, для характеристики которых применимо уравнение состояния идеальных газов Менделеева – Клайперона, значение парциального давления любого компонента можно вычислить следующим образом: откуда где C – концентрация i-го компонента, выраженная в моль/л. Подставим значение р из уравнения (2.8) в уравнение (2.5) и получим соотношение, которым определяется связь Кс и Кр: 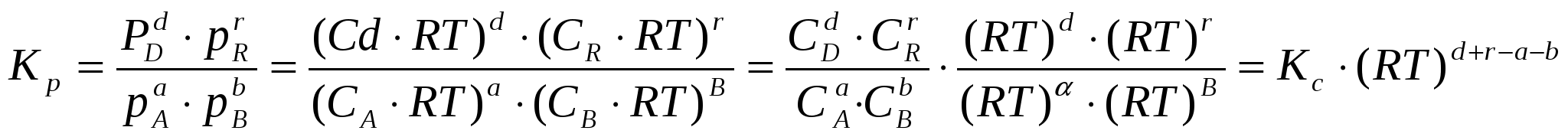 или где Для идеальных газов парциальные давления связаны с общим давлением Робщ и мольной долей Ni данного компонента в смеси согласно законам Дальтона следующим равенством: pi = NiPобщ (2.10), где рi – парциальное давление компонента; Ni – мольная доля этого компонента в смеси; Робщ – общее давление. Подставим значение рi в уравнение (2.5), получим: 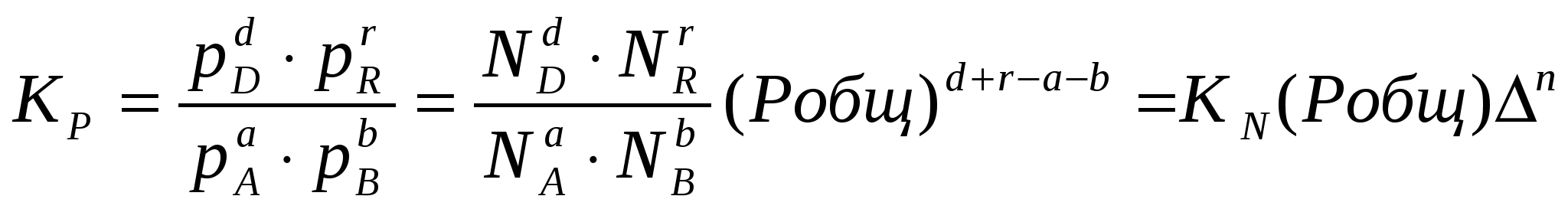 или Кр = К∙ (Робщ)∆n (2.11). Воспользовавшись соотношением Pi = Ni∙ Робщ = где ni – число моль компонента i в смеси, а ni – число моль всех компонентов в смеси, получаем: 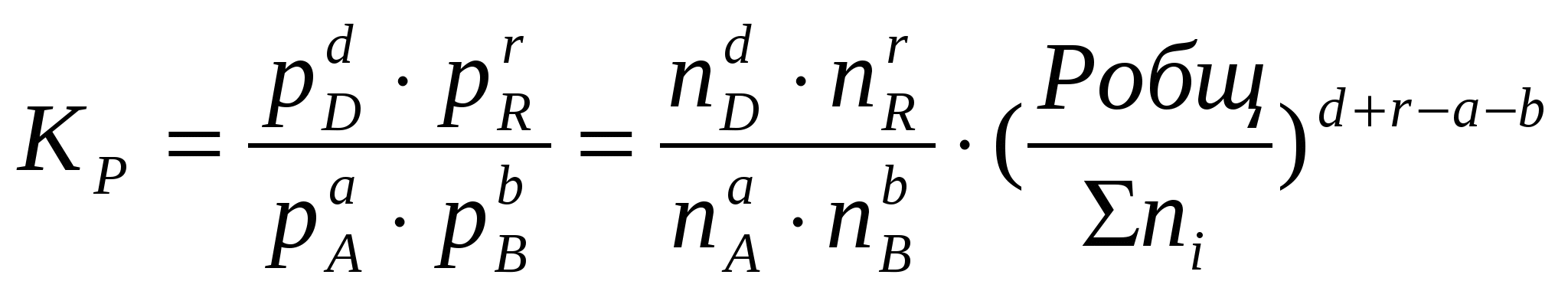 или или Таким образом, если n≠ 0, т.е. если реакция сопровождается изменением числа моль, то имеет место соотношение: Если же ∆n=0 (реакция не сопровождается изменением числа моль), то Кр = Кс = Кn = KN, т.е. значения всех видов констант равновесия совпадают. Кр и Кс для реакции идеальных газов не зависят от давления. КN и Кn от давления зависят в случае ∆n≠0. 2.4. Смещение химического равновесия При постоянных условиях химическое равновесие сохраняется как угодно долго. Однако внешние условия не могут бесконечно оставаться неизменными, а изменение хотя бы одного из них нарушает состояние равновесия, т.е. скорос- ти прямой и обратной реакций не будут равны между собой (v1 v2). Но, так как все физико-химические системы самопроизвольно стремятся к состоянию равновесия, то с течением времени оно вновь установится. Однако, это будет новое равновесие, с другими значениями равновесных концентраций, отвечающими другим, изменившимся условиям. В каком направлении сместится равновесие при том или ином внешнем воздействии? Ответ на этот вопрос дает принцип Ле-Шателье Брауна, который можно сформулировать следующим образом: если на систему, находящуюся в состоянии равновесия, оказывается какое – либо внешнее воздействие, то система отвечает таким образом, чтобы это воздействие ослабить. При этом, если в результате нарушения равновесия скорость прямой реакции будет больше скорости обратной реакции, то говорят, что равновесие смещено вправо (v1 v2), и соответственно, если преобладает скорость обратной реакции, говорят, что равновесие смещено влево (v1 v2 ). Важнейшими условиями, определяющими состояние химического равновесия, являются: 1) концентрация реагирующих веществ 2) температура 3) давление (для реакций, протекающих с изменением давления). Изменение хотя бы одного из них приведет к нарушению равновесия. 2.4.1. Влияние изменения концентрации на состояние равновесия Если концентрация какого-либо вещества в реакционной системе будет, например, повышена, то возрастет число столкновений его молекул с молекулами другого реагента и, следовательно, увеличится скорость реакции с участием этого вещества; таким образом, равновесие будет нарушено. С течением времени концентрации веществ, реагирующих с большей скоростью, будут понижаться и, соответственно, скорость реакции будет убывать, в то время как концентрации продуктов их взаимодействия будут возрастать, соответственно, скорость этой реакции будет увеличиваться. В конце концов будет достигнуто новое равновесие. В этом новом состоянии обе реакции протекают немного быстрее, чем в исходном состоянии, но скорости их будут одинаковы. Если концентрация какого-либо из веществ будет каким-то образом понижена, то в системе пойдут процессы противоположного характера, но в итоге скорости вновь выравняются (их значение будет несколько ниже, чем в исходном cостоянии). Таким образом: а) повышение концентрации одного из исходных веществ, вызывая увеличение скорости прямой реакции, приводит к смещению равновесия вправо (v1 v2); повышение концентрации одного из продуктов реакции, приводящее к возрастанию скорости обратного процесса, смещает равновесие влево (v1 v2 ); б) понижение концентрации одного из исходных веществ, вызывая уменьшение скорости прямой реакции, смещает равновесие влево (v1 v2 ), а уменьшение концентрации одного из продуктов реакции, приводящее к снижению скорости обратной реакции, смещает равновесие вправо (v1 v2). 2.4.2. Влияние изменения температуры на состояние равновесия Смещение равновесия вследствие изменения температуры удобно рассмотреть на примере какой- либо конкретной реакции: N2(г) 3H2(г) 2NH3(г) 91,8 кДж моль Как сместится равновесие, например, при повышении температуры? Из принципа Ле-Шателье следует, что подвод тепла извне должен стимулировать процесс, идущий с его поглощением, т.е. будет возрастать скорость обратной реакции (если прямая реакция – экзотермическая, то обратная эндотермическая, что непосредственно вытекает из закона сохранения энергии). Равновесие в данном случае сместится влево (v1 v2), и воздействие повышения температуры будет ослаблено. Это можно показать на практическом примере. Зная теплоемкости аммиака, водорода и азота, для определенного количества их смеси известного состава, находящейся в равновесии, можно рассчитать количество теплоты, необходимое для повышения температуры на столько-то градусов. Однако, в ходе химической реакции ( в данном случае разложение аммиака) часть тепла поглотится, т.е. будет аккумулирована в форме внутренней энергии системы, и в результате температура повысится на меньшее число градусов. При повышении температуры скорости и прямой, и обратной реакций увеличиваются, но неодинаково. Скорость эндотермического процесса возрастает в большей степени, что и вызывает смещение равновесия. При понижении температуры скорости обеих реакций уменьшатся, но в большей степени замедлится эндотермическая реакция, и равновесие, поэтому, также будет нарушено. Изложенное выше схематично можно изобразить следующим образом: экзотермический процесс охлаждение N2(г) + 3H2(г) 2NH3(г) эндотермический процесс нагревание В общей форме влияние изменения температуры на химическое равновесие можно выразить следующим образом: повышение температуры благоприятствует эндотермическим, а понижение – экзотермическим реакциям. В реакциях, протекающих с незначительным тепловым эффектом, изменение температуры практически не вызывает смещения равновесия. В этом случае повышение температуры лишь ускоряет достижение нового состояния равновесия, которое могло бы установиться и без нагревания вследствие изменения других внешних условий. На рисунке 19 приведены экспериментальные данные, иллюстрирующие влияние температуры на состояние химического равновесия при различных давлениях. Видно, что содержание аммиака в равновесной смеси с повышением температуры уменьшается, что является подтверждением изложенного нами выше. 2.4.3. Влияние изменения давления на состояние равновесия Из экспериментальных данных (рис. 19) следует, что процентное содержание аммиака в системе с повышением давления (Р) возрастает при любой температуре. 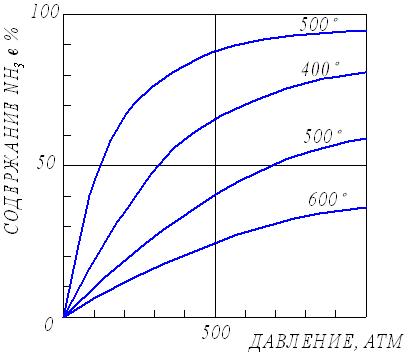 Рис.19. Влияние температуры и давления на состояние химического равновесия при синтезе аммиака. Сопоставим эти данные с изменением числа молекул в газовой смеси: повышение внешнего давления уменьшение общего числа молекул N2(г) + 3H2(г) 2NH3(г) понижение внешнего давления увеличение общего числа молекул В левой части уравнения всего 4 моль газов, а в правой 2. Четыре моль газа при данной температуре и давлении, согласно закону Авогадро, займут объем в два раза больший, чем два моль. Следовательно, процесс синтеза аммиака сопровождается уменьшением общего числа молекул, что приводит к уменьшению объема системы. Этот процесс, как видно из экспериментальных данных, усиливается при повышении давления. Уменьшение давления действует, соответственно, в обратном направлении: усиливая процесс разложения аммиака, оно способствует увеличению общего числа молекул в системе согласно уравнению 2NH3 3H2 + N2, откуда видно, что из двух молекул образуется четыре молекулы: одна – азота и три – водорода. Обобщая, можно сформулировать следующее: а) если реакция идет с изменением числа молекул газов, то давление влияет на ее скорость и, следовательно, вызывает нарушение равновесия, б) повышение давления увеличивает скорость реакции, протекающей с понижением давления, и, соответственно, наоборот. Значения равновесных концентраций веществ в системе H2(г) + Cl2(г) 2HCl(г) при изменении давления остаются постоянными (по два моль газов в обеих частях уравнения). 2.5. Влияние температуры на константу равновесия При рассмотрении вопроса о смещении равновесия показано качественное влияние температуры на константу равновесия. Количественно эта зависимость определяется уравнением Вант-Гоффа. Покажем вывод этого уравнения. Так как константа скорости химической реакции зависит только от температуры, то, очевидно, и константа равновесия зависит только от температуры. Подставив в выражение константы равновесия значения констант скоростей прямой и обратной реакций из уравнения Аррениуса и выполнив несложные преобразования, можно получить Кр = k1/k2 = (А1/А2)е(Е2Е1)/RT = А еЕ/RT, (2.13) где А1 и А2, Е1 и Е2соответственно предэкспоненциальные множители и энергии активации прямой и обратной реакций, а Е разность энергий активации обратной и прямой реакций. Эта разница соответствует тепловому эффекту реакции. Тогда зависимость константы равновесия от температуры выразится уравнением: Кр = А еQ/RT (2.14) Если Q 0, т.е. реакция идет с поглощением тепла (эндотермическая), то значение константы равновесия с повышением температуры возрастает (рис.20). Если Q 0, т.е. тепло в результате реакции выделяется (экзотермическая), то с увеличением температуры значение константы уменьшается. 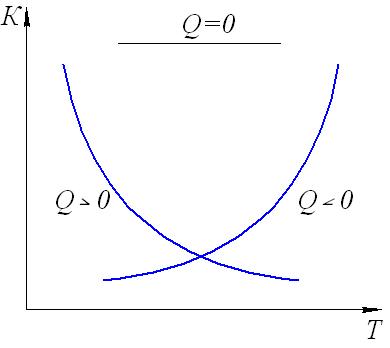 Рис.20. Зависимость константы равновесия от температуры Выводы, сделанные на основании уравнения Вант-Гоффа, находятся в полном соответствии с принципом Ле-Шателье. Покажем возможности использования уравнения Вант-Гоффа для определения константы равновесия при разных температурах и вычисления теплового эффекта реакции. Прологарифмируем уравнение (2.14): lgКр = Q/(2,303 RT) + lgA или lgКр = (Q/(2,303 R))(1/Т) + lgA (2.15) Последнее выражение представляет собой уравнение прямой линии в координатах lgКр – 1/Т: Если построить график зависимости lgКр от 1/Т (рис.21), то полученная экспериментальная прямая отсечет на оси ординат отрезок, равный lgA и имеющий наклон, равный Q/(2,303RT), откуда можно определить Q. Если принять, что тепловой эффект реакции не зависит от температуры, что допустимо в небольших температурных интервалах, то зная константу равновесия при одной температуре (Т1), можно определить константу равновесия при любой другой температуре (Т2). Запишем выражения константы равновесия для температур Т1 иТ2: lgКр1 = Q/(2,303RT1) + lgA, lgКр2 = Q/(2,303RТ2) + lgA. 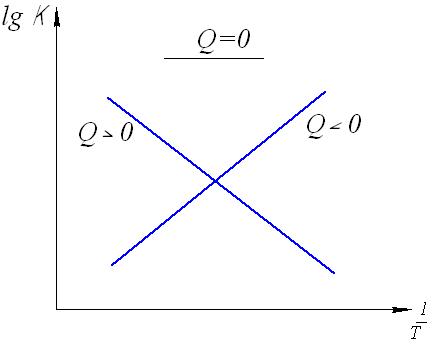 Рис.21. Зависимость логарифма константы равновесия от температуры. Вычитая второе уравнение из первого, получим: lg(Кр1/Кр2) = (Q/(2,303R)) (1/Т11/Т2) (2.16). Этим уравнением можно воспользоваться для вычисления теплового эффекта реакции, если известны константы равновесия при двух температурах. Немаловажно отметить, что константа равновесия (а значит и состояние равновесия) не зависит от энергии активации. Это следует из уравнения (2.13) и подтверждается экспериментально. Очевидно, что изменение, например, увеличение константы равновесия с изменением температуры еще не означает достижения высокого выхода продуктов реакции и, соответственно, целесообразности осуществления процесса в препаративных целях, так как абсолютное значение Кр может оставаться невысоким. Например, уже при достаточно высокой температуре 1000 К константа равновесия эндотермической реакции N2 + O2 2NO очень мала всего 5,5.10-9. Повышение температуры до 2000 К увеличивает значение константы до 3,3.10-4, но даже при 5000 К ее величина составляет всего 0,24. Только при температуре 15000 К значение константы равновесия образования оксида азота достигает 4,5 величины, которую в какой-то степени можно считать приемлемой. Но эта температура в два с половиной раза выше, чем на поверхности Солнца. 2.6. Состояние равновесия и катализаторы Катализаторы не смещают равновесия и не изменяют величины константы равновесия. Они уменьшают время достижения состояния равновесия , но не влияют на равновесные концентрации. Катализатор не изменяет ни начального, ни конечного состояния реагирующих веществ, значит он не влияет на общий энергетический эффект реакции. Он только направляет реакцию по другому пути, изменяет ее механизм и увеличение скорости реакции обусловливается снижением ее энергии активации. Но энергия активации не влияет на положение равновесия, следовательно, на него не влияет и присутствие катализатора. Поскольку катализатор ускоряет прямую реакцию не влияя на равновесие, он во столько же раз должен ускорять и обратную реакцию, так как при равновесии скорости прямой и обратной реакции равны. 2.7. Использование кинетических знаний в управлении химическим процессом Принципиальная возможность протекания химической реакции еще не означает, что на ее основе можно организовать промышленный процесс. Очевидно, что для эффективного производства того или иного продукта, особенно крупнотоннажного, совершенно необходимы детальные знания о закономерностях протекания реакций, что позволяет осуществлять его в оптимальном технологическом, экономически выгодном режиме. И кинетические данные, позволяющие выявлять и изучать механизмы реакций, судить об их скоростях и условиях протекания, играют здесь ключевую роль. Рассмотрим примеры химических процессов, реализованных в промышленных масштабах. 1. Аммиак получают прямым синтезом из азота и водорода (процесс Габера): N2(г) + 3H2(г) 2NH3(г) + 91,8 кДж Необходимо обосновать оптимальные условия проведения процесса с высоким выходом целевого продукта (см. рис.19). Реакция равновесная, каталитическая. В качестве катализатора используется пористое железо, содержащее добавки оксидов алюминия, калия, кальция, кремния. Поскольку прямая реакция экзотермическая, то очевидно (согласно принципу Ле-Шателье), что равновесие будет тем больше смещено в сторону образования аммиака, чем ниже температура процесса. Однако при низких температурах теряет активность катализатор, и скорость реакции очень мала. Поэтому приходится принимать «компромиссное» решение: процесс проводят при 5000С. Из уравнения реакции видно, что общее число моль газообразных веществ по прямой реакции уменьшается от четырех до двух. В таком случае (по принципу Ле-Шателье) для смещения равновесия вправо нужно повышать давление, однако пределы повышения ограничиваются экономическим фактором стоимостью соответствующего оборудования. На практике давление составляет 300 – 350 атм. При указанных условиях выход аммиака составляет только около 30%, однако в результате использования циркуляционной технологической схемы охлаждение газовой смеси после реакции, конденсация и отделение содержащегося в ней аммиака (что, в свою очередь, способствует смещению равновесия вправо), введение непрореагировавших азота и водорода вновь в колонну синтеза суммарная степень превращения исходных веществ в целевой продукт достигает очень высокой величины. 2. Превращение графита в алмаз представляет собой равновесную эндотермическую реакцию с незначительным тепловым эффектом: Сграфит Салмаз 1,9 кДж Согласно принципу Ле-Шателье смещению равновесия вправо будет способствовать повышение температуры, однако увеличение скорости процесса при этом оказалось очень незначительным; кроме того, при этом возрастала и скорость обратной реакции. Решающее значение для возможности практической реализации процесса имеет давление. Причина в том, что плотность алмаза (3,5 г/см3) заметно больше плотности графита (2,2 г/см3), что связано с различием в строении их кристаллических решеток. Следовательно, чтобы сместить равновесие вправо в сторону получения алмаза, нужно повысить давление, которое способствует его образованию в связи с тем, что он занимает меньший объем, чем графит (в полном соответствии с принципом Ле-Шателье). Для практического осуществления реакции потребовались давления порядка десятков тысяч атмосфер. Ясно, что в других случаях используются и все другие возможные факторы управления химическим процессом. |
