1. скорость химической реакции
 Скачать 1.62 Mb. Скачать 1.62 Mb.
|
|
2.8. Примеры решения задач Пример 1. Всеми возможными способами сместить равновесие реакции 4HCl + O2 2H2O + 2Cl2 + Q (H 0) вправо. Все вещества находятся в газообразном состоянии. Решение. Смещение равновесия вправо означает состояние системы, при котором скорость прямой реакции больше скорости обратной реакции. Равновесие можно смещать, изменяя концентрации веществ (1), температуру (2), давление (3). Используем правила, вытекающие из принципа Ле-Шателье: 1) увеличиваем концентрации хлористого водорода и кислорода; к такому же результату приведет уменьшение концентраций воды и хлора (оставляем без обсуждения практическую возможность понижения концентраций продуктов прямой реакции); 2) прямая реакция экзотермическая, поэтому температуру системы нужно понизить; 3) давление следует увеличить, так как прямая реакция идет с понижением давления. Пример 2. Обратимая реакция выражается уравнением N2 3H2 2NH3. К моменту достижения равновесия концентрации веществ составили: [N2] = 2 моль/л, [Н2] = 1 моль/л, [NН3] = 3 моль/л. Найти значение константы равновесия и начальные концентрации азота и водорода. Решение. Константу равновесия вычисляем по уравнению Кр = [NH3]2/([N2][H2]3). Подставляя значения равновесных концентраций, получаем: Кр = 32/(2 13) = 4,5. Чтобы определить значения начальных концентраций азота и водорода нужно принять во внимание , что в соответствии с уравнением реакции один моль азота и три моль водорода взаимодействуют между собой с образованием двух моль аммиака: 1N2 2NH3, 3H2 2NH3. Отсюда, для образования трех моль аммиака требуется: 1N2 2NH3 хN2 3NH3, х=1 3/2=1,5 моль азота ([N2]) и 3H2 2NH3 yH2 3NH3, y=3 3/2=4,5 моль водорода ([H2]). Тогда начальные концентрации азота и водорода составят [N2]0 = [N2] + [N2] = 2 + 1,5 = 3,5 моль/л [H2]0 = [H2] + [H2] = 1 +4,5 = 5,5 моль/л. Пример 3. Константа равновесия реакции H2 + I2 2HI равна четырем. Найти концентрации всех веществ в состоянии равновесия, если начальные концентрации составляли: [H2]0 = 3 моль/л, [I2] = 1,5 моль/л. Решение. Из уравнения реакции видно, что из одного моль водорода и одного моль йода образуется два моль HI. Примем число моль одного из исходных веществ, например, водорода, прореагировавших к моменту наступления равновесия, за x ([H2]). Тогда концентрации веществ в состоянии равновесия будут равны (см. предыдущий пример): [H2] = 3x, [I2] = 1,5x, [HI] = 2x. Подставив эти значения в выражение константы равновесия, получаем: Кр = [HI]2/([H2][I2]) 4 = (2x)2/((3x)(1,5x)). Решая квадратное уравнение, получаем один корень, удовлетворяющий смыслу задачи: х = 1. Теперь можно найти равновесные концентрации веществ: [H2] = [H2]0[H2] = 31 = 2 моль/л [I2] = [I2]0 [I2] = 1,5 1 = 0,5 моль/л [HI] = 2[H2] = 2 1 = 2 моль/л Можно проверить правильность решения, вычислив по найденным значениям константу равновесия: Кр = 22/(2 0,5) = 4. Пример 4. Вычислить константу равновесия реакции; оценить устойчи- вость диоксида азота при нормальных условиях 2NO + O2 NO2. Определяем G0(298) реакции. Для этого используем табличные значения энергий Гиббса образования оксида и диоксида азота: 86,6 кДжмоль и 51,5 кДжмоль соответственно. G0(298) = 51,5 2 86,6 = 121,7 кДж. Найденное значение подставляем в уравнение (2.3): 121,7 = 5,71 lgКр и получаем: lgКр 21, отсюда Кр = [NO2]/[NO]2 = 1021. Большое значение найденной нами константы равновесия показывает, что при стандартных условиях равновесие 2NO + O2 NO2 сильно смещено вправо, а это значит, что при 250С диоксид азота устойчивое соединение. 3. КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Что изучает химическая кинетика? 2. Что понимают под скоростью химической реакции? 3. Что такое истинная и средняя скорость химической реакции? 4. Какие реакции называются практически необратимыми (односторонними)? Приведите примеры. 5. Приведите примеры реакций, скорости которых значительно различаются. 6. В каких единицах измеряется скорость химической реакции ? 7. По каким признакам классифицируются реакции в химической кинетике? 8. Какие реакции называются последовательными? 9. Что называют лимитирующей стадией реакции? 10. Перечислите факторы, влияющие на скорость химической реакции. Приведите примеры. 11. Как влияет на скорость реакции изменение концентраций реагирующих веществ? Сформулируйте закон действующих масс. Приведите его математическое выражение. 12. Как влияет изменение температуры на скорость реакции? Сформулируйте эмпирический закон Вант-Гоффа. Приведите его математическое выражение. 13. На скорость каких реакций и как влияет изменение давление? 14. Как и почему растворитель влияет на скорость реакций? 15. В чем различие роли растворителя в протекании гомо - и гетерогенных реакций? Как это отражается на скорости их протекания? 16. Что называется порядком и молекулярностью реакции? 17. Приведите примеры реакций первого и второго порядков. Покажите математические выражения для констант скоростей первого и второго порядков. 18. Каким образом по экспериментальным данным можно сделать вывод о порядке реакции (для необратимых реакций первого и второго порядков)? 19. Какой физический смысл имеет константа скорости химической реакции? Какую размерность она может иметь? 20. От каких факторов зависит величина константы скорости химической реакции? 21. Как экспериментально определяют константы скоростей реакций первого, второго порядков? 22. Приведите уравнение Аррениуса. Что оно выражает? 23. Что называется энергией активации? Покажите схему энергетической диаграммы, соответствующей протеканию реакции А + В = С + Д Н > 0. 24. Сформулируйте основные положения теории активных столкновений и активного комплекса. 25. Что понимают под энтропией активации? Как от нее зависит скорость химической реакции? 26. Что такое катализ? Какие вещества называются катализаторами? какие ингибиторами? 27. Каков механизм действия катализаторов? Как они влияют на энергию активации реакции? 28. В чем различие гомогенного и гетерогенного каталитических процессов? 29. Из каких основных стадий состоит гетерогенный каталитический процесс? 30. Какие реакции называются цепными? Из каких стадий состоит цепной процесс? 31. Какие вещества называют инициаторами? ингибиторами? Какие роли они играют в цепных процессах? 32. Каковы области практического применения ингибиторов? 33. Какие реакции называются фотохимическими? 34. Какие реакции называют необратимыми? обратимыми? 35. Приведите примеры практически обратимых реакций. Какие экспериментальные признаки они имеют? 36. Что называется состоянием химического равновесия? Почему его называют динамическим? 37. Изменяются ли и почему концентрации веществ в состоянии равновесия? Как они называются? 38. Что означает «смещение» («сдвиг») химического равновесия? 39. Сформулируйте принцип Ле–Шателье. 40. Изменение каких параметров системы приводит к смещению равнове- сия? 41. Как влияет на состояние равновесия изменение концентрации веществ? 42. Как влияет на состояние равновесия изменение температуры? 43. Как влияет на состояние равновесия изменение давления? В каком случае оно не вызывает смещения равновесия? 44. Какой физический смысл имеет константа химического равновесия? 45. Как константа равновесия выражается через равновесные концентрации веществ? 46. От чего зависит константа равновесия? 47. Каково практическое значение знания величины константы равновесия? 48. Как связаны между собой значения константы равновесия и изменения энергии Гиббса реакции? 49. Влияют ли катализаторы на величину константы равновесия? Почему? 50. Зависит ли константа равновесия от энергии активации реакции? Почему? 4. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Лабораторная работа №1. Кинетика химических реакций Опыт №1. Изучение зависимости скорости гомогенной реакции от концентрации реагирующих веществ. Эту зависимость можно изучить на классическом примере гомогенной реакции взаимодействия тиосульфата натрия с серной кислотой, протекающей по уравнению Na2S2O3 + H2SO4 = Na2SO4 + S + SO2 + H2O. Сера образует с водой коллоидный раствор. Время реакции засекают по секундомеру от момента сливания реагентов до появления едва заметного помутнения. Определив время, можно вычислить относительную скорость реакции v = 1/. Ход работы: приготовить три сухие чистые пробирки, пронумеровать их. В первую пробирку внести 4 капли раствора тиосульфата натрия и восемь капель воды, во вторую 8 капель тиосульфата натрия и 4 капли воды, в третью 12 капель тиосульфата натрия без добавления воды. Пробирки встряхнуть. Получим три раствора тиосульфата натрия разной концентрации. Если условно обозначить молярную концентрацию тиосульфата натрия в первой пробирке через «с», то во второй пробирке она будет, соответственно, 2с моль/л, в третьей3с моль/л; в первую пробирку внести одну каплю серной кислоты. Одновременно включить секундомер; встряхивая пробирку, держа ее на уровне глаз, следить за появлением мути. При появлении малейших ее признаков остановить секундомер, отметить время реакции и записать его в таблицу. Пробирку сразу тщательно вымыть; проделать аналогичные опыты во второй и третьей пробирках. Результаты занести в таблицу. По полученным данным построить график зависимости v = f(c), откладывая по оси абсцисс концентрацию, а по оси ординат скорость. Сделать вывод о характере зависимости скорости данной реакции от концентрации тиосульфата натрия. Таблица 3 Экспериментальные данные для определения зависимости скорости реакции от концентрации
Опыт№2. Изучение зависимости скорости гомогенной реакции от температуры. Для эксперимента можно использовать ту же реакцию, что и в опыте №1: Na2SO3 + H2SO4 = Na2SO4 + S + H2O. Ход работы: приготовить три чистые сухие пробирки, пронумеровать их; в каждую внести по 12 капель раствора тиосульфата натрия; пробирку 1 поместить в стакан с водой и через 1-2 минуты отметить температуру. Затем внести в нее 1 каплю серной кислоты, одновременно включить секундомер и остановить его при появлении слабой, едва заметной мути. Результат записать в таблицу; повысить температуру воды в стакане на 100С (нагреванием на плитке, либо смешиванием с горячей водой). Поместить в стакан пробирку 2, выдержать несколько минут до достижения нужной температуры и добавить одну каплю серной кислоты, одновременно включив секундомер. Встряхивать пробирку до появления мути (результат внести в таблицу); аналогично провести опыт в третьей пробирке, повысив температуру в стакане еще на 100С. Таблица 4 Экспериментальные данные для расчета температурного коэффициента реакции
По полученным данным построить график зависимости v = f(t), откладывая по оси абсцисс температуру, а по оси ординат скорость. По уравнению Вант-Гоффа = vt/v0 рассчитать температурный коэффициент реакции. Сделать вывод о влиянии температуры на скорость реакции. Опыт №3. Изучение скорости гетерогенной реакции от степени измельчения (площади соприкосновения) веществ. Ход работы: в две пробирки поместить одинаковые количества мела (или мрамора). В одной пробирке мел должен быть в виде мрамора, в другой в виде порошка; прилить в пробирки по небольшому равному количеству 5% соляной кислоты. Заметить время, которое потребовалось для полного растворения мела. В какой пробирке реакция идет быстрее и почему? Составить уравнение реакции взаимодействия мела с соляной кислотой. Сделайте вывод о роли степени измельчения твердых веществ в гетерогенных реакциях. Лабораторная работа №2. Катализ Опыт №1. Изучение влияния диоксида марганца на скорость разложения пероксида водорода. Реакция разложения пероксида водорода выражается уравнением H2O2 H2O + 0,5O2. Ход работы: налить в пробирку 3-4 мл 2% раствора перекиси водорода. Опустить тлеющую лучину, не касаясь раствора. Отметить, вспыхивает ли лучина; бросить в пробирку небольшую щепотку MnO2 и вновь внести в нее лучину. Вспыхивает ли она? объяснить наблюдаемые явления. Сделать вывод о роли диоксида марганца в этой реакции. Опыт №2. Влияние катализатора на энергию активации гомогенной реакции. В результате работы необходимо определить, как влияют на энергию активации реакции окисления йодистого калия персульфатом калия или натрия небольшие добавки сульфата железа или меди. Ход работы: в три пробирки на половину объема налить 0,1н йодистый калий, в три другие персульфат и поместить их попарно в три термостата с разной температурой; в шесть пробирок отмерить по 1 мл тиосульфата натрия, по нескольку капель крахмала и раствора сульфата железа или меди и поместить их в термостаты (по две на каждую температуру); приготовление реакционных смесей начинать с меньшей температуры. В пробирки с тиосульфатом натрия добавить по 2 мл персульфата и 2 мл йодистого калия. В момент добавления йодистого калия отметить время начала реакции; приготовить реакционные смеси в термостатах с более высокими температурами. В момент появления синей окраски еще раз отметить время. Разность двух отсечек времени дает , за которое концентрация реагирующих веществ изменится на одну и ту же величину. Усреднить время , для каждой зависимости lg(1/) от 1/Т, из которой по формуле Е=4,575 tg рассчитать энергию активации реакции в присутствии катализатора. Полученные данные сравнить со значением энергии активации в отсутствии катализатора (воспользоваться справочными данными или определить экспериментально). Опыт №3. Автокатализ. Ход работы: в пробирку с азотной кислотой поместить немного медных стружек и наблюдать их растворение. Заметить, что при появлении диоксида азота интенсивность растворения меди резко возрастает. Зафиксировать период индукции и продолжительность процесса растворения меди. Составить уравнение реакции. Сформулировать вывод о влиянии диоксида азота (продукта реакции) на скорость ее дальнейшего протекания. Лабораторная работа №3. Изучение кинетики каталитического разложения пероксида водорода Пероксид водорода в водных растворах медленно разлагается. Реакция может быть выражена двумя стадиями: H2O2 H2O + O 2O O2; процесс практически необратим. Скорость реакции определяется первой стадией, как более медленной: v = k[H2O2]. В этом уравнении концентрация перекиси водорода находится в первой степени , следовательно, это реакция первого порядка. В обычных условиях скорость разложения перекиси водорода невелика. В присутствии катализаторов процесс значительно ускоряется и может идти со взрывом. Существует множество катализаторов этой реакции, как в водных растворах, так и в твердом состоянии. В водных растворах процесс катализируется многими ионами, например, Fe2+, Fe3+, Cr2O72, MoO42, I, диоксидом марганца и др. Одним из наиболее распространенных методов изучения кинетики разложения перекиси водорода является газометрический метод (рис.22). Ход работы: 1) заданные количества 7,5-го раствора перекиси водорода, 10 раствора FeCl3 и дистиллированной воды выдерживаем в течение 10 минут при определенной температуре (от 20 до 400С) в водяной бане. Объем воды берется с таким расчетом, чтобы объем реакционной смеси в серии опытов был постоянным. Вода и перекись водорода будут находится в термостатируемом сосуде; 2) проверяем герметичность системы; 3) открываем кран (5) на такой высоте, чтобы уровень воды поднялся до нулевой отметки. Заливаем в реакционный сосуд необходимые количества на- 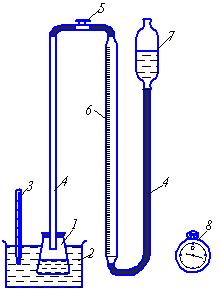 Рис.22. Схема лабораторной установки для изучения кинетики разложения пероксида водорода. 1-реакционный сосуд; 2-водяной термостат; 3-термометр; 4-соединительные шланги; 5-двухходовой кран; 6-измерительная газовая бю- 7-уравнительный сосуд; секундомер. гретых до рабочей температуры дистиллированной воды, затем перекиси водорода, и, в последнюю очередь, раствора хлорного железа. Растворы перемешиваем, затем быстро и плотно соединяем реакционный сосуд с бюреткой (6), закрываем кран (5), включаем секундомер и замеряем объем выделившегося кислорода; 4) в первые 57 минут производим замеры через 1 минуту, при этом уравнительный сосуд непрерывно опускаем, чтобы уровни воды в бюретке (6) и сосуде (7) были одинаковыми. В последующее время замеры производим каждые три минуты, предварительно устанавливая одинаковые уровни воды в бюретке и сосуде; 5) через 2025 минут, когда выделение кислорода заметно замедляется, заменяем водяной термостат (2) на стакан с горячей водой (с температурой не ниже 700 С) и выдерживаем реактор при этой температуре в течение двадцати минут. Затем реактор вновь помещаем в термостат с заданной температурой воды и через десять минут замеряем предельный объем выделившегося кислорода. Выполняем опыты, показывающие зависимость скорости реакции от концентрации катализатора (опыт №1) и температуры (опыт №2). Опыт №1.Зависимость скорости реакции от концентрации катализатора. При одном и том же количестве перекиси водорода создаем 4 5 различных концентраций катализатора, выдерживая постоянство объема реакционной смеси. По результатам эксперимента вычисляем средние значения константы скорости и формулируем соответствующие выводы. Рекомендуемая температура комнатная. Примерные количества реагентов для выполнения эксперимента: объем 7,5% раствора перекиси водорода2 мл; объем 10%-го раствора катализатора (FeCl3)1 мл, 2 мл, 3 мл; объем воды, соответственно, 17 мл, 16 мл, 15 мл; объем реакционной смеси 20 мл. Опыт №2. Зависимость скорости реакции от температуры. По результатам эксперимента необходимо определить энергию активации реакции (Еа) и температурный коэффициент скорости реакции (). Рекомендуемые рабочие температуры 20, 25, 35, 400С; объем реакционной смеси 20мл (2мл 7,5% раствора H2O2, 1мл 10% раствора FeCl3 и 17мл воды). По результатам опытов строим график в координатах lgk1/Т и вычисляем энергию активации реакции (по справочным данным без катализатора она составляет 7175 кДж/моль). Обработка результатов эксперимента: 1) результаты экспериментов записываем в таблицу по следующей форме: условия опыта: V(H2O2) = мл; V(H2O) = мл; V(FeCl3)= мл; t = 0C. Таблица 5 Экспериментальные данные по изучению зависимости скорости реакции от температуры
Максимальный объем кислорода, выделившийся при полном разложении перекиси обозначим V, а объем кислорода, выделившийся на данный момент времени V. 2) строим график зависимости VV, от времени () и по времени полупревращения убеждаемся, что исследуемая реакция действительно является реакцией первого порядка 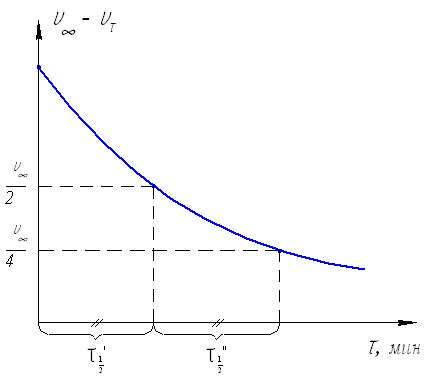 Рис.23. Определение порядка реакции по периоду полупревращения. Для этого по графику определяем значения двух смежных периодов полупревращения (1/2 и 1/2). Для реакции первого порядка их отношение должно равняться единице. Убедиться в протекании реакции по первому порядку можно и по другому. Для этого необходимо построить график зависимости lg(VV) от : 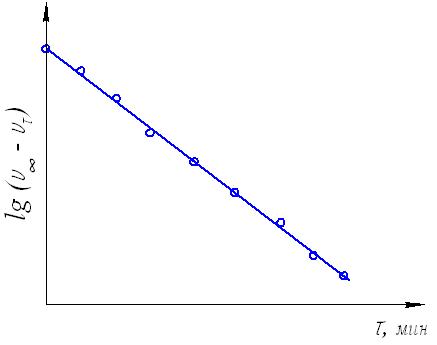 Рис.24. Графическое определение порядка реакции (для реакций первого порядка). Если все точки ложатся на одну прямую, значит это реакция первого порядка. 3) для различных моментов времени от начала реакции определяем значения констант скоростей реакции, пользуясь кинетическим уравнением реакции первого порядка: k = (1/) lg(a/(aх)) Величина «а»начальное количество (моль) или концентрация перекиси водорода, а разность (aх) количество (моль) или концентрация пероксида водорода, оставшегося на момент времени . Величина V предельный объем выделившегося кислорода, т.е. объем кислорода, соответствующий начальному количеству перекиси водорода, а разность (VV ) объем кислорода, который выделится при разложении количества H2O2, оставшегося в системе к моменту времени . Поэтому величина «а» в кинетическом уравнении реакции первого порядка может быть заменена пропорциональной ей величиной V, а вместо (aх) можно использовать (VV): k = (1/) lg(V/(VV)). 4) при каждой температуре рассчитываем среднее значение константы скорости kср = kn, строим зависимость lgkср = f(1/T) и графически определяем энергию активации реакции. 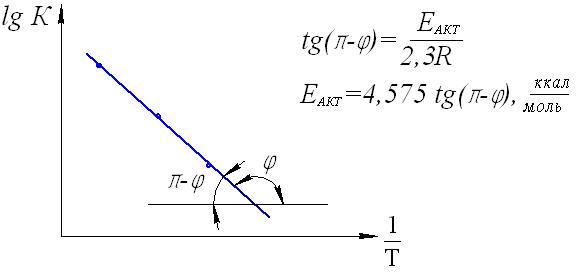 Рис.25. Графический расчет энергии активации Если константы скорости определены только для двух температур, то энергию активации (ккал/моль) вычисляем по формуле: Еа = 4,575 lg(k2/k1)T1T2/(T2T1) 5) определяем температурный коэффициент скорости реакции из выражения эмпирического закона Вант-Гоффа: kt2/kt1 = (t2t1)/10, откуда lg = lg(kt2/kt1)/((t2t1)/10). 6) определяем отношение констант скоростей реакции, проведенной в присутствии различных количеств катализатора и отношение объемов раствора хлорного железа, использованных в этих опытах: kv2,FeCl3/kv1,FeCl3 и V2,FeCl3 /V1,FeCl3. Эти значения должны совпадать: kv2,FeCl3/kv1,FeCl3 = V2,FeCl3 /V1,FeCl3, т.е. скорость гомогенной каталитической реакции разложения пероксида водорода прямо пропорциональна концентрации катализатора Лабораторная работа №4. Состояние химического равновесия Опыт №1. Определение константы равновесия и теплового эффекта реакции. Изучаем равновесную реакцию 2FeCl3 + 2KI 2FeCl2 + I2 + 2KCl, которая в ионном виде будет выглядеть следующим образом: 2Fe3+ + 2I 2Fe2+ + I2. Запишем выражение константы равновесия: Кр = ([Fe2+]2[I2])/([Fe3+]2[I1]2) Ход работы: 1) взять четыре сухие колбы емкостью по 100 мл, пронумеровать. Налить в них следующие объемы 0,03 М раствора FeCl3 и 0,03 М раствора KI с известными титрами, как указано в таблице 6 и поместить колбы на 30 минут в водяной термостат, имеющий температуру 250С; Таблица 6 Рекомендуемые объемы растворов реагентов
2) приготовить восемь конических колб для титрования объемом по 100мл; в каждую налить по 3550 мл дистиллированной воды и поставить их для охлаждения на лед. Слить вместе содержимое колб 1 и 2, а через 10 минут после этого содержимое колб 3 и 4. Отметить момент сливания по часам. Колбы плотно закрыть пробками и установить в термостат; 3) через 25 минут после смешения, из каждой колбы, не вынимая их из термостата, отобрать пипеткой по 15 мл раствора и слить в охлажденную колбу (охлаждение для прекращения реакции) для титрования. Временем отбора пробы считать момент сливания раствора из пипетки в колбу для титрования (отмечать с точностью до одной минуты); 4) сразу после отбора пробы выделившийся йод титруют 0,015 М раствором тиосульфата натрия (Na2S2O3) с известным титром. Тиосульфат прибавлять до появления бледно-желтой окраски; 5) добавить несколько капель раствора крахмала и титровать раствором тиосульфата до исчезновения синей окраски (светло-синяя окраска, появляющаяся через некоторое время после титрования, не учитывается). При титровании происходит следующая реакция: I2 + 2Na2S2O3 Na2S4O6 + 2NaI 6) через 30 минут после отбора пробы из каждой колбы взять по 15 мл раствора и титровать тиосульфатом. Через 40 минут отобрать третью пробу и т. д. Один и тот же объем тиосульфата, пошедший на титрование йода в двух последовательно взятых пробах из каждой колбы, указывает на достижение равновесия реакции. Расчет проводим следующим образом: а) концентрация йода в состоянии равновесия составит C(I2) = C(Na2S2O3) 0,5 (V1/V2), где C(Na2S2O3) молярная концентрация раствора тиосульфата; V1 объем его раствора, израсходованный на титрование йода в момент равновесия, мл; V2 объем взятой пробы, мл; б) концентрация ионов Fe2+ будет рана удвоенной концентрации йода, так как по уравнению реакции образуется одна молекула йода и два иона Fe2+: C(Fe2+) = 2C(I2); в) концентрация ионов Fe3+ равна разности их начальной концентрации и равновесной концентрации ионов Fe2+, т.к. из уравнения реакции следует, что прирост концентрации Fe2+ равен убыли концентрации ионов Fe3+: C(Fe3+) = C(FeCl3) C(Fe2+) или C(Fe3+) = C(FeCl3) 2C(I2). Концентрация треххлористого железа вычисляется из молярной концентрации исходного раствора и степени его разбавления при смешении раствора: C(FeCl3) = C0(FeCl3) а/(а+в), где C0(FeCl3) начальная концентрация раствора треххлористого железа; а и в соответственно, объемы растворов FeCl3 и KI, взятых для проведения реакции; г) концентрация ионов I вычисляется аналогично расчету концентрации раствора треххлористого железа: C(I) = C(KI) 2C(I2), C(KI) = C0(KI) в/(а+в), где C0(KI)молярность исходного раствора. В такой же последовательности проводим опыт при другой температуре (например, при 400С). Расчет значения Кр проводим отдельно для двух растворов при двух температурах. Экспериментальные и расчетные данные сводим в таблицы: Таблица 7 Экспериментальные данные последовательных титрований проб реакционной смеси
Таблица 8 Расчетные данные для вычисления константы равновесия | Колба 1 Колба 2
Опыт №2. Влияние изменения концентрации на состояние химического равновесия. Классическим примером обратимой реакции является взаимодействие хлорида трехвалентного железа с роданидом калия: FeCl3 + 3KSCN Fe(SCN)3 + 3KCl Образующийся роданид железа окрашивает раствор в красный цвет, интенсивность которого зависит от его концентрации. По изменению окраски раствора можно судить о смещении равновесия в ту или иную сторону. Ход работы: 1) в мерный стаканчик или цилиндр налить 2025 мл дистиллированной воды и добавить одну каплю насыщенного раствора хлорида железа и одну каплю насыщенного раствора роданида калия. Реакция проходит практически мгновенно. Полученный окрашенный раствор разлить в четыре пробирки поровну. Одну из пробирок оставить в качестве контрольной. В трех других будем смещать равновесие путем изменения концентраций веществ реакционной системы; 2) в одну из трех пробирок вносим одну каплю насыщенного раствора хлорида железа. Что наблюдается? Отметить изменение окраски раствора, сравнивая с контрольной пробиркой; 3) во вторую пробирку добавляем одну каплю насыщенного раствора роданида калия. Что наблюдается? Заметить, что цвет раствора в этой пробирке более насыщенный, чем в предыдущей. Чем объяснить, что изменение концентрации роданида калия вызывает более эффективное смещение равновесия, чем изменение концентрации хлорида железа? 4) в третью пробирку добавить кристаллический хлорид калия и несколько раз встряхнуть. Отметить изменение окраски раствора в этом случае. Записать уравнение константы равновесия. Сделать выводы о влиянии изменения концентраций веществ на состояние химического равновесия на основании выражения константы равновесия и принципа Ле-Шателье. Опыт №3. Влияние изменения температуры на состояние химического равновесия. Прибор, показанный на рисунке, наполняется двуокисью азота. Известно, что при температуре выше 1400С этот газ состоит только из молекул NO2, а при более низких температурах происходит частичная полимеризация (в данном случае димеризация): 2NO2 N2O4 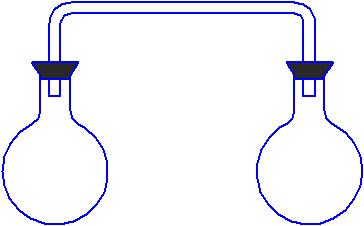 Рис.26. Прибор для наблюдения смещения равновесия Диоксид азота газ бурого цвета, а N2O4 бесцветный. Поэтому по изменению окраски смеси можно судить о смещении равновесия в системе. Смесь этих веществ будет окрашена в зависимости от их относительных количеств в цвета от бледно-желтого до бурого. Ход работы: а) одну из колб прибора поместить в стакан с теплой водой, другуюв сосуд с холодной водой или со смесью льда с солью. Наблюдать изменение цвета газовой смеси в колбах. В какую сторону смещается равновесие в каждой из колб? б) вынуть колбы из стаканов. Как изменяется окраска газовой смеси в этом случае? Объяснить наблюдаемые явления, основываясь на принципе Ле-Шателье. Заключение Тремя китами, на которые опирается современная химия, являются строение вещества, термодинамика и кинетика это положение, высказанное Дж.Д. Берналом в середине 20-го века, вряд ли изменится со временем. Химическая кинетика наука о химическом процессе, закономерностях протекания этого процесса во времени и его механизме, т.е. о деталях взаимодействия реагирующих частиц (молекул, ионов, радикалов, атомов). Зная механизм реакции, ею можно управлять, что позволяет: интенсифицировать протекание полезных процессов или понижать скорость нежелательных превращений; повышать выход целевых продуктов реакции и подавлять образование других соединений; выбирать экономически наиболее обоснованные схемы производства. Таким образом, кинетика как раздел химической науки непосредственно связана с задачами промышленного химического производства. Кинетические методы описания протекающих во времени процессов используют не только в химии, но и в других областях знаний: физике, биологии, медицине, металлургии, в текстильной, целлюлозо-бумажной, парфюмерной, пищевой промышленности. Например, в медицине в онкологии рост ряда опухолей описывают экспоненциальной функцией. В токсикологии и фармакологии используют кинетический показатель «время полувыведения» t0,5 аналог времени полупревращения в химической кинетике. На основе этой величины определяют дозировку и частоту приема лекарств: очередной прием препарата проводят через определенные промежутки времени при уменьшении его концентрации ( в 1,5; 2 или 3 раза). В микробиологии рост числа микроорганизмов описывают в терминах, аналогичных терминам кинетики автокаталитических реакций. Начальный период – «лаг-фаза» время, в течение которого рост числа микроорганизмов, вносимых в питательную среду, не наблюдается (период индукции); «лог-фазой» называют период экспоненциального роста числа микроорганизмов (аналогично периоду протекания самоускоряющейся реакции). «Стат-фаза» последующий период постоянства числа (концентрации) микроорганизмов. В окружающей нас среде постоянно присутствуют токсические вещества различного происхождения. Их количество, поступающее в организм в течение определенного промежутка времени, определяет концентрацию экотоксина в живом организме, Сорг : Wi = Wг + Wв + Wп = k Сорг 0,7Сорг /t0,5, где Wi потоки экотоксина, поступающие в организм с вдыхаемым воздухом (газ), с потребляемой водой и пищей. Используются кинетические приемы и в экономике, и в финансовой сфере. Поток денежной массы, направленный на ее увеличение, та же самоускоряющаяся реакция. Аналогично последовательной химической реакции в прохождении финансового потока имеется лимитирующая стадия, на ускорение прохождения которой направляются усилия. Перечень такого рода примеров можно было бы продолжить. Метод описания тех или иных явлений, изменений каких-либо свойств во времени дифференциальными уравнениями универсален. Впервые использованный в механике, этот метод с середины 19 века стал широко применяться в химии, а впоследствии приемы и термины химической кинетики перешли и в другие науки. |
