Вступительные (9-17). 8. Способы регулирования молекулярной массы синтезируемого полимера. Понятие регулятора, ингибитора, замедлителя и стопера радикальной полимеризации и механизм их действия
 Скачать 446.69 Kb. Скачать 446.69 Kb.
|
|
8. Способы регулирования молекулярной массы синтезируемого полимера. Понятие регулятора, ингибитора, замедлителя и стопера радикальной полимеризации и механизм их действия. Молекулярная масса полимеров зависит от основных параметров реакции (продолжительность, концентрация, способ получения полимеров, соотношение мономеров, наличие монофункционального реагента. Регуляторы - соединения, с помощью которых можно уменьшать (регулировать) молекулярные массы образующихся полимеров. Для регулирования процесса полимеризации применяют ингибиторы и замедлители полимеризации. Ингибиторы – низкомолекулярные вещества, которые меняют длительность индукционного периода, замедляя его. Это часто необходимо делать в технологии производства полимеров для предотвращения преждевременной полимеризации в неконтролируемых условиях. Ингибиторы: хиноны, ароматические амины, нитросоединения, фенолы, органические соли и т.д. 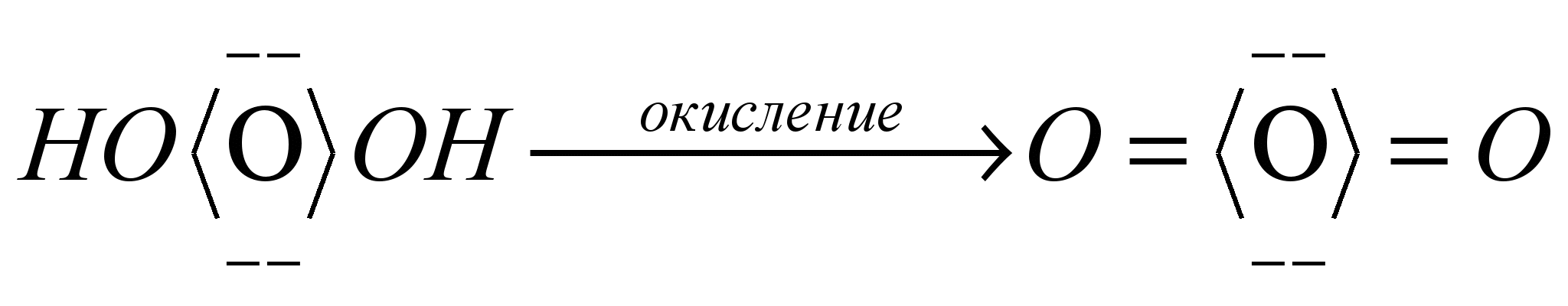 Гидрохинон взаимодействует со свободными радикалами, превращая их в неактивные продукты. Гибель радикалов увеличивает длину индукционного периода. Наряду с ингибиторами, позволяющими полностью остановить полимеризацию, существуют замедлители полимеризации, которые только уменьшают её скорость. Замедлитель выполняет двойную роль: снижает концентрацию радикалов и уменьшает время их жизни, что приводит к снижению длины полимерной цепи. Ингибитор не влияет на скорость полимеризации, но предотвращает начало инициирования цепи, увеличивая индукционный период на кинетической кривой полимеризации. Длительность индукционного периода обычно пропорциональна количеству введенного ингибитора. Одно и то же вещество может выступать и как ингибитор, и как замедлитель, и как регулятор полимеризации в зависимости от природы полимеризуемого мономера. Например, кислород, который замедляет полимеризацию винилацетата и ускоряет полимеризацию стирола. Кроме регуляторов для предотвращения образования структурированного полимера с чрезмерно высокой молекулярной массой применяют стопперы. В качестве стопперов применяют гидрохинон, тетраметилтиурамдисульфид, полисульфид натрия. 9. Кинетика радикальной полимеризации, скорость общей реакции и составляющих ее стадий. Кинетическая кривая полимеризации и ее анализ. Влияние различных факторов на скорость радикальной полимеризации. На кинетике реакции полимеризации и свойствах образующегося полимера отражается множество факторов: вязкость среды (иммобилизация растущих цепей из-за гель-эффекта или образовании нерастворимого полимера), температура, давление, активность мономера, способ инициирования, способ проведения полимеризации, наличие примесей и т.д. Общее кинетическое уравнение полимеризации может быть выведено без учета реакций передачи цепи. Если допустить, что активность макрорадикала не зависит от его длины и мономер расходуется только на стадиях инициирования и роста цепи, то скорость полимеризации (или скорость расходования мономера) можно описать уравнением:  , ,где 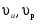 - скорости инициирования и роста. Расход мономера на стадии инициировании гораздо меньше, чем при росте цепи, поэтому можно пренебречь первым членом уравнения и скорость полимеризации представить как сумму многих отдельных последовательных реакций роста. А так как kр = const для этого множества реакций, то можно записать: - скорости инициирования и роста. Расход мономера на стадии инициировании гораздо меньше, чем при росте цепи, поэтому можно пренебречь первым членом уравнения и скорость полимеризации представить как сумму многих отдельных последовательных реакций роста. А так как kр = const для этого множества реакций, то можно записать: Концентрацию радикалов, которую трудно измерить, можно исключить из рассмотрения, используя принцип стационарности. Согласно этому принципу, концентрация радикалов при полимеризации достигает небольшой постоянной величины, когда 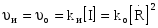 и и  Тогда можно записать для стационарного участка процесса полимеризации: 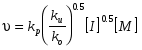 Из уравнения (применяемого на начальных стадиях) следует, что скорость полимеризации увеличится в  раз при удвоении скорости инициирования, это объясняется бимолекулярностью реакций обрыва. Пропорциональность скорости полимеризации от концентрации мономера выполняется не всегда и, как правило, степень больше 1, что связано с участием мономера на стадии инициирования и в реакциях передачи цепи. раз при удвоении скорости инициирования, это объясняется бимолекулярностью реакций обрыва. Пропорциональность скорости полимеризации от концентрации мономера выполняется не всегда и, как правило, степень больше 1, что связано с участием мономера на стадии инициирования и в реакциях передачи цепи.Степень полимеризации также может являться характеристикой процесса полимеризации. Длина кинетической цепи (т.е. количество присоединившихся молекул мономера, приходящееся на один образовавшийся активный центр) можно найти из соотношения скорости полимеризации к скорости инициирования (или обрыва на стационарном участке):  Средняя степень полимеризации при рекомбинационном обрыве цепи равна:  , ,а при диспропорционировании:  . .Во многих случаях встречаются оба эти два варианта обрыва цепи:  , ,где - доля макрорадикалов, обрывающих цепь по механизму диспропорционирования, а (1-) - доля макрорадикалов, гибнущих при рекомбинации. Т.е. увеличение концентрации радикалов и, следовательно, скорости радикальной полимеризации приводит к образованию макромолекул меньшей молекулярной массы. Длина кинетической цепи при Т=const определяется природой мономера и не зависит от способа инициирования, а также от природы инициатора. С учетом реакций передачи цепи: 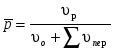 где 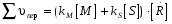 , ,выражая концентрацию радикала через скорость полимеризации 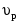 и используя константы передачи на мономер и растворитель, получаем: и используя константы передачи на мономер и растворитель, получаем: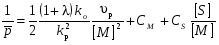 . .Если проводить полимеризацию в присутствии разных количеств инициатора и определить значения 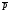 и и 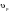 , то, используя (как правило линейную) зависимость , то, используя (как правило линейную) зависимость 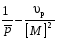 , можно определить значения константы СМ, а также отношение констант обрыва и роста. Например, отношение , можно определить значения константы СМ, а также отношение констант обрыва и роста. Например, отношение 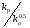 , определяющее скорость полимеризации различных мономеров при [M]=const, [I]=const при 60С для полимеризующегося с высокой скоростью винилацетата равна 0.33, а для стирола 0.022. , определяющее скорость полимеризации различных мономеров при [M]=const, [I]=const при 60С для полимеризующегося с высокой скоростью винилацетата равна 0.33, а для стирола 0.022.Факторы, влияющие на полимеризацию а) влияние температуры и давления на радикальную полимеризацию Известно, что повышение температуры приводит к увеличению констант скоростей всех элементарных стадий процесса полимеризации. Оно оказывает существенное влияние на стадию инициирования, поскольку ее энергия активации является наибольшей по сравнению с другими стадиями. б) влияние концентрации инициатора Как уже отмечалось ранее, зависимость скорости полимеризации и молекулярной массы полимера от концентрации инициатора определяется «правилом квадратного корня». Чем больше концентрация инициатора, тем выше скорость полимеризации, но ниже молекулярная масса образующегося полимера. в) влияние концентрации мономера Установлено, что с увеличением концентрации мономера повышается скорость полимеризации и увеличивается средняя степень полимеризации. г) зависимость скорости полимеризации от времени. Гель-эффект. При полимеризации вязкость системы изменяется на несколько порядков. Когда она возрастает, возрастает и скорость реакции. Этот эффект получил название гель-эффекта. Обычно он проявляется при полимеризации мономера в массе или в виде концентрированного раствора и особенно характерен для полимеризации метилметакрилата. Природу гель-эффекта объясняют тем, что в высоковязких средах заметно уменьшается подвижность макрорадикалов, тогда как подвижность молекул мономера вплоть до стеклования системы изменяется мало. В результате уменьшаются частота столкновения радикалов и скорость бимолекулярного обрыва. Следовательно, увеличиваются среднее время жизни и стационарная концентрация радикалов и возрастают общая скорость и степень полимеризации. После стеклования системы на завершающей стадии полимеризации (80-95 %) скачкообразно уменьшается подвижность мономера, и реакция полимеризации останавливается Кинетическая кривая и ее анализ 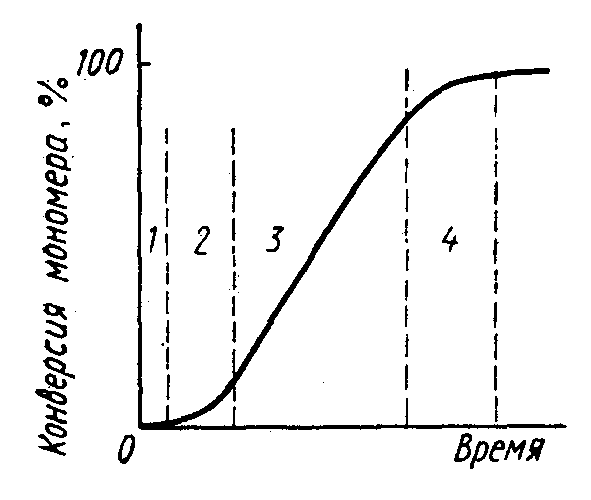 Как видно из рис. 1 на кривой можно выделить пять участков по значениям скоростей основной реакции превращения мономера в полимер в результате полимеризации: 1 – участок ингибирования, где концентрация свободных радикалов мала. И они не могут начать цепной процесс полимеризации; 2 – участок ускорения полимеризации, где начинается основная реакция превращения мономера в полимер, причем скорость растет; 3 – участок стационарного состояния, где происходит полимеризация основного количества мономера при постоянной скорости (прямолинейная зависимость конверсии от времени); 4 – участок замедления реакции, где скорость реакции уменьшается в связи с убылью содержания свободного мономера; 5 –прекращение основной реакции после исчерпания всего количества мономера. 10. Ионная (каталитическая) полимеризация. Катионная полимеризация, каталитические системы и механизм реакций, ее преимущества и недостатки. Анионная полимеризация, катализаторы и механизм реакции. ИОННАЯ ПОЛИМЕРИЗАЦИЯ Ионная полимеризация - это цепной процесс, в котором присоединение мономера к растущим цепям происходит гетеролитически. Активными центрами на концах цепей являются ионы, образующие с противоионами пару, которые генерируются под действием катализаторов или ионизирующих излучений. Степень разделения компонентов ионной пары может быть различна. Обычно выделяют три характерных случая:
Каждая из этих форм активного центра существенно отличается по активности. Поэтому для ионной полимеризации характерно большее влияние природы реакционной среды на скорость процесса и структуру образующегося полимера, так как в системе могут сосуществовать ионные центры различного типа, причем их соотношение изменяется при изменеии температуры. При изменении диссоциирующей и сольватирующей способности среды процессы ионной полимеризации осложняются различными сопутствующими эффектами (изомеризацией, димеризацией, образованием нестереорегулярного полимера и др.). Влияние механизма полимеризации стирола на скорость роста цепи (при 298К)
Внедрение мономера в растущую полимерную цепь осуществляется между заряженным концом растущей макроцепи и противоионом, при этом могут создаваться условия способствующие упорядочению структуры полимера. Ионная полимеризация протекает через последовательные элементарные стадии инициирования, роста цепи, передачи и обрыва цепи. Особенностью ионных полимеризационных процессов является малая вероятность кинетического обрыва цепи, поэтому растущие цепи сохраняют активность и после исчерпания мономера. Такие цепи называют “живыми”. Этот эффект используют для получения блок-сополимеров. Значения энергий активации ионной полимеризации значительно ниже по сравнению с радикальной полимеризацией, поэтому они проводятся при низких температурах, часто отрицательных, так как при понижении температуры увеличивается устойчивость ионых пар. Существенный характер имеет выбор растворителя. Нужен растворитель, который обладает хорошей сольватирующей способностью, не замерзает при понижении температуры, а также не реагирует с катализаторами ионной полимеризации. Наиболее подходящими растворителями, отвечающими этим требованиям, являются: CH3Cl хлористый метил, C5H12 пентан, Ph-NO2 нитробензол и некоторые другие. В таких растворителях при увеличении сольватирующей способности увеличивается расстояние между ионами в ионной паре, а следовательно изменяется активность центра полимеризации. Изменяя природу иона или противоиона в гетерополярном инициаторе, можно направить его действие на раскрытие определенных связей в мономере С=С, С=О, С=N, эпоксидных циклов и т.д. В том числе ионоактивные инициаторы способны инициировать полимеризацию мономеров, не полимеризующихся по радикальному механизму (гомологи этилена, диены, гетероциклические соединения). Решающее значение имеет химическое строение мономера. Винильные мономеры с электронодонорными заместителями (изобутилен, виниловые эфиры) полимеризуются по катионному механизму, а с электроноакцепторными (акрилонитрил, акрилаты) по анионному. Стирол полимеризуется по различным механизмам, так как за счет сопряжения с кольцом могут стабилизироваться и положительные, и отрицательные, и радикальные центры. Ионная полимеризация хуже изучена, чем радикальная. Нет единой кинетической схемы и каждый случай описывается своими особенностями кинетики. КАТИОННАЯ ПОЛИМЕРИЗАЦИЯ Впервые осуществил Бутлеров в 1877 году полимеризацию изобутилена в присутствии серной кислоты. Активный центр: растущая цепь имеет положительный заряд - карбокатион. Мономеры: производные этилена с электронодонорными заместителями, карбонильные гетероциклические соединения, нитрилы. Для ряда мономеров полимеризация возможна лишь по катионному механизму (изобутилен, триоксан, тетрагидрофуран). Способность винилового мономера к реакциям роста по катионному механизму зависит от степени нуклеофильности двойной связи и возможности образования нуклеофильными группами мономера необратимых комплексов с электрофильными агентами (катионом или кислотой Льюиса). Катализаторы: - протонные кислоты: HClO4, H2SO4, H3PO4, HCl и др.; - апротонные кислоты (кислоты Льюиса, катализаторы Фриделя-Крафтса), относящихся обычно к группе координационно-ненасыщенных солей металлов, т. е. MeXn (где Me - металл, X - чаще всего галоген): BF3, AlCl3, SnCl4, TiCl4, FeCl3 и др. Активны в присутствии сокатализаторов - галогеналкилов, воды, спиртов и других соединений, являющихся донорами ионов водорода. Также под воздействием излучений высокой энергии и ряда других реагентов: карбениевых Ph3C+, оксониевых R3O+ солей с комплексным противоионом ([SbCl6], [PF6]), алкилпроизводных металлов ZnR2, AlR3, галогенов и межгалогенных соединений: I2, ICl, IBr. Активность катализаторов может быть разная - например, полимеризация изобутилена в присутствии BF3 происходит со взрывом, с AlBr3 за несколько минут, а с TiCl4 в течение часов. Реакция инициирования заключается во взаимодействии катиона с мономером. В простейших, но довольно редких случаях, катионы получают при диссоциации катализатора, например: HClO4 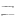 H + ClO4, но гораздо чаще в результате диссоциации комплекса катализатора и сокатализатора: H + ClO4, но гораздо чаще в результате диссоциации комплекса катализатора и сокатализатора:   . .Затем при взаимодействии с мономером катионы смещают на себя электронную плотность -связи с последующим образованием -связи катиона с -углеродным атомом мономера (по отношению к заместителю): 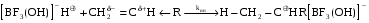 |
