ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ
|
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ
|
1.Прочитайте текст задачи.
|
Определите объём (н.у.) оксида азота (II), образовавшегося при окислении 100 г аммиака в присутствии платинового катализатора, если выход продукта реакции составляет 85%
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений.
|
 2.Дано: 2.Дано:
m (NH3) = 100 г
η (NO) = 85% = 0,85
 
V (NO) = ?
|
3.Запишите уравнение реакции
|
3.Решение:
4NH3 + O2 → 4NO + 6H2O
|
4. Над формулами соответствующих веществ запишите то, что дано в условии задачи, и то, что надо найти
|
100 г х л
4NH3 + O2 → 4NO + 6H2O
|
5. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (массу аммиака и объём оксида азот (П)
|
Mr (NH3) = Ar(N) + 3Ar(H) = 14 + 3 · 1 = 17
M (NH3) = 17 г/моль
m (NH3) = 4 моль · 17 г/моль = 68 г
V (NO) = ν (NO) · Vm = 4 моль · 22,4 л/моль = 89,6 л
100 г х л
4NH3 + O2 → 4NO + 6H2O
68 г 89,6 л
|
6. Составьте пропорции и определите теоретически возможный объём оксида азота (П)
|
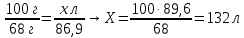
|
7. По формуле находим практический объём оксида азота (П)
|
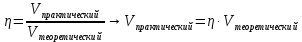
Vпрактический = 0,85 · 132 л = 112,2 л
|
8.Запишите ответ.
|
Ответ: Vпрактический (NO) = 112,2 л
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ
|
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ
|
1.Прочитайте текст задачи.
|
Определите массу соли, образующейся при взаимодействии 10 г гидроксида натрия и 10 г азотной кислоты
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений.
|
 2.Дано: 2.Дано:
m (NaOH) = 10 г
m(HNO3) = 10 г
 
m (NaNO3) = ?
|
3.Запишите уравнение реакции
|
3.Решение:
NaOH + HNO3 = NaNO3 + H2O
|
4. Вычислить молярные массы веществ
|
Mr(NaOH) = Ar(Na) + Ar(O) + Ar(H) = 23 + 16 + 1 = 40
M(NaOH) = 40 г/моль
Mr(HNO3) = Ar(H) + Ar(N) + 3Ar(O) = 1 + 14 + 3 · 16 = 63
M(HNO3) = 63 г/моль
Mr (NaNO3) = Ar(Na) + Ar(N) + 3Ar(O) = 23 + 14 + 3 · 16 = 85
M (NaNO3) = 85 г/моль
|
5. Определим, какое вещество дано в избытке, какое – в недостатке по формуле 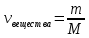
|
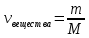
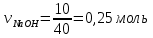 (избыток) (избыток)
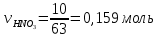 (недостаток) (недостаток)
0,25 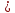 0,159, следовательно азотная кислота дана в недостатке 0,159, следовательно азотная кислота дана в недостатке
|
6. Расчёты производим по веществу, которое дано в недостатке
|
|
метод пропорций
|
7. Над формулами соответствующих веществ запишите то, что дано в условии задачи (над веществом, данным в недостатке), и то, что надо найти
|
10 г Х г
NaOH + HNO3 = NaNO3 + H2O
|
8. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (массу азотной кислоты и нитрата натрия)
|
m(HNO3) = ν · M = 1 моль · 63 г/моль = 63 г
m(NaNO3) = ν · M = 1 моль · 85 г/моль = 85 г
10 г Х г
NaOH + HNO3 = NaNO3 + H2O
63 г 85 г
|
9. Составьте пропорции и определите массу соли
|
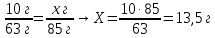
|
количественный метод
|
Выполняем пункты 1 - 6
|
|
7. Над формулами соответствующих веществ запишите то, что дано в условии задачи (над веществом, данным в недостатке), и то, что надо найти
|
0,159 моль Х г
NaOH + HNO3 = NaNO3 + H2O
|
8. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (количество азотной кислоты и массу нитрата натрия)
|
0,159 моль Х г
NaOH + HNO3 = NaNO3 + H2O
1 моль 85 г
|
9. Составьте пропорции и определите массу соли
|
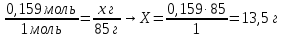
|
10.Запишите ответ.
|
Ответ: m(NaNO3) = 13,5 г
|
 Скачать 267.71 Kb.
Скачать 267.71 Kb.