ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ
|
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ
|
1.Прочитайте текст задачи.
|
При сгорании 8,6 г бескислородного углеводорода образовалось 26,4 г оксида углерода (IV) и 12,6 г воды. Плотность углеводорода по воздуху равна 2,966. Определите молекулярную формулу углеводорода.
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений.
|
 2.Дано: 2.Дано:
m (CO2) = 26,4 г
m(H2O) = 12,6 г
m(вещества) = 8,6 г
Dвозд. = 2,966
 
СхHy = ?
|
3.Запишите уравнение реакции
|
3.Решение:
CxHy + O2 = CO2 + H2O
|
4. Вычислить молярные массы веществ
|
Mr(CO2) = Ar(C) + 2Ar(O) = 12 + 2 · 16 = 44
M(CO2) = 44 г/моль
Mr(H2O) = 2Ar(H) + Ar(O) = 2 · 1 + 16 = 18
M(H2O) = 18 г/моль
|
5. Определим, сколько грамм углерода содержится в 26,4 г углекислого газа
|
44 г CO2 содержит 12 г С
26,4 г CO2 содержит Х г С
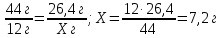
|
6. Определим, сколько грамм водорода содержится в 12,6 г воды
|
18 г H2O содержит 2 г Н
12,6 г H2O содержит Y г H
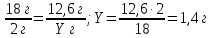
|
7. Находим количество вещества углерода и водорода
|
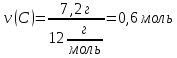
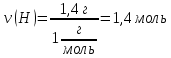
|
8. Составляем пропорцию
|
Х : Y = 0,6 : 1,4
|
9. Избавляемся от десятичной дроби, умножив на 10
|
Х : Y = 6 : 14
|
10. Записать предполагаемую формулу вещества
|
С6H14
|
11. Рассчитать молярную массу предполагаемого вещества
|
Mr(С6H14) = 6Ar(C) + 14Ar(Н) = 6 · 12 + 14 · 1 = 86
M(С6H14) = 86 г/моль
|
12. Рассчитать молярную массу вещества по плотности воздуха
|
М(вещества) = Dвозд. · 29 = 2,966 · 29 = 86 г/моль
|
13. Сравнить полученные результаты
|
М(вещества) = M(С6H14)
86 г/моль = 86 г/моль
|
14. Записать ответ
|
Ответ: формула вещества С6H14
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ
|
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ
|
1.Прочитайте текст задачи.
|
Определите массовую долю примесей в техническом образце карбида кальция, если из 200 г его получили 56 л ацетилена.
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений.
|
 2.Дано: 2.Дано:
m (CaC2) = 200 г
V (C2H2) = 56 л
 
ωпримесей = ?
|
3.Запишите уравнение реакции
|
3.Решение:
CaC2 + 2Н2О = С2Н2 + Са(ОН)2
|
4. Пусть Х – масса чистого карбида кальция. Над формулой ацетилена запишите то, что дано в условии задачи
|
Х г 56 л
CaC2 + 2Н2О = С2Н2 + Са(ОН)2
|
5. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (массу аммиака и объём оксида азот (П)
|
Mr (CaC2) = Ar(Ca) + 2Ar(C) = 40 + 2 · 12 = 64
M (CaC2) = 64 г/моль
m (CaC2) = 1 моль · 64 г/моль = 64 г
V (С2Н2) = ν (С2Н2) · Vm = 1 моль · 22,4 л/моль = 22,4 л
Х г 56 л
CaC2 + 2Н2О = С2Н2 + Са(ОН)2
64 г 22,4 л
|
6. Составьте пропорции и определите практическую массу карбида кальция
.
|
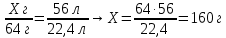
|
7. Определяем массу примесей
|
m(примесей) = 200 г – 160 г = 40 г
|
8. Определяем массовую долю примесей
|
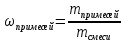
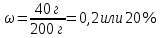
|
9.Запишите ответ.
|
Ответ: 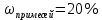
|
 Скачать 267.71 Kb.
Скачать 267.71 Kb.