ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ
|
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ
|
1.Прочитайте текст задачи.
|
Определите формулу мирабилита, являющегося кристаллогидратом сульфата натрия, если после прокаливания навески массой 193,2 г она стала весить 85,2 г.
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений.
|
 2.Дано: 2.Дано:
mкристаллогидрата = 193,2 г
mсоли = 85,2 г
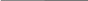 
Na2SO4 · X H2O = ?
|
3.Запишите уравнение реакции (прокаливание ведёт к испарению воды)
|
3.Решение:
Кристаллогидрат прокаливание сульфат натрия
  Na2SO4 · X H2O t0 Na2SO4 Na2SO4 · X H2O t0 Na2SO4
|
4. Над формулами записать, что известно по условию задачи
|
193,2 г 85,2 г
Na2SO4 · X H2O → Na2SO4
|
5. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (находим массу сульфата натрия). Масса кристаллогидрата неизвестна, принимаем за Х
|
Mr (Na2SO4) = 2Ar(Na) + Ar(S) + 4Ar(O) = 2 · 23 + 32 + 4 · 16 = 142
M (Na2SO4) = 142 г/моль
m (Na2SO4) = 1 моль · 142 г/моль = 142 г
193,2 г 85,2 г
Na2SO4 · X H2O → Na2SO4
Х г 142 г
|
6. Составьте пропорции и определите массу кристаллогидрата
.
|
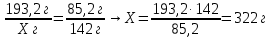
|
7. Вычислить массу воды, которая содержится в кристаллогидрате
|
m(воды) = m(кристаллогидрата) - m(сульфата натрия) = 322 – 142 = 180 г
Mr (H2O) = 2Ar(Н) + Ar(O) = 2 · 1 + 16 = 18
M (H2O) = 18 г/моль
|
8. Определить количество воды в кристаллогидрате
|
Mr (H2O) = 2Ar(Н) + Ar(O) = 2 · 1 + 16 = 18
M (H2O) = 18 г/моль
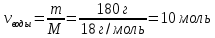
|
9. Запишите ответ.
|
Ответ: Na2SO4 · 10 H2O
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ
|
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ
|
1.Прочитайте текст задачи.
|
Рассчитайте количество водорода, выделившегося при взаимодействии 730 г 30%-ого раствора соляной кислоты с цинком.
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений.
|
 2.Дано: 2.Дано:
mраствора = 730 г
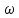 = 30% или 0,3 = 30% или 0,3
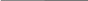 
ν (Н2) = ?
|
3.Запишите уравнение реакции
|
3.Решение:
Zn + 2HCl = ZnCl2 + H2↑
|
4. Пользуясь формулой, рассчитайте массу чистого вещества.
|
mвещ. = mраствора ·ω
m (HCl) = 730 г · 0,3 = 219 г
|
метод пропорций
|
5. Над формулами записать, что известно по условию задачи
|
219 г Х моль
Zn + 2HCl = ZnCl2 + H2↑
|
6. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (находим массу соляной кислоты и количество водорода, которое равно коэффициенту перед формулой водорода).
|
Mr (HCl) = Ar(H) + Ar(Cl) = 1 + 35,5 = 36,5
M (HCl) = 36,5 г/моль
m (HCl) = 2 моль · 36,5 г/моль = 73 г
219 г Х моль
Zn + 2HCl = ZnCl2 + H2↑
73 г 1моль
|
7. Составьте пропорции и определите количество водорода
.
|
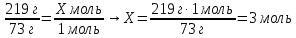
|
количественный метод
|
выполняем пункты 1 - 4
|
|
5. Рассчитать молярную массу соляной кислоты
|
Mr (HCl) = Ar(H) + Ar(Cl) = 1 + 35,5 = 36,5
M (HCl) = 36,5 г/моль
|
6. Рассчитать количество соляной кислоты
|
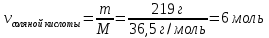
|
7. Над формулами записать, что известно по условию задачи и произведённых расчётов
|
6 моль Х моль
Zn + 2HCl = ZnCl2 + H2↑
|
8. Под формулами записываем, что следует из уравнения реакции (количество соляной кислоты и водорода, которые равны коэффициентам перед соответствующими формулами); составляем пропорцию
|
6 моль Х моль
Zn + 2HCl = ZnCl2 + H2↑
2 моль 1 моль
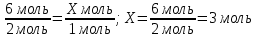
|
алгебраический способ
|
выполняем пункты 1 - 3
|
|
4. По формуле находим количество водорода
|
Zn + 2HCl = ZnCl2 + H2↑
2 моль 1 моль
ν (HCl) = 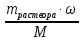
2 моль HCl – 1 моль H2, следовательно ν (H2) = 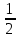 ν (HCl) ν (HCl)
|
5. Находим молярную массу соляной кислоты
|
Mr (HCl) = Ar(H) + Ar(Cl) = 1 + 35,5 = 36,5
M (HCl) = 36,5 г/моль
|
6. Подставляем в формулу величины, производим расчёт
|
ν (H2) = 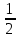 ν (HCl) = ν (HCl) = 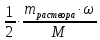
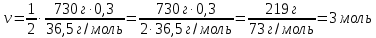
|
Запишите ответ.
|
Ответ: ν (Н2) = 3 моль
|
 Скачать 267.71 Kb.
Скачать 267.71 Kb.