ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ
|
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ
|
1.Прочитайте текст задачи.
|
При сжигании 6 г магния выделяется 152 кДж тепла. Составить термохимическое уравнение образования оксида магния.
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений.
|
 2.Дано: 2.Дано:
m (Mg) = 6 г
Q = 152 кДж
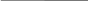 
ТХУ = ?
|
3.Запишите уравнение реакции
|
3.Решение:
2Mg + O2 = 2MgO + Х кДж
|
4. Над формулами записать, что известно по условию задачи
|
6 г 152 кДж
2Mg + O2 = 2MgO + Х кДж
|
5. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (находим массу магния).
|
Mr (Mg) = Ar(Mg) = 24
M (Mg) = 24 г/моль
m (Mg) = 2 моль · 24 г/моль = 48 г
6 г 152 кДж
2Mg + O2 = 2MgO + Х кДж
48 г
|
6. Составьте пропорции и определите количество выделившейся теплоты
.
|
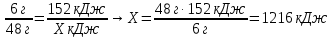
|
количественный метод
|
выполняем пункты 1 - 3
|
|
4. Рассчитать количество магния
|
Mr (Mg) = Ar(Mg) = 24
M (Mg) = 24 г/моль
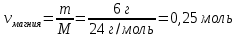
|
5. Над формулами записать известные величины и расчётное количество магния, под формулой количество магния по уравнению реакции (коэффициент перед формулой); составить и решить пропорцию
|
0,25 моль 152 кДж
2Mg + O2 = 2MgO + Х кДж
2 моль
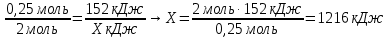
|
Запишите ответ.
|
Ответ: 2Mg + O2 = 2MgO + 1216 кДж
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ
|
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ
|
1.Прочитайте текст задачи.
|
Вычислить, какое количество теплоты выделится при сгорании 6,2 г фосфора. Термохимическое уравнение реакции горения фосфора: 4Р+5O2 = 2Р2O5+3010кДж.
|
2.Запишите условие и требование задачи с помощью общепринятых обозначений.
|
 2.Дано: 2.Дано:
m (Р) = 6,2 г
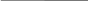 
Q = ?
|
3.Запишите уравнение реакции
|
3.Решение:
4Р+5O2 = 2Р2O5+3010кДж
|
4. Над формулами записать, что известно по условию задачи
|
6,2 г Х кДж
4Р+5O2 = 2Р2O5+3010кДж.
|
5. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (находим массу магния).
|
Mr (Р) = Ar(Р) = 31
M (Р) = 31 г/моль
m (Р) = 4 моль · 31 г/моль = 124 г
6,2 г Х кДж
4Р+5O2 = 2Р2O5+3010кДж.
124 г
|
6. Составьте пропорции и определите количество выделившейся теплоты
.
|
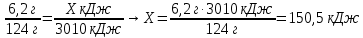
|
количественный метод
|
выполняем пункты 1 - 3
|
|
4. Рассчитать количество фосфора
|
Mr (Р) = Ar(Р) = 31
M (Р) = 31 г/моль
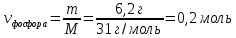
|
5. Над формулами записать известные величины и расчётное количество фосфора, под формулой количество фосфора по уравнению реакции (коэффициент перед формулой); составить и решить пропорцию
|
0,2 моль Х кДж
4Р+5O2 = 2Р2O5+3010кДж.
4 моль
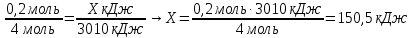
|
Запишите ответ.
|
Ответ: Q = 150,5 кДж
|
 Скачать 267.71 Kb.
Скачать 267.71 Kb.