Монография исследование водорослей.. Во́доросли. Аутентичного материала
 Скачать 2.99 Mb. Скачать 2.99 Mb.
|
|
Характеристики хлоропластов водорослей
Хлоропласты содержат сильно редуцированную кольцевую ДНК, происходящую из нуклеоида эндосимбиотической цианобак-терии, у хлорарахниофитов и криптомонад в хлоропласте имеется также нуклеоморф. Жгутики водорослей имеют единый план строения. Снаружи они покрыты жгутиковой мембраной, внутри находится пучок белковых микротрубочек в виде кольца (9 пар), в центре которого расположены две одинарные микротрубочки. В основании жгутика находится короткоцилиндрическое базальное тело, погруженное в поверхностные слои цитоплазмы. Число жгутиков варьирует у разных представителей, может быть представлено 1, 2 или многими жгутиками. Место прикрепления терминальное (к концу клетки) или латеральное (сбоку клетки). С помощью жгутика клетка передвигается в среде. У Ochrophyta один жгутик простой, второй — с мастигонемами. У Rhodophyta жгутики отсутствуют. Размножение и циклы развития У водорослей встречается вегетативное, бесполое и половое размножение. Вегетативное размножение может осуществляться как простым разделением многоклеточного организма (фрагменты нитей Spirogyra (спирогира)) или колонии (Synura) на несколько частей, так и при помощи специализированных органов. Например, бурые водоросли из порядка сфацеляриевых имеют для этой цели специальные выводковые веточки, а водоросли из порядка харовых — клубеньки на ризоидах. Бесполое размножение водорослей осуществляется при помощи подвижных зооспор или неподвижных апланоспор. При этом протопласт клетки-спорангия делится на части и продукты деления выходят из её оболочки. Особь, на которой формируются спорангии, называют спорофитом. Часто подвижные или неподвижные споры имеют специальные названия. Например, апланоспоры, приобретающие форму материнской клетки, находясь внутри неё, называются автоспорами[en], а если апланоспора одевается толстой оболочкой и впадает в состояние покоя, то это гипноспора; зооспоры, утратившие жгутики, но сохранившие сократительные вакуоли и глазок, будут называться гемизооспорами. Половое размножение. При половом размножении происходит попарное слияние гаплоидных клеток с образованием диплоидной зиготы. У водорослей есть несколько вариантов полового процесса: изогамия — слияние двух одинаковых по форме и размеру подвижных гамет; гетерогамия — слияние двух подвижных гамет одинаковых по форме, но разных по размеру; оогамия — слияние крупной неподвижной яйцеклетки с мелким подвижным сперматозоидом. Клетки, в которых образуются гаметы, называются гаметангии, а сами растения с гаметангиями — гаметофитами. Гаметангии бывают двух типов: образующие многочисленные сперматозоиды — антеридии и образующие одну или несколько яйцеклеток оогонии. Также половое размножение в некоторых группах водорослей может осуществляться и без образования гамет. Например, если сливаются две подвижные одноклеточные водоросли, то это хологамия; слияние протопластов двух неподвижных гаплоидных вегетативных клеток с образованием зиготы — конъюгация. Если гаметофиты и спорофиты в жизненном цикле водоросли имеют выраженные морфологические различия, то это называется гетероморфная смена форм развития, а если они морфологически не отличаются, то изоморфная смена форм развития. Также гаметофиты могут быть однодомными (обоеполыми) — на одной особи развиваются и мужские, и женские гаметы, или двудомными (раздельнополыми) — мужские гаметы — на одних особях, а женские — на других[2]. Экологические группы водорослей Мелкие свободноплавающие водоросли входят в состав планктона и, развиваясь в больших количествах, вызывают «цветение» (окрашивание) воды. Бентосные водоросли прикрепляются ко дну водоёма или к другим водорослям. Есть водоросли, внедряющиеся в раковины и известняк (сверлящие); встречаются (среди красных) и паразитические. Крупные морские водоросли, главным образом бурые, образуют нередко целые подводные леса. Большинство водорослей обитает от поверхности воды до глубины 20—40 м, единичные виды (из красных и бурых) при хорошей прозрачности воды опускаются до 200 м. В 1984 году кораллиновая красная водоросль была найдена на глубине 268 м, что является рекордом для фотосинтезирующих организмов. Водоросли нередко в большом количестве живут на поверхности и в верхних слоях почвы, одни из них усваивают атмосферный азот, другие приспособились к жизни на коре деревьев, заборах, стенах домов, скалах. Микроскопические водоросли вызывают красное или жёлтое «окрашивание» снега высоко в горах и в полярных районах. Некоторые водоросли вступают в симбиотические отношения с грибами (лишайники) и животными. Пресноводные водоросли являются одними из наиболее распространенных и вездесущих организмов на Земле. Они могут существовать в различных экологических условиях — от озер и рек до кислых торфяных болот, заселяют внутренние засоленные озера, обитают на поверхности влажных почв, снега и льда. Водоросли пресноводных водоемов выполняют многочисленные функции в экосистемах, играют ключевую роль в пищевых цепях, участвуя в круговороте питательных элементов и в газовом обмене. Изменения параметров воды во многом определяют особенности распространения различных видов водорослей. В качестве ключевых факторов выступают: 1) температура воды; 2) содержание солей в воде; 3) содержание биогенных элементов (N и Р), т. е. степень эвтрофикации водоема; 4) содержание кислорода в воде; 5) скорость течения воды и др. Значительный вклад в разнообразие водорослей вносит постоянно меняющийся по сезонам состав водорослевых сообществ. В зависимости от микроклиматических и физико-химических характеристик воды доля водорослей разных систематических групп может изменяться. Ключевыми факторами, определяющими изменение состава водорослевого ценоза, выступают температура и освещенность/прозрачность воды. Температурные предпочтения разных групп видов значительно варьируют. В зимний период при ограничении света и низких температурах процессы фотосинтеза затруднены. Водоросли концентрируются в поверхностном слое воды, в составе преобладают одноклеточные жгутиковые виды рода Cryptomonas. В весенний период при повышении освещенности водоема и температуры воды до 12 °С увеличивается доля холодноводных диатомовых водорослей, при повышении температуры до 15 °С увеличивается количество умеренно теплолюбивых диатомовых водорослей. В дальнейшем приходит время для развития зеленых, динофитных и сине-зеленых водорослей. Осенью понижающиеся температуры стимулируют развитие диатомовых, золотистых и холодолюбивых сине-зеленых водорослей [Садчиков]. Морской фитопланктон выступает первичным продуцентом в океанах и морях, основой водных пищевых цепей и характеризуется колоссальным видовым разнообразием. По разным оценкам, количество морских видов достигает 5 тыс. [Hallegraeff et al.]. Ю. Одум [Odum] считал, что ежегодная первичная валовая продуктивность водорослей составляет около 4 • 1017 ккал/год для океанов (исключая эстуарии и коралловые рифы), что сравнимо с продуктивностью всех типов лесов (3,8 • 1017 ккал/год). Несмотря на колоссальную продуктивность водорослей, их постоянное потребление гетеротрофными микро- и макроорганизмами удерживает их биомассу на низком уровне. Эта особенность отражается в классической перевернутой пирамиде биомассы морских экосистем (рис. 6).  а б Рис. 6. Пирамида биомассы в морской и наземной экосистемах: а — водная экосистема; б — наземная экосистема [по: Odum] Водоросли вносят значительный вклад в глобальные процессы производства кислорода и фиксации углерода, на их долю приходится 40 % мировой фиксации углерода [Bolin et al.]. Очень важна роль сине-зеленых водорослей порядка Nostocales (Nostoc, Anabaena и др.) в процессе фиксации атмосферного азота. Эти организмы встречаются как фотобионты лишайников, симбионты на вайях папоротника Azolla [Одум], а также в сво-бодноживущем состоянии. Цианобактерии в лихенизированном состоянии способны фиксировать от 0,2 до 13 кг азота на гектар [Kurina, Vitousek; Belnap]. Некоторые водоросли, являясь эдификаторами в морских и пресноводных экосистемах, создают среду обитания для других организмов. Прекрасным примером являются коралловые рифы, огромное значение в образовании которых играют красные водоросли рода Porolithon. Разнообразие и производительность коралловых рифов обусловлены также наличием других ключевых видов, в частности симбиотических зооксантелл. Осуществляя фотосинтез, водоросли обеспечивают кораллы пищей. Другой пример — бурые водоросли Macrocystis, образующие заросли вдоль скалистых берегов. Так, Macrocystis pyrifera создают уникальные экосистемы вдоль побережья Калифорнии и Мексики, а заросли ламинарий образуют подводные «водорослевые леса», служащие местообитанием большого числа видов растительного и животного мира, которые не встречаются в окружающих водах. Немного известно о наземных водорослях, их первичной продуктивности, сезонных и сукцессионных сменах в наземных водорослевых сообществах. Так, группа водорослей, населяющих поверхность почвы, обитает в экстремальных, по сравнению с другими группами водорослей, условиях и способна переносить длительные периоды недостатка влаги, значительные колебания температуры и яркий свет. В аналогичных условиях существуют водоросли, обитающие на коре древесных растений. Напочвенные водоросли образуют кожистые, войлокообразные пленки, слизистые слоевища (сине-зеленые водоросли) или зеленый налет на поверхности почвы. Нередко можно встретить рассыпанные по поверхности почвы колонии водорослей в виде зеленых слизистых шариков, напоминающих лягушачью икру. Несмотря на достаточно однообразную морфологию, проявляющуюся в формировании «зеленых шаров», было установлено, что разнообразие образующих их видов может быть колоссально. Многие группы водорослей в процессе развития эволюционно сходились на простой морфологии колоний. Так, среди наших представителей колонии подобного вида формирует Nostoc pruniforme. Большое количество водорослей населяет толщу почвы. Почвенные водоросли являются важными компонентами всех стадий формирования почвенного покрова, на первых этапах принимают активное участие в процессах выветривания горных пород и накопления первичного гумуса. Водоросли развиваются как на поверхности почвы и в ее верхних слоях (в основном автотроф-ные), так и в толще почвенного покрова на глубине до 2 м и более (гетеротрофные водоросли). С глубиной количество водорослей закономерно уменьшается. Почвенные водоросли могут влиять на физико-химические свойства почв (меняя рН среды, удерживая минеральные соли, обогащают почву кислородом, улучшая структуру почвы, препятствуя ее эрозии), в частности, участвуя в процессе азотфиксации. Основными группами, населяющими почву, являются сине-зеленые, зеленые, желто-зеленые и диатомовые водоросли. Для их исследования используют метод культивирования, позволяющий в условиях лаборатории на питательной стерильной среде вырастить культуру почвенных водорослей. Водоросли, заселяющие каменистые субстраты, кору и ветки деревьев, находятся в условиях постоянно меняющегося режима увлажнения и значительных перепадов температуры. Так, на коре деревьев обычны зеленые водоросли (Pleurococcus, Trentepolia, Chlorella, Chlorococcum, Desmococcus), реже встречаются сине-зеленые водоросли (Synechococcus, Aphanothece, Plectonema, Nostoc). На поверхности скал встречаются виды родов Plectonema, Nostoc и Scytonema. Также они способны поселяться в/на шерсти животных, например, полярных медведей и ленивцев [Водоросли...]. Водоросли часто выступают компонентом симбиотических отношений, обитая в/на мхах, папоротниках, цветковых растениях и других водорослях. Один из наиболее известных примеров симбиотических взаимоотношений водорослей являются лишайники. Формирование лишайникового симбиоза происходит, когда грибы захватывают водоросли, растущие на почве, камнях и деревьях. Лишайники вносят значительный вклад в видовое и экологическое разнообразие водорослей. Являясь фотобионтом лишайников, многие водоросли и цианобактерии существенно расширяют ареал; существуют водоросли, встречающиеся только в составе лишайникового симбиоза (p. Trebouxia). Классификация Водоросли — крайне гетерогенная группа организмов, насчитывающая около 100 тысяч (а по некоторым данным до 100 тыс. видов только в составе отдела диатомовых) видов. На основании различий в наборе пигментов, структуре хроматофора, особенностей морфологии и биохимии (состав клеточных оболочек, типы запасных питательных веществ) большинством отечественных систематиков выделяется 11 отделов водорослей [3]. Прокариоты (Procaryota) Царство Бактерии (Bacteria) Подцарство Negibacteria Отдел Синезелёные водоросли (Cyanobacteria) Домен Эукариоты (Eucaryota) Царство Растения (Plantae) Подцарство Biliphyta Отдел Глаукофитовые водоросли (Glaucophyta) Отдел Красные водоросли (Rhodophyta) Подцарство Зелёные растения (Viridiplantae) Отдел Зелёные водоросли (Chlorophyta) Отдел Харовые водоросли (Charophyta) Царство Хромисты (Chromista) Подцарство Sar или Harosa Надотдел (надтип) Страменопилы (Stramenopiles) или Гетероконты (Heterokonta) Отдел Охрофитовые водоросли (Ochrophyta) Класс Бурые водоросли (Phaeophyceae) Класс Жёлто-зелёные водоросли (Xanthophyceae) Класс Золотистые водоросли (Chrysophyceae) Отдел Диатомовые водоросли (Bacillariophyta) Надтип (надотдел) Альвеоляты (Alveolata) Тип (отдел) Miozoa Надкласс Динофлагелляты (Dinoflagellata) Надтип (надотдел) Ризарии (Rhizaria) Тип (отдел) Церкозои (Cercozoa) Класс Хлорарахниофитовые водоросли (Chlorarachnea =Chlorarachniophyceae) Подцарство Hacrobia Отдел Криптофитовые водоросли (Cryptophyta) Отдел Гаптофитовые водоросли (Haptophyta) Царство Экскаваты (Excavata) Подцарство Eozoa Тип Эвгленозои (Euglenozoa) Класс Эвгленовые (Euglenoidea =Euglenophyceae) 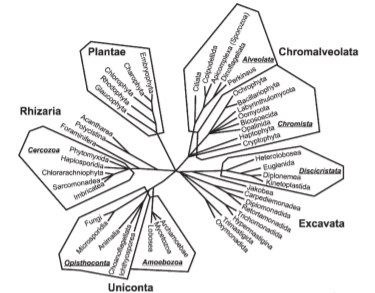 Рис. 1. Дерево эукариотических организмов [по: Keeling, p. 1482] К ветви Chromalvelolata (или царство Chromista) относится отдел Ochrophyta, в который входят бурые, желто-зеленые, золотистые, синуровые и некоторые другие классы водорослей. В особые отделы в пределах царства выделены диатомовые, криптофитовые и гаптофитовые водоросли. Среди нефотосинтезирующих организмов им родственны опалины, лабиринтулиды и оомицеты [Guiry, Guiry]. К царству Chromista относятся также динофитовые водоросли, которые вместе с инфузориями, апикомплексами и колподеллидами включаются в отдел Miozoa (Alveolata). Отдел Euglenophyta, объединяемый многими исследователями в Excavata, относится к царству Protozoa и включает эвгленовые водоросли, а также паразитические и свободноживущие жгутиконосцы, такие как кинетопластиды, диплонемиды и др. Хлорарахниофиты — единственные автотрофы среди группы Rhizaria (Корненожки). Это организмы, отличающиеся развитием обычно довольно длинных выростов — ложноножек (рис. 2). Родственными хлорарахниофитам гетеротрофными организмами являются церкомонады и филозные раковинные амебы (эуглифиды), некоторые солнечники и радиолярии, а также паразитические организмы — плазмодиофоры и гаплоспоридии [Keeling, 2004] (рис. 1). По другим представлениям, корненожки под названием Cercozoa относятся к царству Chromista наравне с Bacillariophyta, Cryptophyta, Miozoa и Ochrophyta. 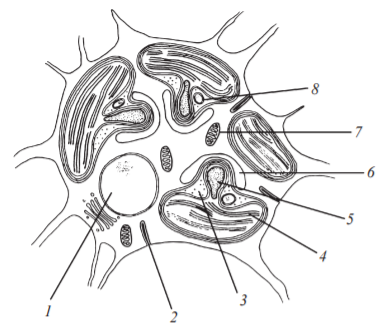 Рис. 2. Строение клетки хлорарахниофит: 1 — ядро; 2 — трихоциста; 3 — рибосомы; 4 — тилакоид; 5 — пиреноид; 6 — парамилоновое зерно; 7 — митохондрия; 8 — нуклеоморф [по: Fykologická...] Самыми крупными группами в пределах царства Plantae яв-ляются высшие растения, зеленые и красные водоросли. Высшие растения рассматриваются многими систематиками как отдель-ная группа фотосинтезирующих организмов, произошедшая от зеленых водорослей и отличающаяся от них прежде всего нали-чием тканей и органов, а также многоклеточными антеридиями и архегониями у всех представителей. Ее статус, по разным пред-ставлениям, различен. Часть исследователей выделяют наземные растения в отдел Tracheophyta, рассматривая входящие в него группы (плауновидные, хвощевидные, цветковые и др.) как классы; исследователи, занимающиеся систематикой высших растений, считают, что эти группы имеют ранг отделов. Неопределенность таксономического ранга существует и по от-ношению к зеленым водорослям. Во многих системах, сформи-ровавшихся до появления генетических исследований, группа зеленых водорослей имела ранг отдела, в котором выделялись три класса: Chlorophyceae, Conjugatophyceae и Charophyceae. К Chlorophyceae относились водоросли различного морфоло-гического строения, характеризующиеся изогамным, анизогамным или оогамным половым процессом. Зооспоры или гаметы этих водорослей обычно имеют жгутики (кроме случаев их вторичной утраты). Специальных половых органов не образуется. Класс Chlorophyceae включал следующие порядки, выделяемые обычно на основе особенностей морфологии [Горбунова]: пор. Volvocales — одноклеточные или колониальные жгути-коносцы; пор. Chlorococcales — одноклеточные или колониальные фор-мы, лишенные жгутиков; пор. Ulotrichales — нитчатые водоросли с одноядерными клетками; пор. Chaetophorales — гетеротрихальные водоросли; пор. Oedogoniales — нитчатые водоросли, характеризующиеся «колпачками» на клетках и большим количеством жгутиков на монадных клетках; пор. Bryopsidales — включает представителей сифональной жизненной формы без упорядоченного ветвления; пор. Dasycladales — сифональные представители с мутовчатым ветвлением; пор. Siphonocladales — нитчатые водоросли сифонокладальной жизненной формы. В 1962 г. датским альгологом Т. Кристенсеном из Chlorophyceae выделен класс Prasinophyceae, отличающийся органическим покро-вом клетки из мелких чешуек и (2)–4–(8) жгутиками. Его самосто-ятельность позднее была подтверждена молекулярными методами. Развитие молекулярно-генетических и ультраструктурных методов исследования привело к дальнейшему пересмотру числа и объемов классов зеленых водорослей. Класс Chlorophyceae повы-шен в ранге до отдела. В системе Ф. Лелиерта с соавторами [Leliaert et al., 2012], кроме прасинофитовых, в отделе Chlorophyta выде-ляются еще три класса: Ulvophyceae (с порядками Bryopsidales, Cladophorales, Dasycladales, Trentepohliales, Ulvales, Ulothrichales), Chlorophyceae (Chlamydomonadales, Chaetopeltidales, Chaetophorales, Oedogoniales, Sphaeropleales) и Trebouxiophyceae (Chlorellales, Oocystales, Prasiolales, Trebouxiales). Конъюгаты (Conjugatophyceae) по «классической» системе зеленых водорослей — класс, включающий одноклеточные, коло-ниальные или нитчатые водоросли, половой процесс у которых — конъюгация. К классу относились четыре порядка — Mesotaeniales, Gonatozygales, Desmidiales и Zygnematales. Зигнемовые и десмидиевые являются наиболее крупными порядками среди конъюгат. Первая классификация зигнемовых водорослей была создана немецким ученым Генрихом де Бари в 1858 г. Согласно его взлядам, пять известных к тому времени родов зигнемовых водорослей находились в одном семействе — Zygnemaceae и двух подсемействах — Zygnemae и Mesocarpae. Раз-деление водорослей на эти таксоны основывалось на особенностях формирования зигоспор в процессе конъюгации. В конце XIX в. была создана вторая система, которая основыва-лась на различиях в форме и расположении хлоропластов у разных представителей порядка. В ней зигнемовые водоросли разделялись на три семейства: Zygnemataceae, Spirogyraceae, Mougeotiaceae. Данная система получила наибольшую поддержку и развивалась вплоть до конца XX в., когда зигнемовые водоросли насчитывали уже около 700 видов в шестнадцати родах [Рундина]. Первая система десмидиевых была предложена в 1840 г. Менегини. Он объединил всех известных на это время предста-вителей в 5 родов (Desmidium, Closterium, Micrasterias, Cosmarium и Staurastrum), основываясь на форме клеток. Позднее, в 1848 г., британский ученый Дж. Ральфс в своей работе «The Brithish Desmidiae» усовершенствовал систему Менегини, выделив 17 ро-дов и объединив их в семейство Desmidiaceae. В 1898 г. Лютке-мюллер создал систему, взяв за основу строение клеточной стенки: Сем. Desmidiaceae Подсемейство: Saccodermae Desmidiaceae Подсемейство: Saccodermae Desmidiaceae Триба: Spirotaeniae Триба: Gonatozygae Подсемейство: Placodermae Desmidiaceae Триба: Peniae Триба: Cosmariae Триба: Closteriae К первому подсемейству он отнес виды с простой клеточной оболочкой, а ко второму — со сложной. Следующий важный шаг сделал В. Вест в 1916 г. Он внес се-мейство десмидиевые в порядок Conjugatae вместе с семейством зигнемовые на основании сходства протекания полового процесса. Кроме того, В. Вест впервые выдвинул предположение о том, что одноклеточные десмидиевые произошли от нитчатых форм, а не наоборот. Г. М. Паламарь-Мордвинцева приводит следующее положение десмидиевых в классе конъюгат: Класс: Zygnematophyceae (Conjugatophyceae) Пор. Zygnematales Пор. Mesotaeniales Пор. Gonatozygales Пор. Desmidiales Сем. Desmidiaceae Сем. Peniaceae Сем. Closteriaceae К концу XX в. попытки построить максимально близкую к естественной систему зеленых конъюгирующих водорослей на основании морфологических особенностей привели к тому, что их объединили в один класс. Впоследствии это было подтверждено генетическими исследованиями. Развитие молекулярно-генетиче-ских методов анализа в конце прошлого века дало необходимый толчок к построению естественной филогенетической системы группы. Согласно современным представлениям, конъюгаты (Zygnema-tophyceae) и харовые водоросли (Charophyceae) совместно с классами Coleochaetophyceae, Klebsormidiophyceae, Chlorokybophyceae и Mesostigmatophyceae, а также высшими растениями относятся к отделу Streptophyta. Причем анализ 76 хлоропластных генов показал, что именно зигнемовые, а не харовые, как полагалось ранее, являются сестринской группой высших растений (рис. 3). Как уже указывалось выше, часть исследователей не поддерживают выделение отдела Streptophyta, они выделяют отдел Charophyta и высшие растения. 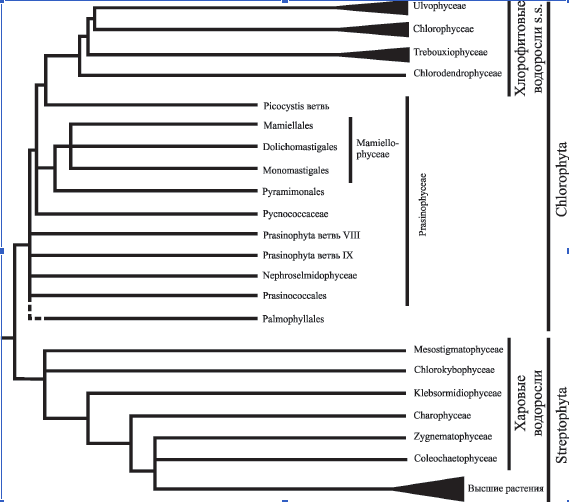 Рис. 3. Филогенетические связи основных групп подцарства Viridiplantae [по: Leliaert et al., 2011, p. 684, с изм.] Согласно классическим представлениям, отдел Крас-ные водоросли подразделялся на два класса — Bangiophyceae и Florideophyceae, отличающиеся строением таллома, формой хлоропласта, строением женских репродуктивных органов и осо-бенностями жизненного цикла [Горбунова; Garbary, Gabrielson]. В системе, предложенной Г. Сандерсом и М. Хоммерсан-дом [Saunders, Hommersand], часть одноклеточных форм, обитающих в экстремальных условиях, выделена в особый отдел — Cyanidiophyta. В этой же работе на основании моле-кулярных данных бангиевые разделены на Rhodellophyceae, Compsopogonophyceae и собственно Bangiophyceae. У первых по-ловое размножение неизвестно и таллом преимущественно одно-клеточный, Compsopogonophyceae характеризуются чередованием гаметофита и спорофита, у Bangiophyceae усложняется строение таллома, появляются карпоспорофиты и поры между клетками. Х. С. Юн с соавторами [Yoon et al.] не принимает выделение Cyanidiophyta как особого отдела, присваивая ему ранг класса, и делит Rhodellophyceae на три класса: Rhodellophyceae s. str. — одноклеточные водоросли с флоридозидом в качестве запасного вещества, Porphyridophyceae — одноклеточные водоросли с манни-том в качестве запасного вещества и Stylonematophyceae — одно-клеточные до нитчатых, с размножением делением или моноспо-рами. Таким образом, в отделе Красные водоросли в настоящее время выделяют 7 классов: Cyanidiophyceae, Rhodellophyceae, Porphyridophyceae, Stylonematophyceae, Compsopogonophyceae, Bangiophyceae и Florideophyceae. Происхождение, родственные связи и эволюция С учётом того, что водоросли — искусственная группа, включающая самые разные по систематическому положению организмы (а одна из основных задач современной систематики — формировать систематические группы на основании филогенетического родства, то есть именно по происхождению), говорить о происхождении и эволюции водорослей в целом смысла нет, ведь одни из них — прокариоты, а другие, относящиеся к эукариотам, также имеют самое разное происхождение[4]. Например, зелёные и харовые водоросли образуют общую родственную группу с настоящими, наземными растениями (Viridiaeplantae), к которым также близки красные водоросли и глаукофиты (Glaucophyta), все вместе они составляют отдельную ветвь Archaeplastidae филогенетического («эволюционного») дерева эукариот. C другой стороны, динофитовые, диатомовые, бурые и золотистые водоросли находятся на другой ветви эволюции эукариот (Chromalvelolata), общей с фораминиферами, радиоляриями, инфузориями, кокцидиями и пр. Наконец, отдельная ветвь (Excavata) включает эвгленовые водоросли и многих других паразитических и свободноживущих жгутиконосцев, среди которых — трипаносомы, трихомонады, дипломонады, оксимонады и пр. Всего выделено 4 ветви «дерева жизни» эукариот (в четвёртой, Unikonta, находятся грибы, животные, микроспоридии, амёбы, хоанофлагелляты и пр., водорослей не выявлено; одна небольшая группа водорослей, Chlorarachniophytes, имеет неопределённое систематическое положение среди эукариот), расхождение этих четырёх ветвей произошло на раннем этапе эволюции эукариот[5]. Роль в природе и жизни человека Роль в биогеоценозах Водоросли — главные производители органических веществ в водной среде. Около 80 % всех органических веществ, ежегодно создающихся на Земле, приходится на долю водорослей и других водных растений. Водоросли прямо или косвенно служат источником пищи для всех водных животных. Известны горные породы (диатомиты, горючие сланцы, часть известняков), возникшие в результате жизнедеятельности водорослей в прошлые геологические эпохи. Кстати, именно по диатомовым водорослям определяется возраст этих пород. Пищевое применение Некоторые водоросли, в основном морские, употребляются в пищу (морская капуста, порфира, ульва). В приморских районах водоросли идут на корм скоту и удобрение. В ряде стран водоросли культивируют для получения большого количества биомассы, идущей на корм скоту и используемой в пищевой промышленности. Съедобные водоросли — богаты минеральными веществами, особенно йодом. Традиционно используются в восточноазиатских кухнях. Одно из самых популярных блюд с водорослями — суши. Водоочистка Многие водоросли — важный компонент процесса биологической очистки сточных вод. Бурное развитие нитчатых и планктонных водорослей (цветение воды) может создавать проблемы в работе очистных сооружений, систем водоснабжения. В морской аквариумистике водоросли используют в системах биологической фильтрации. Применяются водорослевые танки («водорослевики») и скрубберы. Выращиваются либо специально посаженные макроводоросли (обычно из родов Хетоморфа и Каулерпа), либо используется естественное водорослевое обрастание. Интенсивное освещение обеспечивает быстрый рост водорослей и активное поглощение ими загрязнителей. Периодически масса разросшихся водорослей удаляется из фильтра[6]. В фармацевтической промышленности Из водорослей получают: студне- и слизеобразующие вещества — агар-агар (анфельция, гелидиум), агароиды (филлофора, грацилярия), карраген (хондрус, гигартина, фурцелярия), альгинаты (ламинариевые и фукусовые), кормовую муку, содержащую микроэлементы и йод. Водоросли участвуют в образовании некоторых типов лечебных грязей. Химическая промышленность Человек использует морские водоросли в химической промышленности. Из них получают йод, альгиновую кислоту, агар-агар, калийные соли, целлюлозу, спирт, уксусную кислоту. Биотопливо Из-за высокой скорости размножения водоросли применяются для получения биомассы на топливо. Разработано множество различных экспериментальных процессов получения биотоплива (англ.)русск., например, использующих высокие температуры и давления[7]. В науке Водоросли широко применяют в экспериментальных исследованиях для решения проблем фотосинтеза и выяснения роли ядра и других компонентов клетки. Существует определенная методика сбора и хранения водорослей. Исходя из задач, поставленных перед исследователем, определяются места отбора проб, их количество, выбор оборудования, необходимость проведения сбора в конкретное время года и количество выездов. В качестве оборудования для сбора проб водорослей необходимо подготовить емкости с широким горлом и плотно закрывающимися крышками, нож, лопатку-скребок, полиэтиленовые пакеты, формалин, маркер, этикетки, полевой дневник, карандаш. Учитывая постоянную динамику состава водорослей в зависимости от динамики параметров среды, постоянного изменения численности различных групп, сбор водорослей проводится в течение всего вегетационного сезона, начиная с ранней весны и заканчивая поздней осенью. Сбор водорослей в водоемах производится с берега или с помощью лодки. Для сбора используют различные приспособления, позволяющие зачерпнуть пробы на разной глубине. В периоды массового развития водорослей самым простым приспособлением, применяемым для сбора проб, является планктонная сеть (рис. 7) [Топачевский, Масюк]. Для изготовления планктонных сетей используются полиамидные сита, имеющие большую прочность и определенный размер отверстий. Размер ячеек полиамидных сит варьирует от 0,064 до 1,364 мм. При работе с сетью ее протягивают через толщу воды, в результате чего на ткани остаются относительно крупные водоросли (мелкие формы просачиваются через ткань). Сеть имеет форму сачка, на металлическом кольце размещается капроновый мешок, на дне которого располагается металлический или пластиковый стаканчик, в котором оседают водоросли. Сеть применяется при поверхностном сборе водорослей. Ее используют как непосредственно для забора проб, протягивая через толщу воды, так и для фильтрации воды и сгущения проб водорослей. Далее сконцентрированные пробы водорослей из стаканчика переносят в чистый сосуд или герметично закрывающийся полиэтиленовый пакет, который маркируется, а информация о пробе заносится в полевой дневник. Собранные пробы можно изучать в живом состоянии или зафиксировать для дальнейших исследований. Вертикальный сбор проб фитопланктона производится с использованием различных емкостей и сетей, погружаемых на определенную глубину [Киселев]. Для сбора водорослей из определенных горизонтов толщи воды используют бутыли с крышкой или батометры. Батометры или бутыли Майера — это приборы различной конструкции, используемые для взятия проб воды на разной глубине. Эти приборы оборудованы специальными клапанами и кранами для закрывания и открывания под водой (рис. 8).  Рис. 7. Планктонная сеть Апштейна: 1 — обод; 2 — полоса плотной материи для прикрепления фильтрационного конуса к ободу; 3 — стропа, соединяющая обод и стаканчик; 4 — фильтрационный конус; 5 — стаканчик; 6 — силиконовая трубка; 7 — шаровой кран  Рис. 8. Батометры и бутыли разных конструкций для сбора проб водо-рослей на разной глубине водоемов [по: Ask..] Сбор фитобентоса на мелководье производится с использованием обыкновенных сосудов или сифонов, засасывающих поверхностный слой донного ила. На глубине часто используют грабельки, «кошки», илососы, дночерпатели или драги (рис. 9). 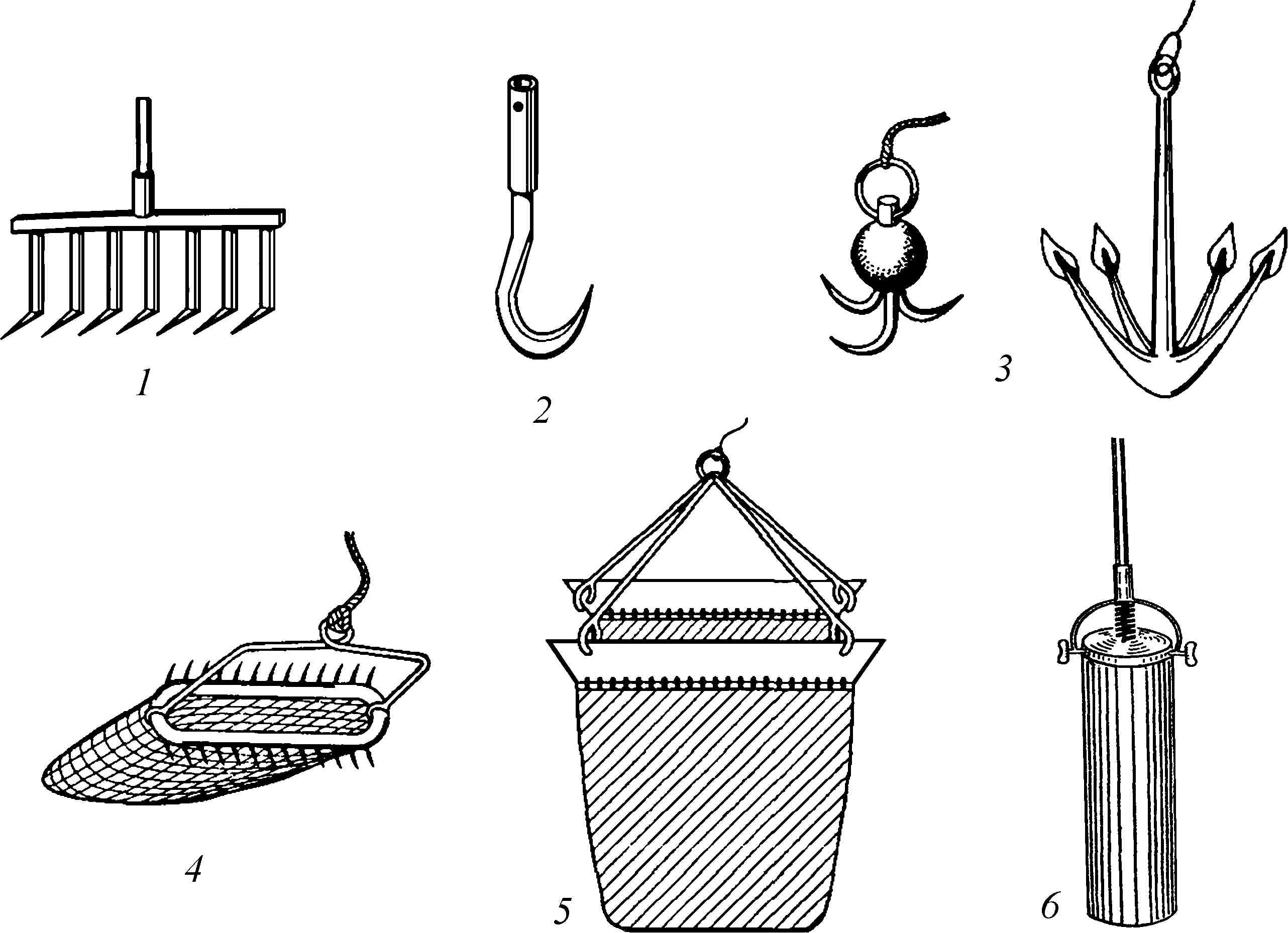 Рис. 9. Приспособления для сбора бентосных водорослей: 1 — грабельки; 2 — серпообразный нож; 3 — якорьки-«кошки»; 4 — драга Раменского (ширина 35 см); 5 — гидробиологическая драга; 6 — трубчатый дночерпатель [по: Садчиков и др., с. 39, с изм.] Сбор прикрепленных водорослей проводится при помощи ножа или лопатки-скребка, соскабливающего слой водорослей с поверхности камней, растений, раковин моллюсков и различных подводных конструкций. Собранный материал переносят в сосуды или пакеты и маркируют. Для лучшей сохранности объектов рекомендуется собирать небольшие кусочки субстрата с прикрепленными к ним особями. Собранные образцы помещают в пакеты или стеклянные емкости и фиксируют 4 %-ным раствором формальдегида. Сбор крупных водорослей проводят в емкости, наполненные водой. Каждая емкость маркируется пронумерованными этикетками, подробная информация о которых заносится в полевой дневник. Для количественной оценки содержания водорослей в пробе собранные пробы фильтруют через планктонную сеть. Объем воды, проходящий через фильтр, можно приблизительно рассчитать по формуле v = izt^d, где v — объем воды, фильтруемой через сеть; г— радиус сети; d — расстояние, на которое была протянута сеть. Пробы водорослей, собранные различными способами, необходимо в дальнейшем сконцентрировать. Существует три основных метода извлечение водорослей: 1) центрифугирование; 2) фильтрация через бумажные (№ 42), мембранные или бактериальные фильтры; 3) отстаивание. Центрифугирование проводят с использованием электрической центрифуги, в которую помещают образцы (5-20 мл) на 10-20 мин, при скорости 1500-2000 об/мин. В пробы добавляется несколько капель 1 % алюмокалиевых квасцов, формалин или раствор Люголя. Метод применяется для концентрирования как живого, так и фиксированного материала. Сгущение проб для концентрирования живого и фиксированного материала также проводится методами прямой и обратной фильтрации. Прямая фильтрация используется для проб с низким содержанием фитопланктона и незначительным количеством примесей органического и неорганического происхождения. При этом используется вакуумный источник, создающий разряжение 0,2-0,3 атм. Пробы пропускаются через фильтры с разным диаметром пор. Выбор фильтров зависит от задач и объектов исследования. Обычно используются «предварительные» (диаметр отверстия 2-5 мкм) и мелкопористые мембранные фильтры (диаметр — от 1 до 0,3 мкм). Для мелких водорослей могут применяться бактериальные фильтры. Метод обратной фильтрации, при котором пробы прогоняются через фильтр снизу вверх, является наиболее щадящим, хорошо сохраняющим клетки и пригодным для всех групп фитопланктона. Собранные пробы можно поместить в стеклянные трубчатые сосуды и оставить отстаиваться на 15-20 дней в темном месте. В дальнейшем воду из верхней части сосуда аккуратно отсасывают с помощью трубки с фильтром на конце, а полученную концентрированную пробу исследуют. Также сгущение можно провести с использованием бактериальных фильтров [Лемеза]. Важным этапом работы является фиксирование собранного материала. Можно сохранить собранные водоросли в живом состоянии несколько часов, если поместить их в холодильник, после чего пробы необходимо незамедлительно исследовать. Исследования живых образцов позволит избежать ошибок, связанных с изменением формы тела водорослей, окраски хлоропластов, потерей жгутиков, вплоть до полного разрушения клеток. Для длительного сохранения проб водорослей используют различные фиксаторы (табл. 2). Однако на сегодняшний день не существует универсального фиксатора, позволяющего сохранять пробы различных групп водорослей. Одними из самых распространенных консервирующих растворов являются 4 %-ный раствор формальдегида и раствор Люголя (хотя содержащийся в аптечном Люголе глицерин способствует образованию в пробах шариков) [Лемеза]. Водоросли, собранные вместе с субстратом, и фильтры с водорослями помещают в 4 %-ный раствор формальдегида. Раствор кислого формалина подходит для сохранения панцирных форм водорослей (динофлагелляты и диатомовые водоросли). Хорошо зарекомендовал себя также раствор формальдегида и хромовых квасцов (5 мл 4 %-ного формальдегида и 10rK2SO4- Cr2(S04)3-24 H20 в 500 мл воды). Зафиксированные пробы могут длительное время храниться в темном прохладном месте. Раствор кислого формалина может быть нейтрализован добавлением карбоната кальция. Раствор Люголя, состоящий из 10 г йода и 20 г йодида калия, растворенных в 200 мл дистиллированной воды с добавлением 20 г ледяной уксусной кислоты, подходит для фиксации одноклеточных жгутиковых и реснитчатых форм планктона, так как хорошо сохраняет жгутики и реснички. Раствор можно хранить в темной склянке до нескольких месяцев. При проведении анализов его добавляют в соотношении 1 : 5. Альгологи часто применяют раствор, разработанный в Институте озероведения РАН: 3 части кристаллического йода (I), 10 частей йодида калия (KI), 5 частей CH3COONa, кристаллик тимола на 100 частей воды. Раствор добавляют в сгущенную пробу до получения чайного цвета. Таблица 2 Фиксаторы и красители, используемые при исследованиях водорослей
Продолжение табл. 2
Окончание табл. 2
Для изучения видового состава проб водорослей используют бинокулярную лупу и/или микроскоп. При использовании микроскопа на предметное стекло наносят каплю исследуемой жидкости и накрывают покровным стеклом. Излишки влаги удаляют фильтровальной бумагой. При необходимости можно добавить пипеткой воды. Чтобы исключить испарение влаги, по краю покровного стекла наносят слой парафина. Для продолжительных наблюдений удобен метод висячей капли с использованием предметного стекла с углублением. Подвижные формы необходимо обездвижить путем нагревания или зафиксировать парами оксида осмия, кристаллического йода или 4 %-ным раствором формальдегида [Федоров, 1979]. При исследовании внутриклеточных структур используют различные красители, самый доступный и эффективный — это раствор Люго-ля, окрашивающий крахмал в синий цвет, кроме того, являющийся еще и фиксатором. Почвенные водоросли, покрывающие поверхность почвы, собирают с верхним слоем почвы, аккуратно срезая ее ножом; водоросли из нижележащих слоев почвы собираются в каждом горизонте почвенного профиля, небольшое количество почвы вынимается из профиля стерильными инструментами. В дальнейшем либо проводится непосредственный анализ материала под микроскопом, либо используется метод культивирования водорослей. Подробнее об этом методе можно узнать из издания «Полевая геоботаника» [Голлербах, Зауер]. Биотестирование Водоросли являются одним из наиболее широко применяемых биообъектов при биотестировании химических веществ и образцов природных и загрязнённых вод. Экодом Предпринимаются попытки использовать некоторые быстро размножающиеся и неприхотливые водоросли (например, хлореллу, которая быстро и в большом количестве синтезирует белки, жиры, углеводы, витамины и способна усваивать примерно 10-12 % солнечной энергии[источник не указан 3887 дней], синтезируя органическое вещество (для сравнения — высшие растения способны усваивать только 1-2 % солнечной радиации) для создания круговорота веществ в обитаемых отсеках космического корабля. |
