Монография исследование водорослей.. Во́доросли. Аутентичного материала
 Скачать 2.99 Mb. Скачать 2.99 Mb.
|
Y2 Z2 ' X] Yj Zj Y0 Z0 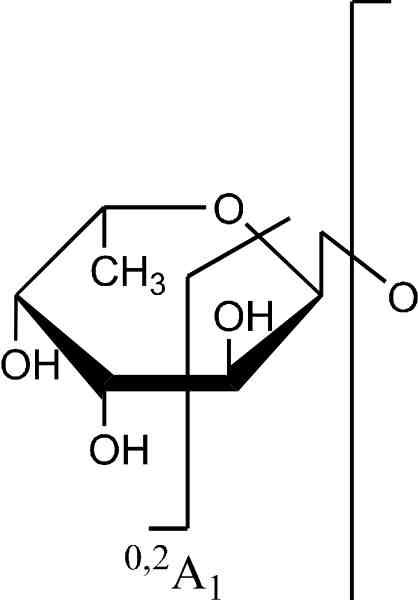 Невосстанавливающий | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| | "°Ч к | |
| A | ||
| sr_ | у | г |
| 1™ OH | | |
в, с,
zr—' Восстанавливающий
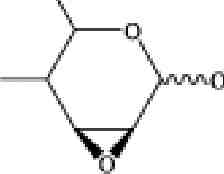
Рис. 3.5. Номенклатура, используемая для описания продуктов
масс-спектрометрической фрагментации гликоконьюгатов,
предложенная Домоном и Костелло
Ионы, сохраняющие заряд на агликоне (восстанавливающем конце для олигосахаридов), обозначаются в случае разрыва моносахаридного кольца — X, при разрыве Ci^O гликозидной связи — Y и при разрыве О^Сх гликозидной связи — Z. Ионы, сохраняющие заряд на невос-станавливающем кольце, обозначаются А, В, С. Численные индексы справа внизу для X, Y, Z от 0 и далее обозначают порядок моносаха-ридных остатков, начиная от агликона (восстанавливающего конца). Численные индексы слева вверху обозначают место разрыва связей в моносахаридном кольце и начинаются с наименьшего по порядку атома углерода (или кислорода) из двух разрывающихся связей, начиная с О (рис. 3.5). Напротив, численные индексы для ионов А, В, С начинаются с цифры 1 и считаются с невосстанавливающего конца (терминального моносахарида). В случае соединений с разветвленной углеводной цепью, вводятся дополнительные индексы а, (3 и т.д., причем индексом а обозначается самая длинная углеводная цепь.
Масс-спектрометрическая фрагментация сульфатированных олигосахаридов в режиме регистрации отрицательных ионов
Как уже было отмечено, особенности метода ИЭР МС позволили
обойти ограничения масс-спектрометрии МАЛДИ при анализе олигосахаридов, содержащих большое число кислотных остатков. В режиме регистрации отрицательных ионов практически не происходит отрыва лабильных кислотных групп, и формируются многозарядные ионы, дающие в режиме МС/МС наиболее интенсивные фрагментные ионы, отражающие информацию о типе связи, последовательности, разветвлениях и местах присоединения кислотных остатков и других заместителей. В связи с этим при изучении анионных поли- и олигосахаридов исполь-
67
зование тандемной ИЭР МС является предпочтительным.
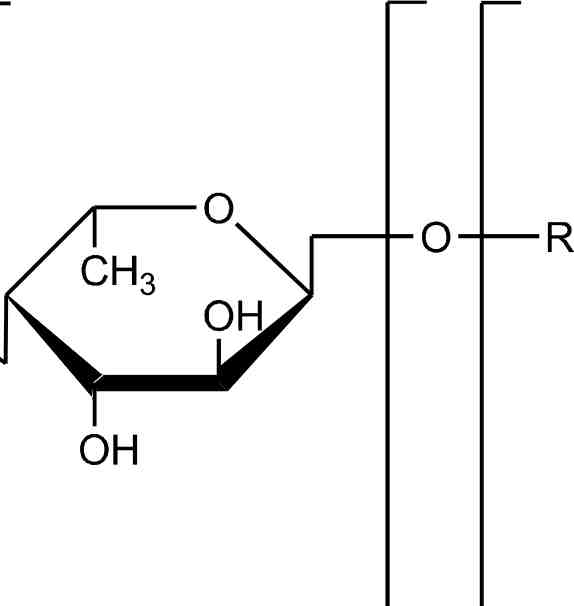
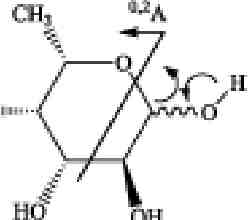
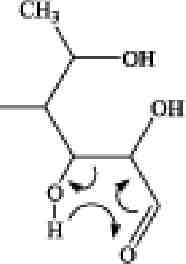
Первая системная работа по изучению позиционных изомеров суль-фатированной фукозы с помощью тандемной ИЭР масс-спектрометрии, совмещенной с капиллярным электрофорезом, была выполнена группой французских ученых. Тиссо с коллегами в 2006 году, взяв за основу предыдущие работы по изучению позиционных изомеров сульфатированных гексоз (Karlsson et al., 1996; Minamisawa, Hirabayashi, 2005), установили, что, на основании данных ИЭР МС/МС, полученных в режиме регистрации отрицательных ионов, возможно различить 2-0-, 3-0- и 4-О-сульфатированные изомеры фукозы (Tissot et al., 2006). Сульфатированная фукоза (в положениях С2 и С4) дает характеристичные °'2Х- и 02А-ионы, в то время как 3-О-сульфатированная фукоза дает только анион HS04- в качестве основного продукта фрагментации. На основании данных компьютерного моделирования и МС/МС экспериментов был предложен механизм образования фрагментных ионов, представленный на рисунке 3.6.
А
\------ОН OSC?
т£139Да
/f^&
В
Н ^ KSO,1
иА97Да
0,ВСн'
С.л-
«-'-II ;
) Он
m/z183 Да
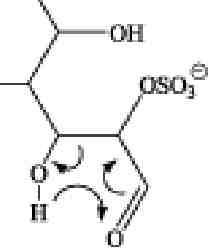
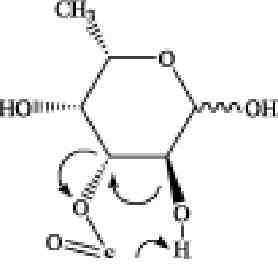
Рис. 3.6. Предполагаемые механизмы образования фрагментных ионов из сульфа-тированной фукозы в условиях ДИС МС/МС (режим регистрации отрицательных ионов). А, Б и В — схемы фрагментации 2-0-, З-О- и 4-О-сульфатированной фукозы с образованием соответственно 0,2Х-иона с m/z139 Да, эпоксида и аниона HS04- с m/z
97 Да и 0ДА-иона с m/z183 Да
68
Предложенный механизм формирования 0,2Х- и 0,2А-ионов включает разрыв связей между атомами С1 и 0-5, ведущий к образованию открытой кето-формы с последующей перегруппировкой МакЛафферти (McLafferty F.W. et al., 1982), характеризуемой разрывом связи между атомами С2 и СЗ пиранозного кольца фукозы (рис. 3.6., А и В).
Отсутствие 0,2Х- и 0,2А-ионов при внутрикольцевом разрыве для З-О-сульфатированной фукозы показывает, что атом водорода при гидроксильной группе атома СЗ играет ключевую роль в формировании 0,2Х- и 0,2А-ионов в процессе фрагментации, что согласуется с более ранними исследованиями (Minamisawa, Hirabayashi, 2005; Carroll et al., 1995). Отсутствие 0,2Х- и 0,2А-ионов также подтверждают исследования (1 ^3)-связанных сульфатированных дисахаридов, полученных из гепарина (Saad, Leary, 2004) и хондроитина (Desaire, Leary, 2000).
Таким образом, использование тандемной масс-спектрометрии в режиме регистрации отрицательных ионов позволяет определить последовательность моносахаридов в олигосахаридах. Установление типа связи и положения заместителей также доступно с помощью этого метода. Однако установить аномерную конфигурацию гликозидных связей и различить диастереоизомеры не всегда возможно без химической или химико-ферментативной модификации исследуемых объектов.
Применение масс-спектрометрии для исследования фукоиданов
Масс-спектрометрический анализ был применен нами для исследования фукоиданов, синтезируемых бурыми водорослями, обитающими в морях Дальнего Востока России.
Методы фрагментации фукоиданов
Структурные особенности сульфатированных полисахаридов, таких как хондроитинсульфаты, гепарины и каррагинаны, успешно исследуются современными МС-методами с МАЛДИ и ИЭР ионизацией.
Для МС-анализа необходимы методы фрагментации полисахаридов до олигосахаридов подходящих размеров, что достигается, в основном, благодаря наличию доступных ферментов, эффективно и специфично катализирующих расщепление сложных полисахаридных молекул (Harvey, 1999; Zaia, 2004). Для фрагментации сульфатированных полисахаридов используют также частичный кислотный гидролиз. Полученные олигоса-хариды, несущие информацию о строении исходного полимера, выделяют и анализируют. Например, Р. Даниель с коллегами использовали 0.75 мМ H2S04 при 60°С для гидролиза фукоидана с последующим выделением олигосахаридов и анализом с помощью ИЭР MCn (Daniel et al., 2007). Для
69
непосредственного анализа сложных реакционных смесей нами были применены как ИЭР МС, так и МАЛДИ МС, причем последний метод оказался более информативным, поскольку обладал низкой чувствительностью к нежелательным примесям и более высокой чувствительностью к полианионным компонентам в смесях за счет продуцирования только однозарядных ионов в источнике (Anastyuk et al., 2010).
Для фрагментации сульфатированных полисахаридов можно применять автогидролиз, представляющий собой, по сути, мягкий кислотный гидролиз с участием собственных сульфатных групп (находящихся в Н+-форме) в качестве источника кислоты. При этом структура образующихся олигомеров может зависеть от положения сульфатных групп в исходном полисахариде. Так, при исследовании сульфатированного галактана из красной водоросли Gigartinaskottsbergiiс помощью ЯМР-спектроскопии и МАЛДИ МС был использован указанный способ получения олигосахаридов (Ciancia et al., 2005). Автогидролиз проводили при концентрации полисахарида 10 мг/мл 11 часов при 60°С. При автогидролизе каррагинанов расщеплялась гликозидная связь между остатками 2-0-сульфат-3,6-ангидро-аТ)-галактозы и 4-0-сульфат-(ЗТ)-галактозы или 2,6-О-дисульфат-а-галактозы и 4-0-сульфат-(3-галактозы (Ciancia et al., 1991; Noseda, Cerezo, 1993; Stortz, Cerezo, 1987; Stortz, Cerezo, 1991). В процессе расщепления гликозидной связи наблюдалось отщепление сульфатной группы в положении С2. Гликозидные связи между остатками З.б-ангидро-а-Б-галактозы также расщеплялись, но с меньшей скоростью. Продукты фрагментации отдельного полисахарида, полученные автогидролизом и частичным кислотным гидролизом также могут различаться из-за различной чувствительности связей в условиях используемого метода.
Для сульфатированных полисахаридов широко применяется сольволиз как наиболее щадящий метод при необходимости их десульфатирования. Однако особенность структуры фукоиданов такова, что даже в условиях сольволитического десульфатирования происходит разрушение, как правило, большей части их молекул и выход подходящей для установления строения высокомолекулярной фракции (например, для метилирования) составляет от 7 до 40% (Bilan et al., 2002, Усов, Билан, 2009) от нативного полисахарида. Таким образом, теряется большая часть информации (часто до 90%) о строении фукоиданов. Нами впервые метод сольволиза был классифицирован как метод деградации фукоиданов и с помощью МС-методов для установления деталей структуры были проанализированы низкомолекулярные продукты, образующиеся при их сольволитическом расщеплении (Anastyuk et al., 2009, Шевченко и др., 2007).
70
Анализ структуры фукоидана из бурой водоросли Sacharinagurjanovae
Современные методы масс-спектрометрии для исследования фукоиданов стали использоваться сравнительно недавно, возможно, потому, что последние представляли сложный объект для изучения. Сообщения об успешном масс-спектрометрическом исследовании фукоиданов появились всего несколько лет назад (в 2007 году) (Daniel et al., 2007; Шевченко и др., 2007).
Первая работа была выполнена в ТИБОХ ДВО РАН и посвящена структурным исследованиям фукоидана из бурой водоросли S. gurjanovae(Шевченко и др., 2007). Высокоочищенная фракция фукоидана LgF2 была выделена из S. gurjanovaeи состояла из остатков фукозы и галактозы с приблизительно равным соотношением: FucGal = 1:0,8. Для масс-спектрометрического исследования LgF2 нами были использованы различные способы деполимеризации. Образец LgF2 дезацетилировали, а затем десульфатировали и получили фракцию LgF-DS. При десульфа-тировании наряду с отщеплением сульфатных групп произошла деполимеризация исследуемого фукоидана. Состав образовавшихся при этом олигосахаридов, которые экстрагировали метанолом, анализировали методом МАЛДИ МС. При анализе масс-спектров были обнаружены сигналы ионов фукоолигосахаридов [Fuc +Na]+ (n=2-ll) в режиме регистрации положительных ионов (рис. 3.7) и [FucnS03] (n=2-ll), а также моносульфат фукозы в режиме регистрации отрицательных ионов (рис. 3.8). Присутствие в спектрах сигналов, отстоящих от пиков фукоолигосахаридов на 16, 32,48 Да, показывало наличие в смеси олигомеров ([Fucn mHexm+Na]+; n=4-6, m=l-3 и [Fucn mHexmS03]; n=3-6, m=l-2), состоящих из остатков фукозы и гексозы, идентифицированной как галактоза.
Таким образом, анализ спектров продуктов сольволиза LgF2 показал наличие фукоолигосахаридов со степенью полимеризации до 11 и смешанных олигосахаридов, содержащих в своем составе фукозу и галактозу (например, Fuc3Gal3). Олигосахариды, содержащие уроновую кислоту, отсутствовали.
В МАЛДИ масс-спектрах продуктов частичного кислотного гидролиза (LgF-H180) дезацетилированного образца фукоидана LgF2 (см. рис. 3.9 А,Б) были обнаружены моносульфаты фукозы и галактозы и серия ионов вида [GalnS03Na+Na]+ (n=2-3); [Galn+Na]+ (n=2-5) и [GalnS03]- (n=2-3), полученных в соответствующих режимах регистрации и принадлежащих сульфатированным галактоолигосахаридам со степенью полимеризации от 2 до 5. Сигналы, соответствующие фуко- и смешанным фукогалак-тоолигосахаридам, отсутствовали. Очевидно, фрагменты молекул полисахарида, построенные из остатков фукозы, в условиях кислотного гидролиза разрушаются.
71
| | | m/z С о с т а в | ||||||||
| | 353.12 IFucr-Na]1 | |||||||||
| | 4W.S9 IFucj-HjO+NuJ1 | |||||||||
| | p-^ 478.90 [Fuc3*Na]+ | |||||||||
| | 495.07 [FucHex.+Na]" | |||||||||
| | 580.94 [Fuc^CNa+Na]1 | |||||||||
| | '47V 606.93 [Fuc^-lbOiNar | |||||||||
| | | &25 Q4 &25.04 [Fut4+Na]+ | ||||||||
| | | I Wl.lM [Fu^Hcxi+WaJ | ||||||||
| | | | 657.07 IFu^He^Na]' 727.0S [R^SQjNa+NaJ4 | |||||||
| ■ | | | 753.26 [Futj-H^O+Na]4" 771.29 [Fuc,+Na]+ 787.33 [Facile*,+Na]_ | |||||||
| | | | 771-29 8IB.38 [FucsHe^+Na] | |||||||
| | | | | 889.47 rFWHjO+NuI1 | ||||||
| - | | | | 917:60 [Fuus-Na]1 317ftC M3.7G [FucsHftSi+Nar | ||||||
| | | | | | 949.65 [Fae5l!ex.+Na]' | |||||
| | | | | | 965.8! ("FucjHcxj НЧа]" 1019.89 [Fucf.SO,Na+Na]' | |||||
| | | | | | 1045.96 [FutT-H^O+NaJ4" | |||||
| | | | | | | 1004.C9 iFucT-^aJ1 | ||||
| | | |||||||||
| | | | | | | 1710.44 [FucB+Na]+ | ||||
| 40 - | | | | | | 1356.94 [Fuo-Naf 150391 [Fucm-bNal1 | ||||
| | | | | | | U io 44 1650.60 [Fucnl-Naf | ||||
| 20 - | | 1355.94 1 1503.91 | ||||||||
| | | | | | | | | | | 1650.60 |
| 0 ' | | | | | | | | | ||
800 1000
