Монография исследование водорослей.. Во́доросли. Аутентичного материала
 Скачать 2.99 Mb. Скачать 2.99 Mb.
|
|
| 243.02 | [FucSOrll]- |
| 371.11 | [FuC2S03-H,0-H]- |
| 3X9.00 | [FucsSOj-HT |
| 405.04 | рп*Н«|30*ЛТ |
| 490.93 | [Fuc-,(SQ3Na)SO,-H]- |
| 517.05 | [Fuc3SO3-Ffc0-H] |
| 535.02 | [FucaSOj-H]- |
| 551.08 | [FucHcx.SOj-H]" |
| 56653 | фп&тДОгЯГ |
| 637_0Й | [FiiCj(S03Na)SOrH]- |
| 663.09 | LFucjSO,-H20-H]" |
| 6S1.13 | [РцСцЗОз-НГ |
| 697.12 | [Fuc3Hex,S03-H]- |
| 713.11 | [FwdfeKsSQs-H]' |
| 7S3.13 | [FucfSC^NalSO.-H]- |
| «09.30 | [Fuc3SO}-HjO-H]" |
| 827.25 | [ftffijSOj-HX |
| 843.] 8 | [Flic4Hcx,S03-H]" |
| 859.25 | [FiK.,Hex2S03-H]- |
| 929.27 | [Puc^SOjKajaOj-H]" |
| 973.39 | [FufoSOrHJ |
| 9R9.46 | [Fu^Hex^O^-H]- |
| 1005.49 | [FucjHex.SO^-H]" |
| ] 119,68 | [FuCtSOj-H]- |
| 1265.92 | [Fuc^SOj-H]- |
| ] 43 2-73 | [Fuc4S03-[ 11/ |
| 155S.65 | [FLiCmSOvH]" |
| 1705.87 | |Fuc |SO,-II| |
| 1412.73 ,&63 | |
| | |
30 1600 1800 m/z
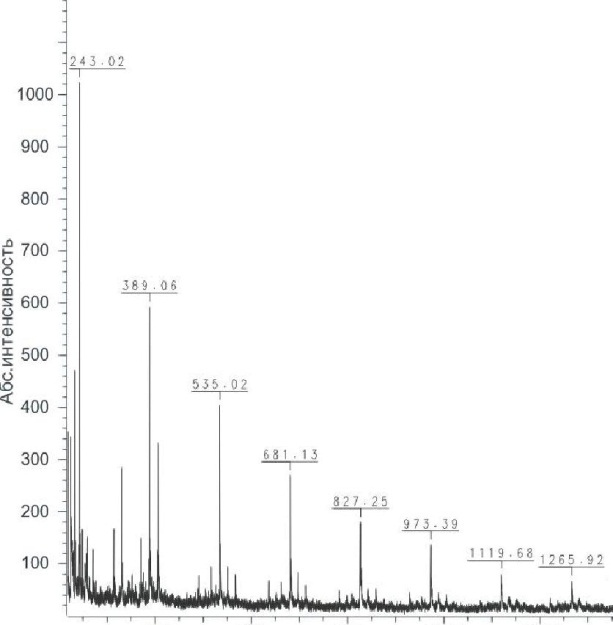
Рис. З.8. МАЛДИ масс-спектр отрицательных ионов низкомолекулярных продуктов, образовавшихся при сольволитическом десульфатировании дезацетилированного
фукоидана LgF2 из S. gurjanovae
Анализ методом МАЛДИ масс-спектрометрии продуктов расщепления фукоидана LgF2 из S. gurjanovae, образовавшихся в процессе сольволитического десульфатирования и частичного кислотного гидро-
72
лиза, позволяет сделать вывод, что фукоидан из S. gurjanovaeявляется сульфатированным галактофуканом, построенном из блоков, состоящих из фукозы и галактозы. Кроме того, из данных МАЛДИ МС следует, что в условиях сольволиза разрушаются предпочтительно фрагменты полисахарида, построенные из остатков галактозы, а при частичном кислотном гидролизе - из остатков фукозы.
■ко ш »
: то
и...
-.LV
400 ■г.-sto ш
|Fuc,SO,NnNi]4
ПчкгТЬГ /
1
IHuiSOjNifyi]'
lL
pbiy*Nn|' [IbiiiSOiNiiN»]*
[Hej,Sft,N**Ni]4
\ Htt, V.|
баз.is «Hi.4
|H(VN»]
1 ■ 1 I 1 1Шг**тИш*
t
xm
asm янн
i-i::i 1ИН
■.ll
п.-/
[Ня|Зоип
|l'j[,4;r, LiUj-H Г
|Р1кжна
[иг, м:.-и1 \
^^y^^^*
Рис. З.9. МАЛДИ масс-спектр положительных ионов (А) и отрицательных ионов (Б) продуктов частичного гидролиза дезацетилированного фукоидана LgF2 из S. gurjanovae
(0,2Н ТФУ, 3 часа, 100° С)
73
Исследование структуры фукоидана из Saccharinacichorioides
Литературная информация о строении фукоидана из S. cichorioides(прежнее название Laminariacichorioides) противоречива. Первой группой исследователей было показано, что исследуемый фукоидан представляет собой практически полностью сульфатированный 1^3-а-Ь-фукан, остатки L-фукозы в котором 2,4-О-дисульфатированы (Zvyagintseva et al., 2003), причем строение основной цепи полисахарида характерно для отряда Laminariales (Phaeosporophyceae) (Cumashi et al., 2007). Согласно данным другой группы исследователей, фукоидан из S. cichorioidesпредставляет собой галактофукан (Fuc:Gal2:l), остатки L-фукозы в котором связаны а-(1^4)-гликозидной связью и сульфатированы в положениях при С2 и СЗ (Yoon et al., 2007). Можно отметить, что существенное содержание галактозы наблюдалось в фукоиданах из водорослей S. japonica(Zvyagintseva et al., 2003), S. gurjanovae(Шевченко и др., 2007) и U. pinnatifida(Lee et al., 2004) также относящихся к отряду Laminariales. При исследовании фукоидана обеими группами исследователей применялись одни и те же методы: десульфатирование и метилирование с последующим анализом производных фукоидана с помощью ЯМР-спектроскопии.
Для анализа фукоидана, выделенного по методу (Zvyagintseva et al., 2003) из S. cichorioides, собранной в шельфовой зоне российского побережья Японского моря, мы применили два метода масс-спектрометрии - тан-демный ИЭР МС в режиме столкновительной диссоциации, который положительно зарекомендовал себя при анализе фукоолигосахаридов из A. nodosumи F. evanescensи тандемный МАЛДИ МС, которым ранее не анализировали сульфатированные фукоолигосахариды в режиме МС/МС отрицательных ионов (точнее режим называется potential lift TOF/TOF, где вторичные ионы образуются при скачкообразном подъеме ускоряющего напряжения и регистрируются вторым времяпролетным анализатором). Использование МАЛДИ МС для полианионных олиго-сахаридов сопряжено с определенными трудностями, поскольку сульфатные группы очень лабильны и могут отрываться в источнике ионов. Нами было найдено, что использование фенилозазона D-эритро-жптозы (arabinoosazone в оригинальной статье (Chen et al., 1997)) в качестве матрицы позволяет минимизировать фрагментацию.
Образец высокосульфатированного фукоидана LcF2 (Fuc, 98%, Man, 2%.), выделенный по методике (Zvyagintseva et al., 2003), был подвергнут автогидролизу. Этанольный экстракт продуктов автогидролиза Lc-AHL (выход 66% от образца LcF2) был проанализирован с помощью масс-спектрометрии ИЭР (рис. 3.10) и МАЛДИ (рис. 3.11) в режиме регистрации отрицательных ионов.
74
I J 8 S
Е I «,-Г1
ё2о Я§
QJf-Ml
220
СЛ
-U±
| 225.007 | [Fuc,S03Na-H20-Na]" |
| 231.010 | [Fuc3(S03Na)3-3Na]3 |
| 234.013 | [Fuc2(S03Na)2-2Na]2- |
| 243.018__[Fu_C|_S0_3_Na-Na]-_279.697'>243.018 | [FuC|S03Na-Na]- |
| 279.697 | [Fuc4(S03Na)3-3Naf |
| 298.037 | [Fuc3(S03Na)2-H20-2Na]2- |
| 307.042 | [Fuc3(S03Na)2-2Naf |
| 328.383 | [Fuc5(S03Na)3-3Na]3" |
| 344.956 | [FuC|(S03Na)2-Nar |
| 371.065 | [Fuc2S03Na-H20-Na]- |
| 380.071 | [Fuc4(S03Na)2-2Na]2- |
| 389.075 | [Fuc2S03Na-Na]- |
| 453.099 | [Fuc3(S03Na)2-2Na]2" |
| 535.131__[Fuc_3_S0_3_Na-Na]-_520_m/zРис.'>535.131 | [Fuc3S03Na-Na]- |
520 m/z
Рис. ЗЛО. ИЭР масс-спектр отрицательных ионов олигосахаридов, полученных автогидролизом фукоидана из бурой водоросли S. cichorioides
и
50 А
0 1|
*i+
| m/z | Состав |
| 225.0 | [Fuc,S03Na-H20-Na]- |
| 243.0 | [Fuc,S03Na-Na]" |
| 344.9 | [Fuc,(S03Na)2-Na]- |
| 371.0 | [Fuc2S03Na-H20-Na]- |
| 389.1 | [Fuc2S03Na-Na]- |
| 473.0 | [Fuc2(S03Na)2-H20-Na]- |
| 491.0 | [Fuc2(S03Na)2-Na]- |
| 517.1 | [Fuc3S03Na-H20-Na]" |
| 535.1 | [Fuc3S03Na-Na]- |
| 619.1 | [Fuc3(S03Na)2-H20-Na]- |
| 637.1 | [Fuc3(S03Na)2-Na]- |
| 739.1 | [Fuc3(SO,Na)3-2Na]- |
| 783.2 | [Fuc4(S03Na)2-Na]- |
| 885.3 | [Fuc4(S03Na)j-2Na]- |
| 929.4 | [Fuc5(S03Na)2-Na]- |
500
Ю |
200
300
400
600
700
800
900 m/z
Рис. 3.11. МАЛДИ масс-спектр отрицательных ионов олигосахаридов, полученных автогидролизом фукоидана из бурой водоросли S. cichorioides
Анализ масс-спектров, полученных двумя методами, дал следующий состав смеси: моносульфат и дисульфат фукозы с m/z243.0 и 344.9 (основные компоненты) и набор олигосахаридов со степенью полимеризации 2—5 и числом сульфатов на молекулу до 3. Стоит отметить, что интенсивность сигнала иона дисульфатированной фукозы с m/z344.9 была выше при регистрации состава смеси методом МАЛДИ МС.
Далее были получены тандемные масс-спектры большинства ионов, находящихся в смеси. Для того, чтобы идентифицировать фрагментные ионы, имеющие одинаковое значение m/z, но возникающие из восстанавливающего либо невосстанавливающего концов молекулы, образец был восстановлен NaBD4. В результате, ионы, сохраняющие заряд на
75
восстанавливающем конце (Y-ионы), имели на 3 Da большую массу и были идентифицированы однозначно. Полученные данные совпали с результатами исследований фрагментации олигосахаридов каррагинана с помощью ИЭР МС/МС, где было четко показано, что наличие сульфатной группы в остатке сахара провоцировало образование соответствующих Y-ионов, в то время как В- и С-ионы могли образовываться при разрыве гликозидных связей также и между несульфатированными остатками Сахаров (Yu et al., 2006). В тандемных масс-спектрах олигосахаридов из S. cichorioid.esС-ионы практически не наблюдались.
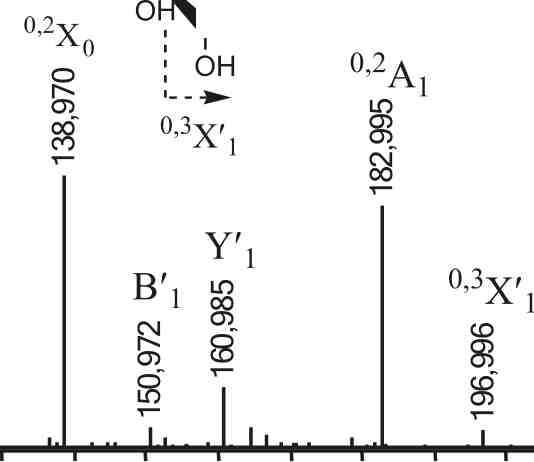
На рисунках 3.12 и 3.13 показаны наиболее информативные тандемные масс-спектры дисульфатированной фукобиозы, полученные разными масс-спектрометрическими методами. Тандемный масс-спектр ИЭР (рис. 3.12) двухзарядного иона [Fuc2(S03Na)2-2Na]2" с m/z234.011 содержал интенсивные сигналы ионов с В с m/z225.007 и Y с m/z243.017 формирующихся при разрыве гликозидных связей. Та же картина повторилась и в тандемном МАЛДИ масс-спектре (рис. 3.13), где интенсивности указанных сигналов примерно совпадали. Отсюда следует, что сульфатные группы находились в среднем по одной на восстанавливающем и на невосстанавливающем остатках фукозы. Сигналы 0,2Х0/0,2А0, имеющие высокие интенсивности в ИЭР МС/МС спектрах фукоолигосахаридов из A. nodosum, содержащих большой процент (1^4)-связанных остатков фукозы, в данных масс-спектрах имеют гораздо меньшие интенсивности, особенно полученных с помощью МАЛДИ МС/МС.
На положение сульфатных групп в остатках фукозы на невосстанавливающем конце дисахарида указывают сигналы 0,2А1 (сульфат при С4), а также группа сигналов 0,3ХГ По всей видимости, интенсивность сигнала 0,2Х зависит от наличия сульфатной группы в положении С2 и она тем меньше, чем выше вероятность сульфатирования при С2, поскольку интенсивности ионов такого типа были высоки в тандемных ИЭР масс-спектрах несульфатированных олигосахаридов (Zhang et. al., 2006) с остатком уроновой кислоты на восстанавливающем конце. Для более протяженных молекул общая картина сохранялась - остатки фукозы были связаны преимущественно (1^3)-связью и сульфатированы в положениях С2 или С2/С4.
Таким образом, в условиях автогидролиза были получены мультисуль-фатированные моно- и олигосахариды, не образующиеся в продуктах деградации с использованием сольволитического десульфатирования. Особенностью тандемных масс-спектров фрагментов фукоидана из S. cichorioidesбыло отсутствие или сверхнизкая интенсивность фрагмент-ных ионов 0,2А/0,2Х, возникающих в случае наличия в смеси структур,
76
содержащих в цепи (1^4)-связанные остатки фукозы, как в случае с фукой даном из A. nodosum(Daniel et al., 2007). Из вышесказанного следует, что исследуемые фрагменты содержали 2- и реже 4-сульфати-рованные (1^3)-связанные остатки фукозы в качестве превалирующей
| | /|--------О. /СН3 |
| | ■o3so |
| он | |
| /1--------О | о d"*Yi |
| -'-03SOy | |
[M(2Na)-2Na]
| | /1--------О, /СН3 |
| ОН | 03SO |
| А--------О | J о \f"Bl |
| с ' н0> | |