Монография исследование водорослей.. Во́доросли. Аутентичного материала
 Скачать 2.99 Mb. Скачать 2.99 Mb.
|
|
Глава 4. Проблемы стандартизации препаратов полисахаридов бурых водорослей Стандартизация полисахаридов кажется нам проблематичной по ряду причин: известно, что разные виды бурых водорослей синтезируют существенно различающиеся по строению полисахариды; отдельный вид водоросли синтезирует характерный для него набор полисахаридов, который может содержать несколько структурных типов фукоиданов, равно как ламинаранов и альгиновых кислот; состав и структура полисахаридов может зависеть от вида и сезона сбора водоросли и, по всей видимости, от ее репродуктивного статуса. Условия процессов предобработки водоросли и экстракции полисахаридов также имеют значение при получении биополимеров. Воспроизводимость стандартных характеристик отдельных препаратов очень важна для создания БАД, пищевых добавок и, в особенности, для лекарств. Поэтому нами большое внимание уделено исследованию влияния вышеперечисленных факторов на состав и структуру полисахаридов водорослей. Влияние эндо- и экзогенных факторов на содержание и структурные характеристики полисахаридов бурых водорослей морей Дальнего Востока России Сведения о влиянии эндо- и экзогенных факторов на композицию и структуру полисахаридов бурых водорослей чрезвычайно ограничены, особенно это относится к фукоиданам, интерес к которым в настоящее время только возрастает. В последние годы активно изучаются разносторонняя биологическая активность, проявляемая фукоиданами, и возможности их использования для создания лекарственных средств и биологически активных добавок к пище. Фукоиданы — сульфатированные полисахариды бурых водорослей, представляют собой чрезвычайно структурно разнородную группу. Непременным и часто главным компонентом молекул большинства из них служат остатки a-L-фукозы, этерифицированные серной кислотой. В составе фукоиданов обычно находят другие моносахариды (галактозу, маннозу, ксилозу, рамнозу, глюкуроновую кислоту), а также ацетильные группы. Анализ литературы показывает, что биологические свойства этих полисахаридов связаны с типами фукоиданов, определяемыми структурой их основной цепи, молекулярной массой, содержанием и расположением сульфатных и ацетатных групп (Cumashi et al., 2007; Li et al., 2008). В настоящее время из бурых водорослей выделили фукоиданы, кото- 95 рые условно можно разбить на структурные типы следующим образом: фуканы (1,3- и 1,3;1,4-а-1-фуканы), саргассаны (галактофуканы), аско-филланы (фукоманноуронаны или фукогалактоманноуронаны) и другие промежуточные структуры (Berteau et al., 2003). В связи с этим возникает серьезная проблема стандартизации препаратов, которая осложняется тем, что состав и структура полисахаридов зависит не только от вида водоросли, но и от других как внешних, так и внутренних факторов. В меньшей степени это касается альгиновых кислот и их водорастворимых аналогов. Установлено, что альгиновые кислоты вегетативных растений состоят, главным образом, из остатков маннуроновой кислоты, и поэтому аналогичны в разных видах водорослей. Генеративные растения накапливают альгиновые кислоты с большим или меньшим содержанием гулуроновой кислоты, что приводит к видоспецифической разнице в структуре и свойствах альгиновых кислот (Jothisaraswathi et al., 2006). Данные о влиянии спороношения на содержание альгиновых кислот в тканях водорослей весьма противоречивы: одни исследователи отмечали накопление этих полисахаридов в фертильных растениях или частях растений, содержащих репродуктивные структуры (Nishide et al., 1988), другие, напротив, нашли снижение содержания альгината в тканях при развитии сорусов (Hosoda, 1979; Apoya et. al., 2002). Сведения о различиях в содержании и структуре фукоиданов в зависимости от вида, сезона или стадии развития водоросли еще более ограничены (Rioux et al., 2009; Honya et al., 1999). Считают, что фуко-иданы являются видоспецифическими полисахаридами, однако сложности со стандартизацией в данном случае связаны с тем, что один вид водоросли может синтезировать несколько типов фукоиданов. Так, из Fucusvesiculosisвыделено 16 фракций фукоиданов, имеющих различный моносахаридный состав (Fitton , 2005). Кроме того, содержание и структура этих полисахаридов претерпевают значительные изменения в течение жизненного цикла водоросли (Имбс и др., 2009; Skriptsova et al., 2010). Honya с соавторами исследовали изменение содержания и моно-сахаридного состава фукоидана из Saccharinajaponicaв зависимости от сезона (Honya et al., 1999). Немногочисленными исследованиями (Усов и др., 20056) показано, что спороношение значительно влияет на состав фукоидана и что наибольшее количество фукоиданов накапливается в репродуктивных органах бурых водорослей. В публикациях (Rioux et al., 2009; Zvyagintseva et al., 2005) изучали влияние возраста растений на содержание фукоидана. Анализ имеющихся в литературе данных о влиянии эндо- и экзогенных факторов на композиции и структуру полисахаридов бурых водорослей позволил нам сделать предположительный вывод о 96 том, что содержание и структура полисахаридов значительным образом могут зависеть от репродуктивного статуса водоросли. В особенности это справедливо для фукоиданов. С целью подтверждения этого предположения нами были выбраны широко распространенные в морях Дальнего Востока водоросли: Saccharinajaponicaf. diabolica, Costariacostata, Undariapinnatifida, Alariaochotensis, Fucusevanescens, Silvetiababingtoniiи Sargassumpallidumдля изучения зависимости моносахаридного состава водорастворимых полисахаридов и, соответственно, содержания фукоидана и ламинарана, а также альгиновых кислот от вида и стадии развития водоросли. Краткая общая характеристика исследованных образцов дана в табл. 4.1. Для стерильной и фертильной тканей семи видов бурых водорослей (S. japonicaf. diabolica, Fevanescens, S. babingtonii, S. pallidum, A. ochotensis), относящихся к разным семействам, был проведен сравнительный анализ содержания полисахаридов (альгиновых кислот, ламинарана и фукоидана) (Skriptsova et al., 2012). Основная часть полисахаридов, выбранных для исследования водорослей, была представлена альгинатами (табл. 2). Наиболее высокое содержание этого полисахарида отмечено у водоросли S. japonicaf. diabolica, находящейся в стерильном состоянии. Содержание альгинатов в остальных образцах бурых водорослей различалось незначительно и находилось, в основном, в интервале от 20 до 30 %. Ранее отмечалось, что содержание альгиновой кислоты в ламинариевых водорослях в среднем выше, чем в фукусовых (Суховеева и др., 2006), эти наблюдения были подтверждены нашими исследованиями (табл. 4.2). Содержание фукоидана в исследованных видах варьировало в широких пределах — от 3 до 25% в расчете на сухую биомассу (табл. 4.2). Минимальное количество полисахарида отмечено в вегетативной ткани S. japonicaf. diabolica— 3,4%. Ранее также отмечалось, что дальневосточные представители порядка Laminariales весьма бедны фукоиданами, содержание которых в тканях водорослей в среднем колеблется от 0,3—1,0 до 3—4% от сухой биомассы (Honya et al., 1999; Аминина и др., 2007; Усов, А. И. и др., 2001). Исключение составляют S. cichorioidesи спорофиллы A.fistulosa, A. marginataи U. pinnatifida, содержание полисахарида в которых может достигать 11; 7,8; 6,7 и 16% от сухой массы, соответственно (Zvyagintseva et al., 2005; Усов, Смирнова и др., 2005; Усов и др., 2001; Skriptsova et al., 2010). В нашем исследовании массовая доля фукоидана у трех видов фукусовых водорослей варьировала в довольно широких пределах: от 7—9% от сухой биомассы у S. pallidum, что было сравнимо с содержанием полисахарида у проанализированных нами видов ламинариевых водорослей, до 25% у S. babingtonii. 97 Таблица 4.1 Общая характеристика проанализированных бурых водорослей
Таблица 4.2 Характеристика водорастворимых полисахаридов, выделенных из некоторых видов бурых водорослей на разных стадиях их жизненного цикла
99
^Результаты спектрофотометрического определения (Skriptsova A.V. et al, 2012),**Опре-деление моносахаридного состава фракций ВЭЖХ после их полного кислотного ги-дролиза,***% от веса сухой водоросли (Skriptsova A.V. et al, 2010),****% от фракции водорастворимых полисахаридов (Имбс Т.И и др., 2009) С целью изучения полисахаридного состава и структурных характеристик фукоиданов в зависимости от репродуктивного статуса водоросли был проведен анализ моносахаридного состава фракций, выделенных из вышеперечисленных водорослей. В гидролизатах общих фракций водорастворимых полисахаридов, экстрагированных из 5 образцов водорослей, преобладала фукоза, доля которой варьировала от 17% у Л. ochotensisдо 70—80 % у Е evanescensи S. babingtonii(табл. 4.2). В экстрактах из A. ochotensisи фертильных образцов S. japonicaf. diabolicaпреобладала глюкоза, по мольной доле которой можно судить о содержании ламинарана в водорослях. Мольная доля глюкозы в этих водорослях достигала 40—59 и 14—47%, соответственно, тогда как у других исследованных видов эти значения не превышали 10%. Ранее было высказано предположение, что развитие репродуктивных структур в водорослях оказывает существенное влияние на их полисаха-ридный состав (Имбс и др., 2009; Skriptsova et al., 2010). Сравнительный анализ показал, что содержание фукоидана в фертильных образцах всех исследованных видов было значительно выше, чем в стерильных, за исключением S. pallidum. Содержание фукоидана в этой водоросли, как в вегетативных талломах, так и в слоевищах с развитыми рецептакулами значимо не различалось (табл. 4.2). Степень увеличения массовой доли фукоидана в тканях растений в период размножения зависела от вида водоросли. Так, если у F. evanescensи S. japonicaf. diabolicaсодержание полисахарида в фертильных растениях (или частях растений для S. japonica) 100 было почти в 2 раза выше по сравнению со стерильными, то у A. ochotensisи S. babingtonii— лишь в 1,3 и 1,5 раза, соответственно (табл. 4.2). Моно-сахаридный состав водорастворимых полисахаридов при формировании репродуктивных структур (органов) также зависел от видовой принадлежности водорослей. Например, у обоих исследованных представителей сем. Fucaceae (F. evenscensи S. babingtonii) как стерильные, так и фертильные растения синтезировали относительно гомогенный фукоидан с преобладанием фукозы, доля которой при развитии генеративных структур (в генеративных растениях) менялась незначительно (табл. 4.2). Вегетативные особи трех других исследованных видов водорослей (A. ochotensis, S. japonicaf. diabolicaи S. pallidum) синтезировали более гетерогенный по моносахаридному составу фукоидан. Среди моносахаридов также доминировала фукоза (табл. 4.2). Сульфатированные полисахариды, выделенные из фертильных образцов S. pallidumи A. ochotensis, характеризовались более высоким содержанием галактозы и фукозы по сравнению со стерильными и фактически представляли собой галактофуканы. Для S. japonicaf. diabolica— в образцах, содержащих генеративные ткани, фукозы и маннозы было меньше, чем в вегетативных тканях (табл. 4.2). Для всех исследованных видов характерно снижение доли маннозы в полисахариде с развитием репродуктивных структур (органов): в среднем содержание маннозы относительно фукозы уменьшалось в 1.5—3 раза (табл. 4.2). Исследования сезонной динамики содержания и структурных характеристик фукоиданов, а также их изменения в зависимости от репродуктивного статуса водоросли были проведены в ТИБОХ на примере широко распространенных на Дальнем Востоке видов бурых водорослей С. costataи U. pinnatifida(порядок Laminariales). С. costata— это однолетнее растение. В Приморье в мае-июне у этой водоросли появляется спороносная ткань, созревание зооспор водоросли завершается в июне-июле, затем происходит их рассеивание, и к августу слоевища водоросли разрушаются (Пржеменецкая (Макиенко), 1988). В течение такого короткого вегетационного периода, а именно, с апреля по июль содержание фукоидана в С. costataувели- Рис 4 л Динамика С0Держания фу-чилось в 5 раз (рис. 4.1) (Имбс и др., 2009). коидана> ламинарана и уронана в с При этом изменялся моносахаридный С0$Шав зависимости от месяца сбора состав фукоидана - от гетерофукана, состо-
101 ящего из фукозы, галактозы, ман-нозы и рамнозы (Fuc:Gal:Man:Rha = 1,0:0,3:0,4:0,2) в апреле—мае, до галактофукана в июне—июле (рис. 4.2). Содержание сульфатов в наблюдаемый период увеличилось более чем в 5 раз (рис. 4.2). На примере С. costataбыло показано, что молекулярная масса фуко-идана заметно уменьшается по мере созревания водоросли (рис. 4.3). Обнаруженная закономерность особенно интересна в связи с тем, что полисахариды с более низкой молекулярной массой предпочтительнее в качестве биологически активных веществ, т.к. их введение в организм высших животных вызывает меньше нежелательных 65 60 55 50 45 39 40 1 35 Щ » 30 ё 26 20 15 10 5 О -о— SCbNa* —А— Flic ^^Gal -О— Man -•— Rha -ш—Gfc ■О- Xyl 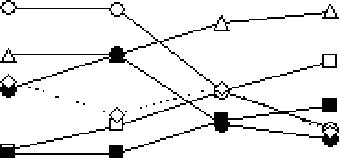 Рис. 4.2. Изменение моносахаридного состава (Fuc, Gal, Man, Rha, Xyl, Glc (% от суммы нейтральных моносахаридов)) и сульфатов (% от веса фракции) во фракциях водорастворимых полисахаридов водоросли С. costataв зависимости от месяца сбора эффектов (Kulicke et al., 1997). Оптимум молекулярных масс для биологически активных полисахаридов расположен в области невысоких значений от 10 до 100 кДа. Так, фукоиданы, проявляющие антикоагу- лянтную активность, имеют молекулярные массы от 50 до 100 кДа (Nagumo et al., 1996). Аналогичные исследования были проведены для U. pinnatifida— водоросли, имеющей очень широкий ареал распространения. Эта водоросль, как и С. costata, характеризуется коротким вегетационным периодом. В отличие от С. costata, U. Рис. 4.3. Молекулярно-массовое распределение pinnatifidaимеет морфологи-фукоиданов из майского (а) и июльского (б) об- чески разграниченные части разцов водоросли С. costata. Разделение фукоида- таллома: вегетативную (планов проводили на последовательно соединенных стина) И репродуктивную колонках Shodex Asahipak GS-520 HQ и GS-620 (спорофиллы) И, благодаря HQ (7,5 X 300 мм) этому, служит удобным объ-
102 ектом для исследования физиологии и химического состава участков слоевища, выполняющих разные функции. Ранее для U. pinnatifidaбыло показано, что во время роста с ней происходят значительные морфологические изменения: меняются весовые соотношения листовой пластины и спорофилл в цельном талломе водоросли (Skriptsova et al., 2004). Листовая пластина составляет основную часть веса таллома в период с апреля по июнь. В период спороношения U. pinnatifidaспорофиллы составляют до 76% от веса цельного таллома водоросли. В литературе относительно состава и строения полисахаридов U. pinnatifidaимеются разрозненные данные. Ранее из разных частей этой водоросли выделили фукоиданы различных структурных типов, которые показали разнообразную биологическую активность. Спорофиллы U. pinnatifidaсодержали преимущественно сульфатированные галактофуканы, в то время как цельные талломы водоросли синтезировали смесь полисахаридов галактофуканового и аскофилланового структурных типов. Нашими исследованиями было показано, что содержание фукоидана в U. pinnatifidaс апреля по июль увеличилось в 5 раз, достигнув максимума к июлю, когда спорофиллы составляли основную часть таллома водоросли (рис. 4.4) (Skriptsova et al., 2010). При этом значительно изменился моносахаридный состав фукоидана: содержание Gal увеличилось, Man — заметно уменьшилось, а содержание Fuc практически не изменилось (рис. 4.5). Мольное отношение FucGal изменилось от 1,0:0,34 в апреле до 1,0:0,69 в июле. В апреле U. pinnatifidaсинтезировала гетерофукан, содержащий, помимо фукозы, примерно одинаковые количества маннозы и галактозы, а в июне—июле — фу-коидан, представляющий собой галактофукан (рис. 4.5). Ж В о R К ° о н D s 3 о ^ 20 15 10 Апрель Май Июнь Июль Рис. 4.4. Содержание фукоидана (% от сухой обезжиренной водоросли) в бурой водоросли U. pinnatifidaв зависимости от месяца сбора Таким образом, наибольшее количество фукоидана содержалось в июльском образце водоросли, когда спорофиллы составляли основную часть таллома. Изучение моносахаридного состава фукоидана U. pinnatifidaпоказало, что в разные месяцы водоросль синтезировала фукоиданы различных структурных типов: в апреле—мае — сульфатированный гетерофукан, содержащий наряду с фукозой большие количества маннозы (до 30%) и галактозы (до 25%), в июне—июле — фукоидан, представля- 103 {-о к к ой Он и И О ш о £ 70 I60 ё 50 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
