Монография исследование водорослей.. Во́доросли. Аутентичного материала
 Скачать 2.99 Mb. Скачать 2.99 Mb.
|
|
§ 40 с И 30 д S 20 I Man □ Fuc D Gal 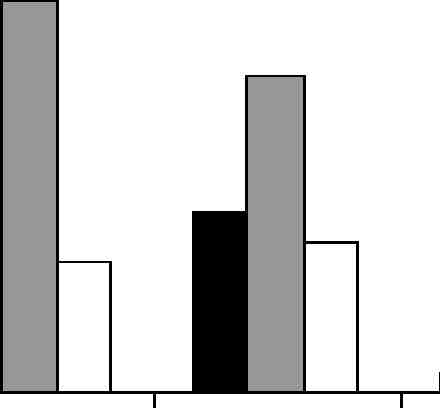 Апрель Май Июнь Июль Рис. 4.5. Динамика моносахаридного состава фукоидана бурой водоросли U. pinnatifida в зависимости от месяца сбора ющий собой сульфатированный галактофукан с содержанием маннозы не более 5—7%. Изменения с апреля по июль в содержании и моносахаридном составе фукоидана водорослей С. costataи U. pinnatifidaмогут быть связаны как с изменениями внешних условий в течение года (температура, концентрация биогенных элементов, освещенность), так и с эндогенными причинами (рост, сопровождающийся морфологическими изменениями талломов, спороношение). Естественно было предположить, что основной причиной изменений в содержании и моносахаридном составе фукоидана водорослей С. costataи U. pinnatifidaможет быть формирование спорангиев, т.е. изменение репродуктивного статуса водоросли. Репродуктивный статус взрослых растений определяется наличием (фертильное состояние) или отсутствием (стерильное состояние) сорусов. В отличие от С. costata, у которой, как у большинства видов бурых водорослей порядка Laminariales, спорангии образуются на поверхности пластины, U. pinnatifidaимеет спорофиллы — специализированный орган, где формируются и созревают споры, и который можно отделить от основного растения. Июньские сборы водоросли С. costataсодержали смесь фертильных и стерильных особей. Нами были отобраны талломы водоросли со зрелыми спорангиями и из них выделена фракция водорастворимых полисахаридов (ВПбферт). Фракция ВПбферт содержала самый высокий процент фукоидана по сравнению с фракциями ВПбст (стерильные особи) и ВПб (смесь фертильных и стерильных особей) (табл. 4.3). Анализ данных (табл. 4.3) показывает, что для С. costataимеется прямая связь между 104 повышением содержания фукоидана во фракции водорастворимых полисахаридов с формированием репродуктивных органов. Таблица 4.3 Характеристика фракций водорастворимых полисахаридов (ВП) из С. costata, собранной в разные месяцы (май (5), июнь (6), июль (7)) и стадии жизненного цикла (фертильные (ферт) и стерильные (ст))
* — % от веса фракции ВП. Спорогенез U. pinnatifidaв заливе Петра Великого начинается в конце мая, когда температура воды поднимается до 14°С (Skriptsova et al., 2010). В это время популяция U. pinnatifidaсостоит из фертильных и вегетативных взрослых (с развитыми спорофиллами) растений. Нами были отобраны взрослые растения с развитыми спорофиллами, но имеющие разный репродуктивный статус: фертильные, имеющие спорофиллы с развитыми сорусами, и вегетативные, спорофиллы которых не содержали парафиз или спорангиев. Из спорофилл этих растений были выделены фракции фукоиданов. В спорофиллах фертильных особей содержание фукоидана (15%) было в 5 раз выше, чем в вегетативных растениях (3%). Сравнение моносахаридного состава фукоидана С. costata, полученного из образцов водоросли без сорусов (фракция ВПб) и со зрелыми спорангиями (фракция ВПбферт.) (рис. 4.6), показало, что при переходе С. costataк спороношению в полисахариде увеличилась доля фукозы и галактозы и значительно уменьшилась доля маннозы и рамнозы (с 18 до 4 мол% и с 13 до 2 мол%, соответственно). Мольное отношение моносахаридов Fuc:Gal:Man:Rha в фукоиданах, выделенных из вегетативного и генеративного растений, изменилось от 1,0:0,3:0,4:0,2 до 1,0:0,3:0,05:0,03, соответственно. Содержание сульфатов выросло в 3 раза (табл. 4.3). В 105 итоге можно сделать вывод, что фукоидан из С. costataсо зрелыми спорангиями представляет собой сульфатированный галактофукан, тогда как вегетативные особи синтезируют фракции низкосульфатированных гете- щ I S ео (-о о4 о о 50 -40 30 20 -10 Ш □ Fuc □ Gal ■ Man ИБЪа без сорусов с сорусами Рис. 4.6. Моносахаридный состав фукоидана из С. costata с сорусами и без сорусов рополисахаридов, состоящих из рамнозы, маннозы, галактозы и фукозы. В фукоидане из спорофилл U. pinnatifidaтакже наблюдались изменения в составе нейтральных моносахаридов при переходе водоросли к
К 60 50 40 30 20 10 Г*1 ± I □ Fuc □ Gal ■J-i ИМап без сорусов с сорусами Рис. 4.7. Моносахаридный состав фукоидана из спорофилл U. pinatifidaс сорусами и без сорусов 106 спороношению (рис. 4.7). Содержание маннозы уменьшилось практически в 5 раз (с 16 % в вегетативном до 3,4 % в генеративном растениях). С развитием сорусов в растениях в моносахаридной композиции увеличилось содержание галактозы (с 27 до 43 мол %), содержание фукозы не изменилось, по-этомумольное отношение Fuc:Gal изменялось от 1,0:0,51 в вегетативном до 1,0:0,80 в генеративном растениях. Таким образом, при переходе водоросли к спороношению моносахаридный состав фукоидана как в С. costata, так и в 17. pinnatifidaсущественно изменяется: в вегетативных растениях содержатся преимущественно низкосульфатированные гетерополисахариды, построенные из маннозы, фукозы и галактозы, а в генеративных - высокосульфатированные полисахариды, состоящие, в основном, из галактозы и фукозы. В целом полученные для водорослей С. costataи U. pinnatifidaданные хорошо согласуются с результатами исследований, проведенных нами для других водорослей (Skriptsova et al., 2012): по мере созревания и развития сорусов содержание фукоидана в растениях увеличивалось до 5 раз; одновременно происходили существенные изменения в молекулярно-массовом распределении, моносахаридном составе, в результате фертильные растения синтезировали менее гетерогенный по моносахаридному составу фукоидан по сравнению с вегетативными особями (Имбс и др., 2009; Skriptsova et al., 2010). Общей структурной закономерностью для сульфатированных полисахаридов всех исследованных нами видов было увеличение в них доли фукозы и снижение доли маннозы при переходе водорослей из вегетативного в репродуктивное состояние, за исключением S. japonicaf. diabolica. За счет этого уменьшалась гетерогенность моносахаридного состава. Анализ собственных и литературных данных показывает, что увеличение содержания фукоидана и изменение его моносахаридного состава в процессе репродукции является общей закономерностью для бурых водорослей. Структурные перестройки полисахарида при спороношении, по-видимому, являются видоспецифичными. Изменение направленности биосинтеза сульфатированных полисахаридов при репродукции характерно также для красных водорослей (Yermak et al, 2006; Барабанова и др., 2005). Увеличение содержания фукоидана с началом спороношения как у С. costata, так и у U. pinnatifida, равно как и у других исследованных бурых водорослей позволяет предположить, что фукоидан необходим для нормального функционирования спорообразующих тканей или фукоидан участвует в высвобождении спор. Изменение моносахаридного состава позволяет сделать вывод, что структура фукоидана также может быть связана с его физиологической ролью при развитии органов размножения 107 и/или выходе спор или гамет. Ранее было показано, что фукоиданы формируют слизистые «шапочки» спорангиев ламинариевых водорослей (Evans, 1973) и слизистые «пробки» в остиолах концептакулов F. serratus (Green, 1993). Гистохимически фукоиданы определяются как основной компонент внеклеточного матрикса (ВКМ) концептакулов. Концентрация этих полисахаридов в ВКМ концептакулов в десятки раз выше, чем в межклетниках сердцевины (Speransky et al., 1999; Speransky, 2001). Предполагается, что фукоиданы, благодаря их гигроскопичности, помогают высвобождению репродуктивных клеток (Evans, 1973). Согласно существующему мнению, одновременный выход гамет фукусовых водорослей обеспечивается мгновенным одновременным набуханием ВКМ концептакулов, что приводит к выталкиванию гамет (Paerson et al., 1988). Предполагается, что фукоиданы могут выступать как защитные агенты, особенно в репродуктивных органах, которые, как известно, являются наиболее чувствительными к негативному воздействию среды. Предположительно, благодаря своим антиоксидантным свойствам (Xue et al., 2001; Wang et al., 2008; Wang et al., 2010) фукоиданы в естественных условиях могут защищать растения от оксидативного стресса, вызванного флуктуациями температуры, света, солености и др. Предполагается также экранирующая функция фукоида-на против высокой интенсивности света и ультрафиолетовой радиации (Holtkamp, 2009). Возможно, поэтому репродукция водорослей связана с изменением содержания, состава и строения их полисахаридов. Приведенные выше факты позволяют утверждать, что накопление фукоидана при репродукции является общей закономерностью для бурых водорослей. Очевидно также, что в процессе спороношения происходят структурные изменения фукоиданов: моносахаридный состав становится менее гетерогенным, возможны также уменьшение молекулярной массы и увеличение степени сульфатирования синтезируемых водорослями фукоиданов. В итоге можно сделать вывод, что бурые водоросли, находящиеся в фертильном состоянии, синтезируют в больших количествах менее гетерогенный и более суль-фатированный фукоидан по сравнению с вегетативным состоянием. Принимая во внимание, что биохимический состав водорослей варьирует в зависимости от стадии жизненного цикла и экологических условий, изучение влияния эндо- и экзогенных факторов на содержание и структуру фукоиданов, установление закономерностей их изменений, определение физиологического периода, когда водоросль синтезирует фукоидан, обладающий постоянными структурными характеристиками и определенной биологической активностью, имеет практическое значение. Подобные исследования необходимы 108 для определения оптимальных сроков сбора водорослей с целью стандартизации препаратов полисахаридов, поскольку стандартизация — непременное условие для создания БАД или лекарств на основе новых соединений. Глава 5. Технологии переработки бурых водорослей Бурые водоросли составляют основу растительности морей России, запасы их огромны, число видов водорослей превышает полторы тысячи, и являются основным источником органического вещества в прибрежной зоне наших морей. Водоросли этого отдела включают наибольшее количество промысловых и потенциально промысловых видов, важнейшими из которых являются ламинариевые и фукусовые. Вовлечение водорослей в переработку требует глубоких знаний о химическом составе используемого сырья. По своему химическому составу бурые водоросли значительно отличаются от водорослей других отделов и наземных растений. Они содержат уникальные по структуре и биологическому действию соединения, среди которых важное место занимают полисахариды: ламинараны (1,3;1,6-(3-В-глюканы), альгина-ты (сополимеры маннуроновой и гулуроновой кислот) и фукоиданы (высокосульфатированные гомо- и гетерополисахариды). Существенный вклад в положительное влияние бурых водорослей на организмы вносят именно полисахариды — альгиновые кислоты как энтеросор-бенты, ламинараны как иммуномодуляторы и антиопухолевые агенты и фукоиданы как антикоагулянты, иммуномодуляторы, антивирусные, антибактериальные и антиопухолевые агенты. При получении из водорослей продуктов питания или широко используемой альгиновой кислоты, ламинараны и фукоиданы попадают в отходы производства. Учитывая огромные запасы бурых водорослей и их видовое разнообразие, они все чаще рассматриваются как потенциально важный источник этих биологически активных соединений. Известно, что качественный состав бурых водорослей достаточно стабилен, однако в количественном отношении он значительно изменяется от одной таксономической группы родов к другой, а в пределах одного рода — от вида к виду. Даже в пределах одного и того же вида количественный состав химических веществ водорослей зависит от многих факторов: возраста, физиологического состояния, условий обитания, сезона сбора и пр. (см. главу 4). Поэтому при организации переработки бурых водорослей с целью получения лечебных или лечебно-профилактических препаратов, необходимо использовать достаточно гибкие технологические схемы, позволяющие извлекать все ценные компоненты из бурых водорослей с учетом большой вариабельности их состава. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
