Монография исследование водорослей.. Во́доросли. Аутентичного материала
 Скачать 2.99 Mb. Скачать 2.99 Mb.
|
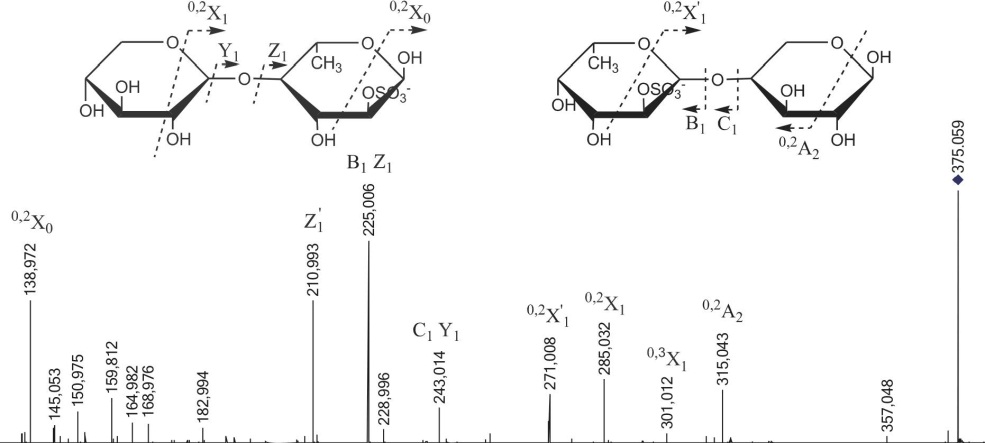
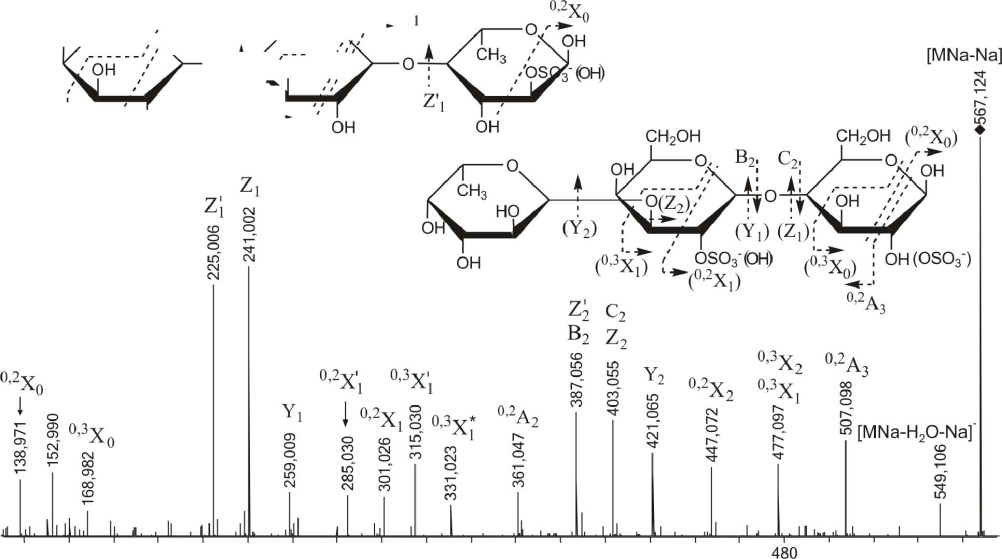
с m/z535.131 были похожи, поэтому мы привели анализ МС/МС спектра последнего иона (рис. 3.19). Наиболее интенсивными ионами МС/МС спектра были сульфатированная фукоза (m/z243.017) и ее дегидратированная форма (m/z225.007), образовавшиеся в результате разрыва гликозидных связей.
с m/z243.016 (данные не приведены) дал результаты, согласующиеся с полученными ранее для A. nodosum(Daniel et al., 2007). Интенсивность иона 0>2А с m/z182.996 (фрагмент 4-О-сульфатированной фукозы) была примерно в 2 раза ниже, чем интенсивность иона 0,2Х с m/z138.971 (фрагмент 2-О-сульфатированной фукозы). Полученные результаты согласуются с литературными данными (Bilan et al., 2002, Kusaykin et al., 2006), из которых следует, что остатки фукозы в в фукоидане из Е evanescensсульфатированы в основном при С2. |
Фрагментационные картины наиболее интенсивного иона [Fuc2S03Na-Na]
В спектре были найдены менее интенсивные фрагментные ионы с m/z389.074 и 371.065, соответствующие сульфатированной фукобиозе и ее дегидратированной форме. Кроме того, имелись сигналы ионов °'2Х0 и 0,2Х , получающиеся в результате двойного разрыва моносахаридного кольца с m/z138.971 и с m/z285.029, которые также давали информацию о сульфатировании гидроксилов при С2 остатков фукозы на восстанав-
84
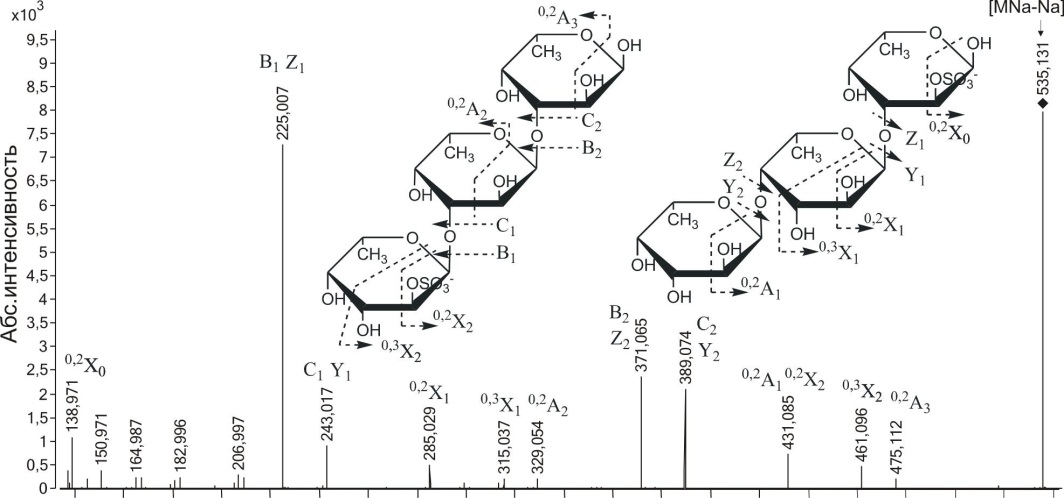
Рис. 3.19. Тандемный ИЭР масс-спектр иона [Fuc3S03Na-Na]- с m/z535.131
ливающем конце и соседнего с ним. Фрагментный ион 0,2Х2 с m/z431.085 возникал из сульфатированного при С2 остатка фукозы, находящегося на невосстанавливающем конце. Присутствие фрагментного иона малой интенсивности с m/z182.996 свидетельствовало о 4-О-сульфатировании невосстанавливающего остатка фукозы. Фрагментные ионы, несущие информацию о 4-О-сульфатировании других остатков фукозы в оли-гомере, обнаружены не были. Ион °'2А2 низкой интенсивности с m/z329.054 (по сравнению с ионом 0>2Х2 с m/z431.085, полученным из невосстанавливающего остатка со свободным гидроксилом при СЗ) давал информацию о вероятности (1^3)-связи между остатками фукозы на невосстанавливающем конце (рис. 3.19, слева). Однако, МС/МС спектр содержал ионы 0,3Х1 с m/z315.037 и 0,2Х1 с m/z285.029, указывающие на наличие (1^4)-связи между этими же остатками (рис. 3.19, справа). Ион очень низкой интенсивности 0,2А3 с m/z475.112 и вышеупомянутый 0,2Х0 свидетельствовали о вероятности (1^3)-связи между остатками фукозы, находящимися на восстанавливающем конце. Таким образом, методом МС/МС обнаружены фрагменты фукоидана, построенные из сульфатированных остатков фукозы с чередующимися (1-»3)- и (1->4)-связями, что также находится в соответствии с результатами предыдущих исследований (Kusaykin et al., 2006). Анализ более протяженных сульфатированных фукоолигосахаридов не дал столь четких результатов из-за большого количества шума в спектре и сложности в интерпретации.
Использование тандемной масс-спектрометрии позволило установить структурное значение в фукоидане из F. evanescensеще одного минорного компонента - галактозы. МС/МС спектр иона с m/z259.018, соответствующего [GalS03Na-Na]", давал информацию о С2 и С4/С6 сульфатировании
85
хЮ 3.4-1
3,2^
3 I 2,8^
2,6^
^2,4
8 2,2
I
1 2
ff 1.6
ii,4
ё1,2 < 1
0,8^ 0,6^ 0/N
0,2^
oJ
CH2OH ' Al CH2OH
-о//"*" Л-—ov/
Hid ,.il 1.1
MX, 0,2Y
CH2OH ,.*J CH2OH _A^
-О'' V, 7 J--------О /
■\ .J- r2/ К ОН
°>3X,
[MNa-Na]"
130 140 150 160 170 180 190 200 210 220 230 240 250 260 270 280 290 300 310 320 330 340 350 360 370 380 390 400 410 420 430 m/Z
Рис. 3.20. Тандемный ИЭР масс-спектр иона [Gal2S03Na-Na]" с m/z421.060
остатков галактозы. МС/МС спектр иона [Gal2SO Na-Na] с m/z421.060 (рис. 3.20) содержал интенсивный фрагментный ион с m/z241.000 и менее интенсивный с m/z259.012. Образование этих ионов связано с разрывом гликозидных связей и отщеплением дегидратированного остатка сульфа-тированной галактозы и сульфатированной галактозы соответственно.
Ион 0,2Х0 с m/z138.970 указывал на сульфатирование остатка галактозы на восстанавливающем конце при С2. Фрагментные ионы 0,2Х с m/z301.022 и 0,3Х1 с m/z331.032 свидетельствовали о 2-О-сульфатировании остатка галактозы, находящегося на невосстанавливающем конце. Фрагменты, характерные для сульфатирования остатка галактозы при С4, отсутствовали. Таким образом, МС/МС-анализ позволил обнаружить и установить структуру галактозосодержащих фрагментов фукоидана: Gal2S03--(l-H)-Gal и Gal-(l->4)-Gal2S03.
Галактоза входила также в состав смешанного дисахарида [Fu^Ga^SO^a-Na] с m/z405.070, присутствующего в МС-спектре. Как и в случае с предыдущими сульфатированными дисахаридами, этот ион содержал несколько изомеров, различающихся положением в них моно-сахаридных остатков и сульфатных групп. МС/МС спектр (рис. 3.21) содержал интенсивные ионы с m/z225.007 и 241.003, образование которых связано с разрывом гликозидных связей и отрывам сульфатированных остатков дегидратированной фукозы и галактозы. Фрагментные ионы 0,2Х-типа с m/z285.029 и 301.021 указывали на 2-О-сульфатирование невосстанавливающих остатков фукозы и галактозы.
Фрагментный ион оаА с m/z198.992 (на рисунке не отмечен) указывал на 4-О-сульфатирование невосстанавливающего остатка галактозы,
86
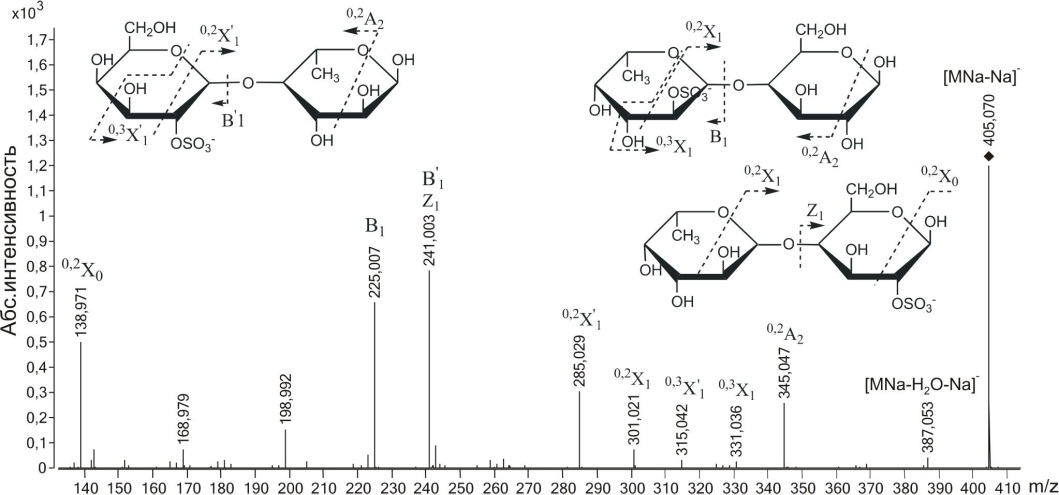
Рис. 3.21. Тандемный ИЭР масс-спектр иона [FuCjGaljSC^Na-Na]- с m/z405.070
следов 4-О-сульфатирования остатков фукозы не обнаружено. Присутствие ионов 0,2А2 с m/z345.047 и 0,2Х0, указывает на наличие (1^4)-связи, однако наличие (1-*3) -связи не может быть исключено, т.к. в таком случае, как уже было неоднократно отмечено, не образуются фрагментные ионы 0>2Х и 0>2А. Наличие иона 0>3Х0 с m/z168.979 также подтверждает присутствие структурного варианта Fuc-(1^4)-Gal-2-S03- в исследуемой смеси, т.к. для остатков сульфатированной галактозы вероятность фрагментации по типу 0,3Х была выше, чем для остатков фукозы (см. описание МС/МС спектра сульфатированной галактозы). Таким образом, масс-спектрометрический анализ показал наличие в смеси ионов Gal-(1^4)-Fuc-2-S03-, Gal-2-S03"-(l-H)-Fuc и незначительное количество Fuc-(1^4)-Gal-2-S03. Остаток галактозы на невосстанавливающем конце может быть сульфатирован при С4.
Картина масс-спектрометрической фрагментации иона [Fuc1Gal2S03Na--Na]
| m/z | Состав |
| 243.02 | [Fuc,S03Na-Na]" |
| 371.07 | [FucjSOjNa-HjO-NaJ |
| 389.08 | [Fuc2SO,Na-Na]" |
| 473.01 | [Fuc2(S03Na)2-H20-Na]' |
| 491.02 | [Fu^(S03Na)2-Na]" |
| 507.00 | [FuciGal,(S03Na)2-Na]" |
| 592.95 | [FuQ2(S03Na)3-Na]- |
| 608.90 | [FuclGall(S03Na)3-Na] |
| 783.12 | [FuC4(S03Na)2-Na]" |
| 885.07 | [Fuc4(S03Na)3-NaT |
| 987.01 | [Fuc4(S03Na)4-NaT |
| 1088.96 | [Fuc4(S03Na)5-NaT |
| 1177.20 | [Fuo;(S03Na)3-NaT |
400
600
800
1000
1200 m/z
Рис. 3.23. МАЛДИ масс-спектр отрицательных ионов олигосахаридов, полученных автогидролизом фукоидана из бурой водоросли F. evanescens
88
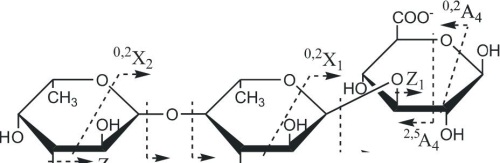
Структурные характеристики олигосахаридов были установлены с помощью МАЛДИ МС/МС. Основной компонент смеси — дисульфа-тированная фукобиоза имела преимущественно (1^4)-гликозидную связь между остатками фукозы (Anastyuk et al., 2012). Ее тандемный масс-спектр представлен на рисунке 3.24.
100J
гсбСН
0
Na03SO
°'2А2 gj
В]
о
Y,
°'2ХЛ
hso;
т- О)
I о
со
0,2Х,
В', аэ со
см
\
[M(2Na)-NaHS04-Na] I °<2Х',
т- СО h- CO СО СО
jjkb.
М*
100 150 200 250 300 350 400 m/z
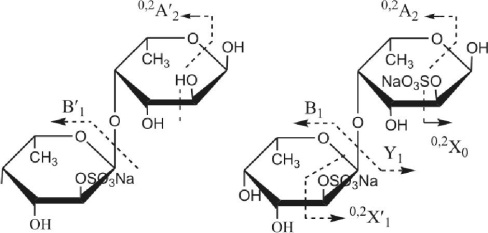
Рис. 3.24. Тандемный МАЛДИ масс-спектр иона [Fuc (SO Na)2-Na]" c m/z491.0
По характеру интенсивностей фрагментных ионов масс-спектр оказался более похож на тандемный масс-спектр дисульфатированной фукобио-
зы, выделенной из фукоидана А.
P^laOsSOv'
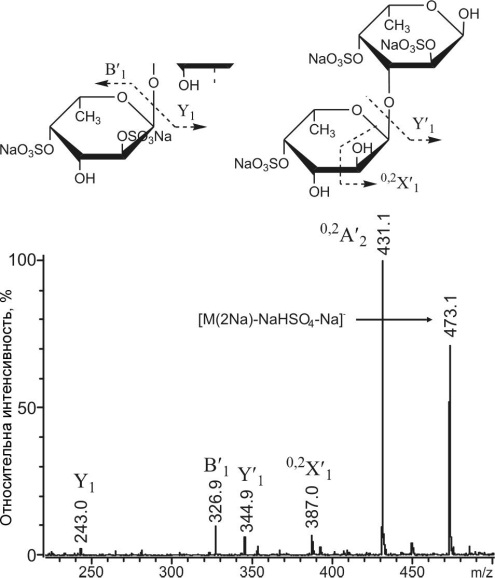
Рис. 3.25. Тандемный МАЛДИ масс-спектр иона [Fuc,(SO,Na),-Na]- с m/z593.0
nodosum, где авторами было отмечено существенное количество (1^4)-связанных остатков a-L-Fucp. (Daniel et al., 2007) При этом, из спектра не следовало, есть ли в смеси (1^3)-связанные остатки a-L-Fucp.
Этот вопрос был снят при анализе иона трисульфатированной фукобиозы с m/z593.0. (рис. 3.25). Благодаря наличию дополнительной сульфатной группы, мы смогли наблюдать Y-ион с m/z344.9, соответствующий отщеплению дважды сульфатированного остатка фукозы с восстанавливающего конца молекулы. Поскольку в фу-
89
коидане из F. evanescensсульфатирование при СЗ остатка ct-L-Fucp не было обнаружено (Bilan et al., 2002), был сделан вывод о присутствии некоторого количества (1^3)-связанных остатков ct-L-Fucp (рис. 3.24).
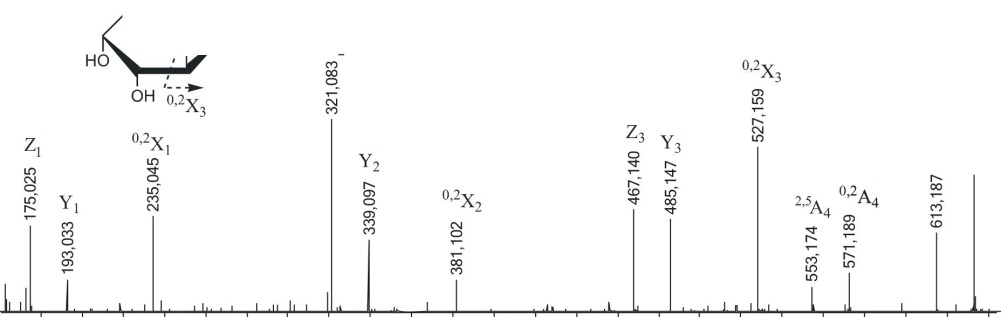
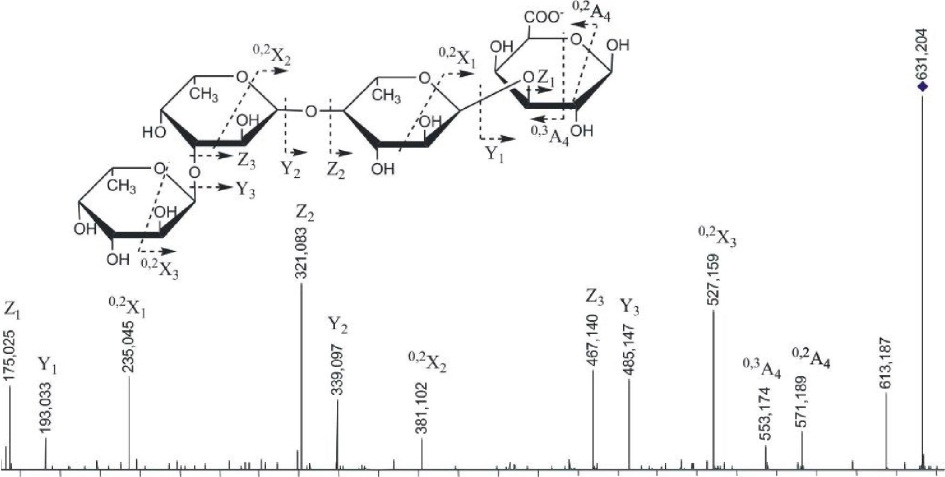
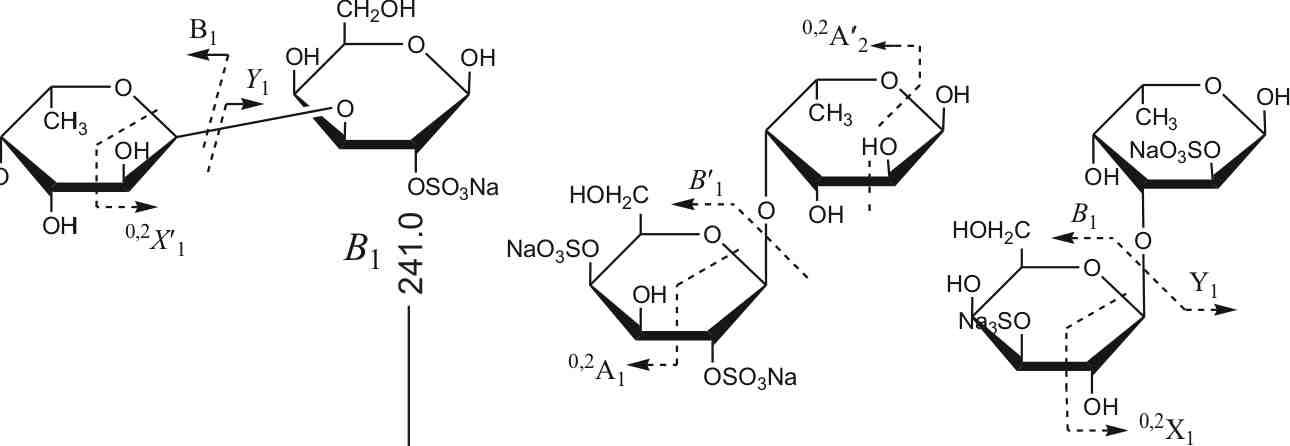
Остатки гексозы (D-Gal) были обнаружены в составе ди- и трисульфа-тированных дисахаридов типа FucHex. По результатам анализа тандемно-го масс-спектра (рис. 3.26), было предложено 3 варианта строения дисаха-рида: Gal-2-OS03Na-(l->3)-Gal-2-OS03Na, Gal-2,4-flH-OS03Na-(l->4)-Fuc и Fuc-2-OS03Na-(1^4)-Gal-2-OS03Na. Полученные данные дополняют результаты работы (Anastyuk et al., 2009), в которой мы наблюдали только моносульфатированные остатки галактозы. Стоит отметить, что указанные остатки (рис. 3.25) находились преимущественно на невос-станавливающем конце молекулы. Более протяженные и более сульфа-тированные олигосахариды также были проанализированы с помощью тандемной МАЛДИ МС (Anastyuk et al., 2012). Они были построены из чередующихся 3- и 4-связанных остатков ct-L-Fucp, сульфатированных в положении С2, реже С4 в случае некоторых (1 ^3)-связанных остатков фукозы. (1-»4)-Связанные остатки фукозы преимущественно находились на восстанавливающем конце молекул и были слабо сульфатированы. По всей видимости, в условиях автогидролиза в первую очередь расщепляется именно (1^3)-гликозидная связь, чем и объясняется пре-
100
£50
0 Рис
hso;
0.2
Хп
^0
СП а>
00 О
СО CD
0.2 ,
о см
0,2™
V °-ой
0.2
jj
0,2
х,
[M(2Na)-NaHS04-Na]
B\Y
i * i
AS
JufiH.JijMHLtl
*AkJ}l
100 150 200 250 300 350 400 450 m/z
3.26. Тандемный МАЛДИ масс-спектр иона [Fuc1Gal1(S03Na)2-Na]" с m/z 507.0
90
обладание ионов Сахаров с четной степенью полимеризации в спектре на рис. 3.23. Полученные нами структуры соответствовали структурам, установленным в работе (Bilan et al., 2002), с использованием независимых методов. Таким образом, нами было показано, что использование автогидролиза как альтернативного метода деполимеризации фукоиданов позволяет надежно получать мультисульфатированные олигосахариды, отвечающие фрагментам исходного фукой дана.
В работах (Anastyuk et al., 2010; Anastyuk et al., 2012) нам удалось показать, что использование тандемной МАЛДИ МС не уступает возможностям тандемной ИЭР МС и даже имеет некоторые преимущества: удобнее работать со смесями и интерпретировать тандемные масс-спектры благодаря тому, что источник МАЛДИ продуцирует только однозарядные ионы. Возможность использовать тандемную МАЛДИ МС появилась благодаря специально подобранной нами матрице, с помощью которой удалось добиться минимальной фрагментации исследуемых образцов в ионном источнике.
Заключение
С помощью масс-спектрометрического анализа нами были исследованы структурные особенности фукоиданов из трех видов бурых водорослей: S. gurjanovae, F. evanescens, S. cichorioides. Фукоиданы из S. gurjanovaeи S. cichorioidesбыли исследованы впервые в ТИБОХ ДВО РАН (Шевченко и др., 2007). Для получения олигосахаридов, доступных для масс-спектрометрического анализа, были также впервые разработаны условия деполимеризации фукоиданов различными методами: сольволитическим десульфатированием, автогидролизом и частичным кислотным гидролизом.
Фукоидан из S. gurjanovaeбыл деполимеризован в условиях сольво-литического десульфатирования и частичного кислотного гидролиза. С помощью МАЛДИ масс-спектрометрии среди низкомолекулярных продуктов деполимеризации в процессе сольволиза кроме фукозы [Fuc+Na]+ и [FucSOJ были обнаружены нейтральные фукоолигосахари-ды: [Fucn+Na]+, n=2-ll, сульфатированные фукоолигосахариды [FucnS03], п=2-11, а также смешанные олигосахариды: [Fucn-mGalm+Na]+, n=4-6, m=l-3; [Fucn mGalmS03], n=3-6, m=l-2. Обнаружение смешанных олигосахаридов свидетельствует о блочном строении фукоидана. Протяженность блоков, построенных из фукозы, была достаточно велика и достигала 11, а возможно и более остатков. В продуктах частичного кислотного гидролиза, напротив, преобладали галактозосодержащие олигосахариды: [Galn+Na]+, n=2-5, [GalnS03], n=2-3, причем фукоза в смеси была найдена
91
только в виде ионов мономеров [Fuc+Na]+ и [FuCjSOJ и в составе иона [Fuc Gal SO ]. Размер максимального блока, построенного из галактозы, равен пяти. Интересно отметить, что в условиях кислотного гидролиза более лабильными являются гликозидные связи между остатками де-зоксигексозы (фукозы), а при сольволизе — между остатками галактозы. Впервые, с помощью химических и физико-химических методов было показано, что фукоидан из S. gurjanovaeпредставляет собой галактофукан блочного строения, сульфатированный и частично ацетилированный как по остаткам фукозы, так и галактозы. Размеры блоков, построенных из галактозы, находятся в интервале от двух до пяти, а из фукозы - от двух до одиннадцати. В среднем на 5 остатков фукозы приходилось 2-3 остатка галактозы. Исследуемый фукоидан отличается от аналогичных полисахаридов, выделенных из других видов семейства ламинариевых, которые представляют собой сульфатированные (1^3)-а-Ь-фуканы (Усов, Билан, 2009; Kusaykin et al., 2008), хотя повышенное содержание галактозы отмечалось для фукоиданов из S. japonica(Zvyagintseva et al., 2003) и S. cichorioides(Yoon et al., 2007).
Фукоидан из бурой водоросли F. evanescens, no одним данным представлял линейную цепь с чередующимися 3- и 4-связанными остатками a-L-Fucp, сульфатированными в положении 2 или много реже 2 и 4. По другим данным фракция фукоидан из F. evanescens также являлся 1^3;1^4-а-Ь-фуканом с преобладанием (1^3)-связанных остатков фукозы (1-»3:1-»4 = 3.5:1) (Kusaykin et al., 2006).
Для деполимеризации выделенного из F evanescens по методу (Kusaykin et al., 2006) фукоидана было применено сольволитическое десульфатиро-вание, в результате которого был получен набор олигосахаридов со степенью полимеризации до 6. Согласно данным масс-спектрометрического анализа (Anastyuk et al., 2009), этот фукоидан содержал протяженные участки, построенные из (1^3)-связанных остатков a-L-Fucp (до трех, и, возможно, более), сульфатированных в основном в положении С2. С помощью тандемной МАЛДИ МС (Anastyuk et al., 2012) нами были получены данные о строении основной цепи, согласующиеся с работой (Bilan et al., 2002), поскольку фукоидан в этом случае был выделен и деполимеризован в более «мягких» условиях. Было показано, что автогидролиз позволяет эффективно получать мультисульфатированные олигосахариды, отвечающие фрагментам фукоидана.
Впервые в фукоидане нами были найдены структурные фрагменты, содержащие остатки ксилозы, галактозы и глюкуроновой кислоты, обнаруженные ранее в моносахаридном составе фукоидана из F. evanescensв минорных количествах. Фрагменты, содержащие глюкуроновую кислоту на
92
восстанавливающем конце, состояли из чередующихся 3- и 4-связанных остатков a-L-Fucp. Полученные данные (Anastyuk et al., 2009) находятся в соответствии с результатами предыдущих исследований (Kusaykin et al., 2006). Кроме того, нами впервые было показано, что остатки ксилозы и галактозы включены в цепь фукоидана. Остаток ксилозы в основном 2-О-сульфатирован и может быть связан (1^4)-связью с остатками ct-L-Fucp. Остатки 2-О-сульфатированной галактозы (до двух) между собой могут быть связаны (1^4)- или (1^3)-связями, а с остатками ct-L-Fucp - (1^4)-связью. Ранее только для фукоидана бурой водоросли Fucusserratusбыло показано (Bilan et al., 2006) наличие (3-(1^4)-связанных остатков ксилозы (до шести), входящих в основную цепь.
Фукоидан из S. cichorioidesисследовался ранее в работах (Zvyagintseva et al., 2003; Yoon et al., 2007). Полученные нами данные согласуются с выводами, сделанными в работе (Zvyagintseva et al., 2003), согласно которым этот фукоидан представляет собой высокосульфатированный (1^3)-а-L-фукан, но находятся в противоречии с результатами, полученными в работе (Yoon et al., 2007), согласно которым фукоидан из S. cichorioidesпредставляет собой галактофукан (Fuc:Gal2:l), остатки ct-L-фукозы в котором (1^4)-связаны и 2,3-О-дисульфатированы. В условиях автогидролиза, впервые примененного нами для деградации фукоиданов, были получены сульфатированные и нейтральные фукоолигосахариды с максимальной степенью полимеризации (п) до 7. Результаты анализа с помощью ИЭР и МАЛДИ МС/МС сульфатированной a-L-фукозы и фукоолигосахаридов с п=2-3 показали следующее: остатки 2-0- и 4-О-сульфатированной a-L-фукозы были соединены в основном (1^3)-связями. Содержание (1^4)-связанных остатков a-L-фукозы было незначительным. Данные о структурном состоянии остатков гексозы не были получены, поскольку в продуктах деполимеризации фукоидана фрагменты, их содержащие, не были обнаружены.
При интерпретации тандемных масс-спектров сульфатированных олигосахаридов в основном были использованы результаты работ (Tissot В. et al., 2006) и (Daniel R. et al., 2007). Тем не менее, в процессе исследований нами были сделаны следующие уточнения: механизм формирования фрагментов азХ, наблюдаемых во всех сульфатированных фукоолигосаха-ридах, по-видимому, требует наличия сульфатной группы в положениях СЗ (Tissot et al., 2006) или С2 (Daniel et al., 2007), поскольку подобные сигналы не наблюдались в МС/МС спектрах олигосахаридов, содержащих уроновую кислоту на восстанавливающем конце (Anastyuk et al., 2009). На интенсивность сигналов 0,2Х в случае замещения гликозидного гидроксила влияет наличие сульфатной группы в положении С2, так
93
как сигналы 0,2Х для фукоуронидных фрагментов имели более высокую интенсивность, чем для сульфатированных фукоолигосахаридов. Следовательно, при наличии замещенного атома водорода гликозидного гидроксила механизм образования иона 0,2Х для олигосахаридов отличается от предложенного ранее (Minamisawa, Hirabayashi, 2005; Tissot et al., 2006) для сульфатированных моносахаридов. Это наблюдение позволяет точнее по соотношению интенсивностей фрагментов 0,2Х и 0,ЗХ определить положение сульфатной группы.
94