Монография исследование водорослей.. Во́доросли. Аутентичного материала
 Скачать 2.99 Mb. Скачать 2.99 Mb.
|
|
сн3 03SO °>3Х, [M2Na-NaHS04-Na] 130 140 150 160 170 180 190 200 210 220 230 240 250 260 270 280 290 300 310 320 330 340 350 360 370 m/z Рис. 3.12. Тандемный ИЭР масс-спектр иона [Fuc (SO Na) -2Na]2" c m/z 234.011 100- £75 CD о x <D \-I 3J50 с; <D О О Ь25 О HSO/ (UA 0,2д 05 СО CD о> о см см оо т—f ±4-4 в о Y CN „ CN 200 0,2 X, о ОО CN [M{2Na)-Na] 4t [M(2Na)-NaHS04-Na] °'3Xn/°'3Xf CM ^Г * CD CO -**!*-*• 100 300 400 m/z Рис. 3.13. Тандемный МАЛДИ масс-спектр иона [Fuc (SO Na) -Na]" c m/z 77 структурной единицы. Сигнал фрагментного иона, характерный для СЗ сульфатирования. в МС/МС спектрах моно- и дисульфатированной фукозы отсутствовал (Daniel et al., 2007). Применение тандемной МАЛДИ МС (а это было сделано впервые для таких образцов) для анализа смеси мультисульфатированных олигосахаридов с использованием специально подобранной матрицы (арабиноозазона) с целью уменьшения фрагментации образца в источнике ионов, по сравнению с ИЭР МС показало повышенную чувствительность к таким компонентам. Полученные данные согласуются с результатами исследований, выполненных ранее в ТИБОХ ДВО РАН (Zvyagintseva et al., 2003). Положение минорных включений остатков гексозы в структуре фукоидана из S. cichorioidesостается невыясненным, поскольку в режиме отрицательных ионов гексозосодержащих олигосахаридов зарегистрировано не было. Исследование структуры фукоидана из Fucusevanescens С помощью методов углеводной химии и ЯМР-спектроскопии М. Билан с соавторами было показано, что основная цепь фукоидана из F. evanescensпредставляет собой линейный полимер, построенный из сульфатирован-ных в основном при С-2 и частично ацетилированных остатков a-L-Fucp, соединенных чередующимися (1->3)- и (1->4)-гликозидными связями (Bilan et al., 2002). При этом была установлена структура только основной цепи фукоидана. Кусайкин с соавторами выделили из F. evanescensфракцию фукоидана, содержащую приблизительно в 3.5 раза больше (1^3)-связанных остатков фукозы, чем (1^4)-связанных (Kusaykin et al., 2006). В обеих работах представлены данные моносахаридного состава фукоидана, содержащего помимо фукозы, минорные компоненты — ксилозу, маннозу и галактозу. При этом положение этих минорных компонентов в структуре фукоидана не было установлено. В нашей работе (Anastyuk et al., 2009) мы показали, что, используя тандемную масс-спектрометрию с ионизацией электрораспылением (ИЭР МС/МС), возможно установить структурные особенности не только сульфатированных фукоолигосахаридов, но и смешанных олигосахаридов, содержащих минорные моносахариды, что не всегда доступно методам ЯМР-спектроскопии. Исследуемый нами образец фукоидана из F. evanescens(FeF2) был выделен по методу, описанному в работе (Kusaykin et al., 2006). В условиях сольволитического десульфатирования этого фукоидана помимо полимерной фракции был получен набор олигосахаридов, как в случае с фукоиданом из L. gurjanovae. Экстракцией этанолом из реакционной смеси была выделена доступная для масс-спектрометрического анализа олигосахаридная фракция Fe-dSlmf. По данным МАЛДИ МС положи- 78 тельных ионов, фракция Fe-dSlmf содержала набор интенсивных пиков, соответствующих ионам [Fuc +Na]+ (n=l-6) (см. рис.3.14, вставка). Спектр также содержал менее интенсивные сигналы, соответствующие смешанным олигосахаридам, в которых один или несколько остатков фукозы замещены остатком другого моносахарида, например, [Fuc1Pent1+Na]+ с mlz319.0 Да и [Fuc1Hex1+Na]+ с mlz349.1 Да, отстоящих от иона [Fuc2+Na]+ с mlz333.1 Да на -14 и +16 Да соответственно. Таким образом, несуль-фатированные олигосахариды, содержащие остатки пентозы и гексозы были найдены в МАЛДИ масс-спектре фракции Fe-dSlmf: [Fuc Pent+Na]+, п=1-6 и [Fuc Hex+Na]+, n=l-6.
220 240 260 280 300 320 340 360 380 400 420 440 460 480 500 520 540 560 580 600 620 640 660 680 Cojnts ys. Mass-to-Charge (rm/z) Рис. 3.14. ИЭР масс-спектр сульфатированных олигосахаридов фракции Fe-AFl, полученной из Fe-dSlmf с помощью обращенно-фазовой ВЭЖХ. Вставка содержит МАЛДИ масс-спектр положительных ионов фракции Fe-dSlmf, полученной в условиях сольволитического десульфатирования МАЛДИ масс-спектр, полученный в режиме регистрации отрицательных ионов, содержал набор интенсивных пиков ионов, соответствующих моносульфатированным фукозе и фукоолигомерам со степенью полимеризации 2—4 (данные не приведены). Это означало, что десульфатирование прошло не полностью и в смеси присутствовали сульфатированные компоненты. С целью обогащения смеси анионными компонентами фракция Fe-dSlmf была разделена с помощью обращенно-фазовой ВЭЖХ. Фракция 1 (Fe-AFl), не задержавшаяся на колонке, была проанализирована с помощью ИЭР МС в режиме регистрации отрицательных ионов. Высокая чувствительность тандемного ИЭР масс-спектрометра с времяпролетным анализатором позволила обнаружить 79 не только сульфатированные компоненты, но и фукоолигомеры, содержащие уроновую кислоту, для большей части из которых также были получены МС/МС спектры (см рис. 3.14). Согласно моносахаридному составу фракции Fe-AFl пентозе соответствует ксилоза (Xyl), гексо-зе — галактоза (Gal), уроновая кислота была идентифицирована как глюкуроновая (GlcA). Полная информация по составу данной фракции отображена в таблице 3.1. Таблица 3.1 Значения m/zосновных и минорных (*) низкомолекулярных продуктов сольволитического десульфатирования (фракция Fe-AFl) фукой дана из F. evanescensyполученные с помощью ИЭР МС
Наличие в фукоидане из F. evanescensостатков сульфатированных ксилозы (m/z229.006) и галактозы (m/z259.018), а также фрагментов, содержащих уроновую кислоту ([FucnGlcA-Na]", n=l-3), было показано нами впервые (Anastyuk et al, 2009). Каждый ион, наблюдаемый в ИЭР масс-спектре (табл. 3.1), был подвергнут фрагментации с целью извлечения структурной информации. Стоит отметить, что отдельные сигналы ионов в масс-спектре могут соответствовать нескольким изомерам, имеющим одинаковую массу, но отличающимся положением сульфатных групп, типом связи, положением остатков различных моносахаридов и др. Однако, благодаря характеристичным фрагментам, нередко становится возможным установление структурных особенностей отдельных изомеров. На рис. 3.15 представлена картина распада иона с m/z229.003, соот- 80 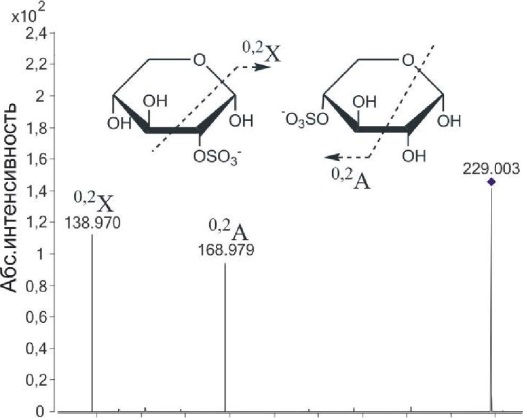 140 150 160 170 180 190 200 210 220 230 Counts vs. Mass-to-Charge (m/z) ветствующего [XylS03Na-Na] . Интенсивные фрагменты с m/z138.970 и 168.979 соответствовали двойным разрывам связей внутри кольца. Первый ион 02Х свидетельствовал о 2-0-, а второй — 0,2А — о 4-О-сульфатировании остатка ксилозы. Следовательно, исходный полисахарид содержит 2-0- и 4-О-сульфатированные остатки ксилозы. Тандемный масс-спектр иона фрагмента, содержащего кси- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
