Монография исследование водорослей.. Во́доросли. Аутентичного материала
 Скачать 2.99 Mb. Скачать 2.99 Mb.
|
|
§• «■ ™ 5,9 ■ о. * 5,8 ■ i5,7 ■ 1 5'6' °- 5 5 ■ |" U 5,3. 5,2 ' после лечения 3 мес после лечения 6 мес после лечения Рис. 7.28. Динамика изменений в содержании дифосфатидилглицерина (ДФГ) в плазме крови после лечения и последующего профилактического применения препаратов Колебания этого показателя в плазме крови при приеме системы статин 10 мг + фуколам и фуколам были идентичными. Проявлялась тенденция к росту этой фракции. Если при приеме статин 10 мг + фуколам через 3 мес эта величина составляла б,01±0,15%, а через б мес - б,17±0,15%, то при приеме фуколама через 3 мес количество ДФГ в плазме крови составляло 5,9б±0,09%, а через б мес - б,20±0,3б%. Это позитивный фактор, так как эта фракция необходима для функционирования ферментов дыхательной цепи митохондрий, что важно для энергообеспечения реакций синтеза при восстановлении структуры мембран. В других исследованиях авторы настоящей главы (Майстровский и др., 180 2010) исследовали влияние фукоидана из F. evanescensна показатели ли-пидного обмена у 60 пациентов с окклюзионными заболеваниями сосудов и ишемией нижних конечностей ПА - ША стадий по Фонтейну - Покровскому. Все пациенты были разделены на группы: пациенты 1 группы получали базовую инфузионную терапию, дезагреганты, спазмолитики. Пациенты 2 группы в дополнение к традиционной терапии получали фукоидана из Е evanescensв составе БАД «Фуколам» по 1 капсуле (500 мг) 2 раза в день в течение 21 дня. Группа контроля состояла из 30 здоровых доноров без очевидных факторов риска развития атеросклероза. Согласно последним данным Совета Экспертов и Методических рекомендаций Всероссийского научного общества кардиологов, опубликованных в 2009 году, верхняя граница нормального уровня ОХС в сыворотке крови в российской популяции составляет 6,2 ммоль/л. Однако, с позиций профилактики атеросклероза и его осложнений, желательно, чтобы уровень ОХС в сыворотке крови не превышал 5,0 ммоль/л, ТГ -1,7 ммоль/л, ЛПНП — 3,0 ммоль/л, а ЛПВП был в пределах 1,0—1,89 ммоль/л. В нашем исследовании уровень общего холестерина в сыворотке крови пациентов варьировал от нормальных значений (<5,2 ммоль/л) до высоких (>б,2 ммоль/л), средние значения в группах до начала исследования находились в пределах 5,2—6,0 ммоль/л (табл. 7.4). Таблица 7.4 Показатели липидного обмена у пациентов с облитерирующим атеросклерозом сосудов нижних конечностей
181
Примечание: 1-1- пациенты контрольной группы до лечения; 2- пациенты контрольной группы после лечения. Как видно из табл., 7.4. неблагоприятное распределение ОХС между атерогенными и антиатерогенными фракциями липопротеидов у пациентов с облитерирующим атеросклерозом сосудов нижних конечностей - накопление его в ЛПОНП и ЛПНП — приводило к увеличению индекса атерогенности, значимо отличавшегося от такового у здоровых доноров. Уровень триглицеридов находился в границах значений нормы, однако значимо отличался от средних значений в группе здоровых доноров. Наиболее высокие уровни ЛПНП определялись у пациентов с атеросклерозом сосудов нижних конечностей в сочетании с ишемической болезнью сердца (ИБС) I и II степени, гипертонической болезнью (ГБ) I и II степени при сопутствующей гиперхолестеринемии (6,0±0,6 ммоль/л). По окончании традиционного базового лечения концентрация общего холестерина в сыворотке крови пациентов контрольной группы (5,1 ±0,6 ммоль/л) не изменялась по сравнению с исходными значениями (5,2±0,8 ммоль/л) (р=0,686). Аналогичная динамика была характерна и для показателей агрессивных липидных фракций — ЛПНП, ЛПОНП и триглицеридов, уровень которых оставался на прежнем уровне (табл. 7.4). У пациентов, получавших БАД «Фуколам», наблюдалась отчетливая антиатерогенная динамика липидного обмена (рис. 7.29). Так, концентрация общего холестерина значимо снижалась с 4,9±0,6 ммоль/л до 4,1 ±0,5 ммоль/л (р=0,00). Следует подчеркнуть, что гипо-холестеринемическое действие фукоидана наблюдалось в случаях как исходно высоких (с 5,8±0,6ммоль/л до 5,1 ±0,5 ммоль/л, р=0,000, п=12), так и исходно нормальных значений показателя ОХС (с 4,1 ±0,4 ммоль/л до 3,3±0,4 ммоль/л, р=0,009, п= 10). На фоне снижения уровня общего холестерина наблюдалась нормализация его распределения между фракциями липопротеидов: концентрация ЛПВП в сыворотке крови увеличивалась с 1,0±0,2 ммоль/л до 1,3±0,4 ммоль/л, значимо отличаясь от показателя до начала лечения (р=0,000), концентрация ЛПНП 182 - снижалась с 3,2±0,7 ммоль/л до 2,1±0,4 ммоль/л, (р=0,000), что приводило к снижению индекса атерогенности с 3,9±0,7 до 2,б±0,8, (р=0,001). Уровень триглицеридов снижался у пациентов как с исходно высокими показателями (с 2,4±0,4 ммоль/л до 1,б±0,б ммоль/л, р=0,001, п=10), так и у пациентов с показателями, находящимися в границах средне-нормальных значений (рис. 7.29). Выполненные нами исследования показали, что включение БАД «Фуколам» на основе фукоидана из бурой водоросли Fucusevanescensв схему консервативной терапии больных облитерирующим атеросклерозом 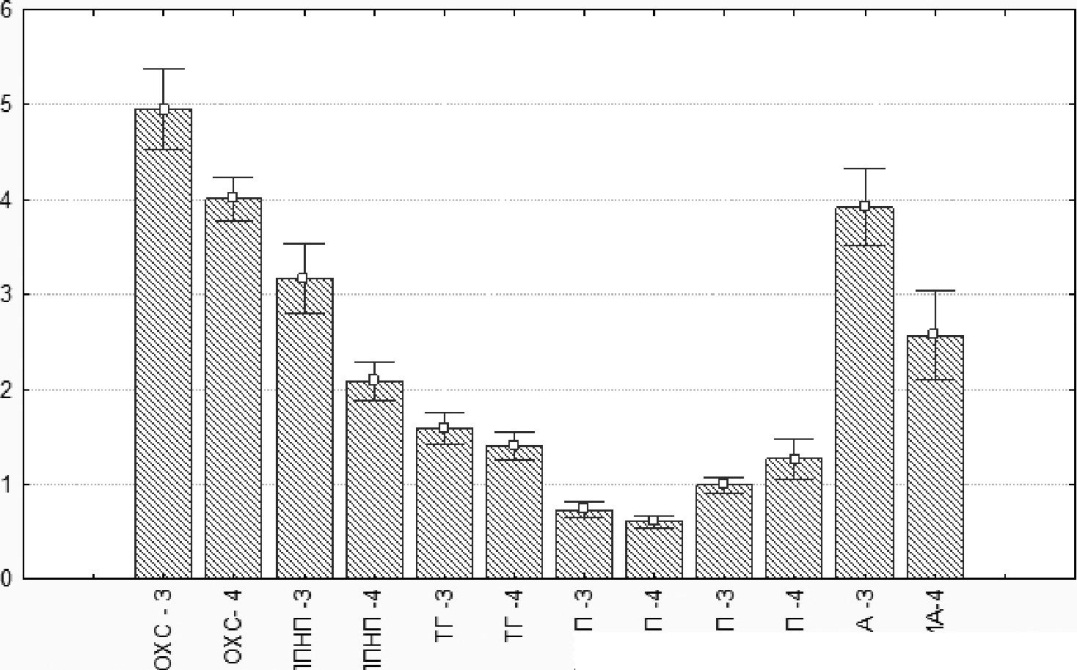
Рис. 7.29. Влияние «Фуколама» на показатели липидного обмена у пациентов с атеросклерозом сосудов нижних конечностей. По оси ординат — концентрация липидных фракций в сыворотке крови (ммоль/л); 3 — пациенты опытной группы до лечения; 4 — пациенты опытной группы после лечения сосудов нижних конечностей приводит к нормализации распределения холестерина между фракциями липопротеидов и снижению коэффициента атерогенности. Как уже отмечалось, одним из ключевых моментов в атеросклеротическом воспалении является снижение рецепторного поглощения клетками ХС ЛПНП и, как следствие, накопление его в крови и тканях где они подвергаются модификации, включающей гликозили-рование, ацетилирование и оксидацию липидов, деградацию апопроте-ина и другие химические изменения. Патогенетическое значение ЛПНП 183 определяется выраженными провоспалительными и проатерогенными свойствами — способностью к стимуляции синтеза молекул адгезии, хемокинов, факторов роста, пролиферации гладкомышечных клеток и их миграции из медии в интиму, репликации и синтезу соединительной ткани. По мнению В.В. Тертова и др. (1994), изменение структуры ЛПНП происходит из-за снижения их содержания в составе сиаловых кислот, являющихся полифункциональными соединениями с сильными кислотными свойствами. Как правило, в норме в свободном виде сиаловые кислоты не встречаются, а входят в состав различных углеводсодержа-щих веществ (гликопротеины, гликолипиды, олигосахариды). Занимая в их молекулах концевое положение, сиаловые кислоты оказывают значительное влияние на физико-химические свойства и биологическую активность этих соединений. В. Li et al. (2008) полагают, что фукоиданы, действуя подобно сиаловым кислотам, увеличивают отрицательный заряд клеточной поверхности, способствуя связыванию холестерина и желчных кислот, ответственных за транспорт жиров из кишечника в кровь(Нап L-K. et al., 2004). В свою очередь полисахариды, связываясь в просвете кишечника с желчными кислотами, способны прерывать рециркуляцию богатого холестерином пула желчных кислот и усиливать их экскрецию с фекалиями (Пискун и др., 1998; Gallaher . et al. 2002). В результате в печеночных клетках развивается дефицит холестерина, для компенсации которого увеличивается количество мембранных рецепторов к ЛПНП, обеспечивающих дополнительный клиренс ХС ЛПНП из плазмы, что, в свою очередь, ведет к снижению уровня ХС в плазме крови. Гипохолестеринемический эффект фукоидана может быть также обусловлен способностью полисахаридов слабее связывать гидрофильные желчные кислоты, способствуя увеличению в плазме относительного содержания гидрофобных желчных кислот, которые сильнее, чем гидрофильные кислоты, ингибируют активность холестерин-7 -гидроксилазы в печени (Хотимченко и др., 2005.) Другое объяснение может состоять в продукции короткоцепочечных жирных кислот (пропионовой, уксусной и масляной) при бактериальной ферментации полисахаридов, также ингибирующих синтез холестерина в печени (Хотимченко и др., 2005; Sagawa, Kato, 2003). Молекулярные механизмы изменения липидного метаболизма в настоящее время рассматриваются с учетом изменений функциональной активности макрофагов, трансформирующихся в пенистые клетки и включающей, по меньшей мере, два механизма. Один из них обусловлен связыванием модифицированных липопротеинов рецепторами, доминирующими среди которых являются скевенджер-рецепторы, другой — с действием провоспалительных цитокинов (Душкин, 2006.) с участием 184 ядерных гормональных рецепторов: PPARy (peroxisome proliferator-activated receptors — ядерных рецепторов, активирующих пролиферацию пероксисом), LXR, RAR и др.) и транскрипционных факторов — ядерного каппа-В и АР-1 (Chawla et al.,2001). В этой связи в терапии атеросклероза патогенетически обоснованными являются фармакологические и имму-нотерапевтические подходы, обеспечивающие блокирование рецепторов макрофагов и модуляцию продукции цитокинов и ингибирование транскрипционных процессов. Установленные нами противовоспалительные и гиполипидемические свойства фукоидана из бурой водоросли Fucusevanescens(в составе БАД «Фуколам») могут быть обусловлены блокированием скевенджер-рецеп-торов, для которых сульфатированные полисахариды являются лиган-дами (Jin et al., 2009), а также установленной нами ранее способностью этого полисахарида снижать исходно высокий уровень провоспалительных цитокинов, продуцируемых макрофагами — TNFa, IL-8, IL-1, IL-6 (Запорожец, 2006) и ослаблять C-FOS или C-Jun транскрипционную активность, препятствуя связанной с активатором белка-1 (АТ-1) транс-активационной деятельности (Jin et al., 2009). Гиполипидемическое действие фукоиданов может быть связано и с влиянием на адипоциты - клетки, участвующие в жировом обмене. В целом, ожирение ассоциируется со степенью дифференцировки адипо-цитов, накоплением внутриклеточных липидов и липолизом ( Shi, Burn, 2004). В 2011 году появилось сообщение М.К. Park et al. об ингибирующем эффекте фукоидана на аккумуляцию липидов, опосредованным регуляцией уровня гормончувствительной липазы (HSL), которая является ограничивающим ферментом, обеспечивающим гидролиз ТГ жирных кислот. Накопление липидов под действием фукоидана снижалось на 16,5—52,2% при дозе фукоидана 100 мкг/мл и 200 мкг/мл соответственно. Одновременно в адипоцитах снижался уровень ТГ и увеличивался - HSL. Эти исследования свидетельствуют о способности фукоидана индуцировать липолиз в адипоцитах, усиливая синтез HSL. Установленная в работе (Kim et al., 2009) способность фукоидана подавлять дифференцировку адипоцитов, опосредованную уменьшением экспрессии генов PPARy, p38MARKs, а также генов белка, связывающего жирные кислоты (АР2ацетил-КоА-карбоксилазы), является фактором, предотвращающим накопление эндогенного жира. Показано также (Yokota et al., 2009), что фукоидан стимулирует внутриклеточный транспорт липопротеинлипазы и уменьшает деградацию этого фермента в адипоцитах, что позволяет использовать его для ингибирования накопление жира. Действие фукоидана в этом случае связано с индукцией 185 экспрессии мРНК липопротеинлипазы, а также индукцией секреции аполипопротеина С-П - кофактора, ответственного за активацию липопротеинлипазы в капиллярах. Полученные результаты подтверждают и данные М.Я. Розкина (1991), показавших способность фукоиданов стимулировать липолиз путем активации фермента липопротеидлипазы. Возможные механизмы гипогликемического эффекта фукоидана также могут быть связаны с замедлением всасывания глюкозы из кишечника в кровь, стимуляцией ферментов, ответственных за утилизацию глюкозы, а также стимуляцией высвобождения инсулина. Кроме того, ли-пидопонижающий эффект фукоидана может обусловливать увеличение поглощения глюкозы периферическими тканями. Таким образом, результаты проведенных нами исследований показывают, что фукоидан, полученный из бурой водоросли F. evanescens, не только является модулятором функций врожденного и адаптивного иммунитета (Запорожец, 2006), но и обладает уникальной многокомпонентной биологической активностью, обусловленной его структурными особенностями. Сочетание противовоспалительных и иммуномодулирующих свойств с антикоагулянтной активностью, а также гиполипидемические и антиоксидантные свойства делают перспективным его использование при атеросклерозе. В современной мировой практике известны биопрепараты, по общему действию аналогичные фукоидану, однако они ограниченно представлены на отечественном рынке и обладают высокой стоимостью. В то же время уникальность химических структур, наличие сырьевой базы в Дальневосточном регионе, экологически чистые и экономичные технологии производства создают предпосылки для более широкого использования в клинической практике фукоидана из бурой водоросли F. evanescens. 186 |
